Contents
- 1 概要
- 2 骨格筋の血流調節:休息時および運動中(BLOOD FLOW REGULATION IN SKELETAL MUSCLE AT REST AND DURING EXERCISE)
- 3 骨格筋の血流速度(SKELETAL MUSCLE BLOOD FLOW RATE)
- 4 骨格筋血流の制御(CONTROL OF SKELETAL MUSCLE BLOOD FLOW)
- 5 筋血流の神経制御(Nervous Control of Muscle Blood Flow)
- 6 運動中の循環調整(CIRCULATORY READJUSTMENTS DURING EXERCISE)
- 7 交感神経系の活性化による影響(Effects of Sympathetic Activation)
- 8 交感神経刺激が運動中の動脈圧に与える影響(Sympathetic Stimulation May Increase Arterial Pressure During Exercise)
- 9 運動中の動脈圧の増加が重要な理由(Why Is Increased Arterial Pressure During Exercise Important?)
- 10 運動中の心拍出量の増加の重要性(Importance of Increased Cardiac Output During Exercise)
- 11 激しい運動中の心拍出量の変化のグラフィック解析(Graphic Analysis of Changes in Cardiac Output During Heavy Exercise)
- 12 冠動脈循環(CORONARY CIRCULATION)
- 13 冠動脈血供給の生理解剖(PHYSIOLOGIC ANATOMY OF THE CORONARY BLOOD SUPPLY)
- 14 正常な冠血流は心拍出量の5%(NORMAL CORONARY BLOOD FLOW AVERAGES 5% OF CARDIAC OUTPUT)
- 15 心筋圧迫が収縮期および拡張期に冠血流に及ぼす位相変化(Cardiac Muscle Compression Causes Phasic Changes in Coronary Blood Flow During Systole and Diastole)
- 16 心外膜対心内膜の冠血流—心筋内圧の影響(Epicardial Versus Subendocardial Coronary Blood Flow—Effect of Intramyocardial Pressure)
- 17 冠血流の制御(CONTROL OF CORONARY BLOOD FLOW)
- 18 冠血流の神経制御(Nervous Control of Coronary Blood Flow)
- 19 冠動脈の神経刺激による直接効果(Direct Effects of Nervous Stimuli on Coronary Vasculature)
- 20 代謝因子、特に心筋の酸素消費が心筋血流の主要なコントローラーです(Metabolic factors, especially myocardial oxygen consumption, are the major controllers of myocardial blood flow)
- 21 冠血流の神経制御(Nervous Control of Coronary Blood Flow)
- 22 心筋の代謝の特殊性(SPECIAL FEATURES OF CARDIAC MUSCLE METABOLISM)
- 23 虚血性心疾患(ISCHEMIC HEART DISEASE)
- 24 アテローム性動脈硬化は虚血性心疾患の主な原因です(Atherosclerosis Is a Major Cause of Ischemic Heart Disease)
- 25 急性冠動脈閉塞(Acute Coronary Artery Occlusion)
- 26 心臓の側副循環の救命的価値(Lifesaving Value of Collateral Circulation in the Heart)
- 27 冠動脈の徐々に進行するアテローム性狭窄(Gradual Atherosclerotic Narrowing of the Coronary Arteries)
- 28 心筋梗塞(Myocardial Infarction)
- 29 心内膜下梗塞(Subendocardial Infarction)
- 30 急性冠動脈閉塞後の死因(CAUSES OF DEATH AFTER ACUTE CORONARY OCCLUSION)
- 31 急性心筋梗塞からの回復の段階(STAGES OF RECOVERY FROM ACUTE MYOCARDIAL INFARCTION)
- 32 心筋梗塞からの回復後の心機能(HEART FUNCTION AFTER RECOVERY FROM MYOCARDIAL INFARCTION)
- 33 冠動脈疾患における痛み(PAIN IN CORONARY HEART DISEASE)
- 34 狭心症の薬物治療(Drug Treatment of Angina Pectoris)
- 35 冠動脈疾患の外科的治療(Surgical Treatment of Coronary Artery Disease)
概要
- 骨格筋(skeletal muscles)への血流
- 心臓(heart)への冠動脈(coronary artery)血流
これら各種血流の調整は、主に筋肉組織の代謝ニーズに応じた血管抵抗(vascular resistance)の局所的な制御によって達成されます。
また、関連する主題の生理学についても議論します、これには以下が含まれます:
- 運動中の心拍出量(cardiac output)の制御
- 心筋梗塞(heart attacks)の特性
- 狭心症(angina pectoris)の痛み
骨格筋の血流調節:休息時および運動中(BLOOD FLOW REGULATION IN SKELETAL MUSCLE AT REST AND DURING EXERCISE)
激しい運動は、体内に大量の骨格筋が存在するため、正常な循環系が直面する最もストレスの多い状況の一つです。すべての筋肉が大量の血流を必要とします。また、心拍出量は、非アスリートの場合には通常の4〜5倍、訓練されたアスリートの場合には6〜7倍に増加する必要があります。これは、運動中の筋肉の代謝ニーズを満たすためです。
骨格筋の血流速度(SKELETAL MUSCLE BLOOD FLOW RATE)
休息時、骨格筋の血流は平均して筋肉100gあたり3〜4 ml/分です。訓練されたアスリートが極端な運動を行うと、この血流は25〜50倍に増加し、筋肉100gあたり100〜200 ml/分になることがあります。持久力トレーニングを受けたアスリートの大腿筋では、ピーク血流が筋肉100gあたり最大400 ml/分に達することが報告されています。
筋収縮中の血流について、図21-1は強力なリズミカルな筋運動中の脚のふくらはぎ筋の血流変化の記録を示しています。各筋収縮に伴い血流が増減することに注目してください。収縮が終わると、血流は数秒間高いままですが、その後数分で通常に戻ります。
運動中の筋収縮フェーズで血流が低下する原因は、収縮した筋肉による血管の圧迫です。強いテタニック収縮(tetanic contraction)が血管を持続的に圧迫すると、血流はほぼ停止しますが、これは収縮の迅速な弱化も引き起こします。
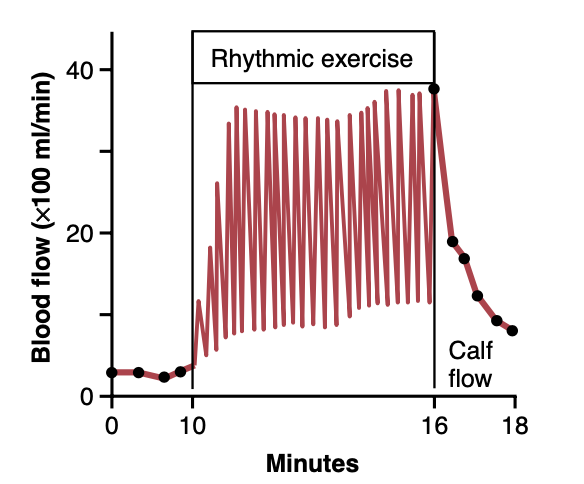
Figure 21-1. Effects of muscle exercise on blood flow in the calf of a leg during strong rhythmic contraction. The blood flow was much less during contractions than between contractions. (Modified from Barcroft H, Dornhorst AC: The blood flow through the human calf during rhythmic exercise. J Physiol 109:402, 1949.)
骨格筋血流の制御(CONTROL OF SKELETAL MUSCLE BLOOD FLOW)
筋肉内の酸素(Oxygen)が減少すると、血流が大幅に増加します。骨格筋活動中に生じる筋血流の大幅な増加は、主に局所的に放出される化学物質によって直接筋小動脈(muscle arterioles)を拡張させることで引き起こされます。最も重要な化学的効果の一つは筋組織内の酸素レベルの減少です。筋肉が活動すると、迅速に酸素を使用し、組織液内の酸素濃度を低下させます。これにより、酸素レベルの低下が血管をリラックスさせ、酸素不足が血管拡張物質の放出を引き起こすため、局所的な動脈拡張(arteriolar vasodilation)が起こります。アデノシン(Adenosine)は重要な血管拡張物質かもしれませんが、実験では、筋動脈に直接大量のアデノシンを注入しても、激しい運動中と同じ程度の血流増加は起こらず、骨格筋での血管拡張を2時間以上維持することはできませんでした。
幸いにも、筋血管がアデノシンの血管拡張効果に鈍感になった後でも、他の血管拡張因子が運動が続く限り増加した毛細血管血流を維持し続けます。これらの因子には次のものが含まれます:(1) カリウムイオン(potassium ions)、(2) アデノシン三リン酸(adenosine triphosphate, ATP)、(3) 乳酸(lactic acid)、および (4) 二酸化炭素(carbon dioxide)。これらの因子が筋血流を増加させる量を定量的にはまだ知りませんが、この主題は第17章でさらに詳しく議論されました。
筋血流の神経制御(Nervous Control of Muscle Blood Flow)
局所組織の血管拡張メカニズムに加えて、骨格筋は交感性血管収縮神経(sympathetic vasoconstrictor nerves)を備えており、動物の種によっては交感性血管拡張神経(sympathetic vasodilator nerves)も備えています。
交感性血管収縮神経線維は、神経終末でノルエピネフリン(norepinephrine)を分泌します。この機構が最大限に活性化されると、休息中の筋肉を通る血流を通常の半分から3分の1まで減少させることができます。この血管収縮は、循環ショックやその他のストレス期間中に動脈圧の低下を抑えるのに生理学的に重要であり、血圧を上げる必要がある場合もあります。
さらに、交感神経血管収縮神経終末(sympathetic vasoconstrictor nerve endings)で分泌されるノルエピネフリン(norepinephrine)に加えて、両側の副腎髄質(medullae of the adrenal glands)は、激しい運動中にノルエピネフリンを増加させ、さらにエピネフリン(epinephrine)を循環血流(circulating blood)に大量に分泌します。循環しているノルエピネフリンは、直接的な交感神経刺激と同様に、筋肉の血管に対して血管収縮効果(vasoconstrictor effect)を引き起こします。しかし、エピネフリンはしばしばわずかな血管拡張効果(vasodilator effect)をもたらします。これは、エピネフリンが血管のβアドレナリン受容体(beta-adrenergic receptors)をより多く刺激するためであり、これらは血管拡張受容体(vasodilator receptors)であるのに対し、ノルエピネフリンは主にα血管収縮受容体(alpha vasoconstrictor receptors)を刺激します。これらの受容体については第61章で議論されています。
運動中の循環調整(CIRCULATORY READJUSTMENTS DURING EXERCISE)
運動中に筋肉が必要とする大量の血流を供給するために、循環系には3つの主要な効果が生じます:(1) 多くの組織で交感神経系(sympathetic nervous system)の活性化が起こり、それに伴い循環への刺激的な影響が生じます;(2) 動脈圧(arterial pressure)の上昇;(3) 心拍出量(cardiac output)の増加です。
交感神経系の活性化による影響(Effects of Sympathetic Activation)
運動の開始時に、脳(brain)から筋肉(muscles)への信号は、筋肉の収縮(muscle contraction)を引き起こすだけでなく、血管運動中枢(vasomotor center)にも伝達され、他の多くの組織で交感神経の放出(sympathetic discharge)を開始します。同時に、副交感神経(parasympathetic)の心臓への信号は抑制されます。したがって、以下の3つの主要な循環効果が生じます:
- 心臓(heart)は、交感神経の刺激(sympathetic drive)によって心拍数(heart rate)が大幅に増加し、ポンピング強度(pumping strength)も増加します。これは、副交感神経の通常の抑制から心臓が解放されるためです。
- ほとんどの末梢循環(peripheral circulation)の小動脈(arterioles)は強く収縮しますが、活動中の筋肉内の小動脈は、筋肉内の局所的な血管拡張効果(local vasodilator effects)によって強く拡張します。したがって、心臓は筋肉に必要な増加した血流を供給しながら、同時に身体のほとんどの非筋肉部位への血流は一時的に減少し、これによって筋肉への血液供給が「貸し出される」形となります。このプロセスは、筋肉への追加の2 L/分の血流をもたらし、これは人が命を賭けて走る場合に、わずかな走行速度の増加が生死を分ける場合に非常に重要です。末梢循環の2つのシステム、すなわち冠状動脈系(coronary system)と脳循環系(cerebral system)は、この血管収縮効果から免れます。幸運なことに、これらの循環領域は血管収縮の神経支配が弱いためです。なぜなら、運動において、心臓と脳は骨格筋と同様に不可欠だからです。
- 静脈(veins)および他の容量性血管領域(capacitative areas of the circulation)の筋肉壁が強力に収縮し、全身充填圧(mean systemic filling pressure)が大幅に増加します。これは第20章で学んだように、血液が心臓へ静脈還流(venous return)するのを促進し、結果的に心拍出量(cardiac output)を増加させるための最も重要な要因の一つです。
交感神経刺激が運動中の動脈圧に与える影響(Sympathetic Stimulation May Increase Arterial Pressure During Exercise)
運動中に交感神経刺激が増加する重要な効果は、動脈圧を上昇させることです。この動脈圧の上昇は、以下を含む複数の刺激効果から生じます:(1) 脳と活動中の筋肉を除くほとんどの組織の小動脈および細動脈(small arteries)の血管収縮;(2) 心臓によるポンピング活動の増加;(3) 静脈収縮(venous contraction)による全身充填圧の大幅な増加です。これらの効果が協力して作用することで、運動中にほぼ常に動脈圧が上昇します。
運動中の動脈圧の増加が重要な理由(Why Is Increased Arterial Pressure During Exercise Important?)
実験室で筋肉が最大限に刺激された場合でも、動脈圧が上昇しない限り、筋血流(muscle blood flow)は約8倍以上には増加しません。しかし、マラソンランナーの研究から、筋血流は安静時に全身で約1 L/分であるのに対し、最大活動時には20 L/分以上に増加することがわかっています。この違いは何でしょうか?主に、通常の運動中に動脈圧が上昇することです。たとえば、激しい運動中に動脈圧が30%上昇するとします。この30%の増加は、筋組織の血管を通じて血液を押し出す力を30%増加させます。しかし、これだけが重要な効果ではありません。この追加の圧力は血管の壁を伸ばし、この効果によって、局所的に放出される血管拡張物質と高い血圧が協力して、筋血流を通常の20倍以上に増加させることができます。
運動中の心拍出量の増加の重要性(Importance of Increased Cardiac Output During Exercise)
運動中には多くの異なる生理的効果が同時に発生し、心拍出量は運動の度合いに応じてほぼ比例して増加します。実際には、運動中に筋肉への酸素やその他の栄養素を供給するために増加した心拍出量を提供できる循環系の能力は、筋肉の力と同じくらい重要で、持続的な筋肉作業の限界を設定する上で不可欠です。たとえば、心拍出量を最も増加させることができるマラソンランナーは、一般的に記録破りの走行時間を持っています。
激しい運動中の心拍出量の変化のグラフィック解析(Graphic Analysis of Changes in Cardiac Output During Heavy Exercise)
図21-2は、激しい運動中に発生する心拍出量の大幅な増加をグラフィックで分析したものです。点Aで交差する心拍出量と静脈還流の曲線は正常な循環を表しており、点Bで交差する曲線は激しい運動を表しています。心拍出量の大幅な増加には、心拍出量曲線と静脈還流曲線の両方において重要な変化が必要です。これは次のように説明されます:
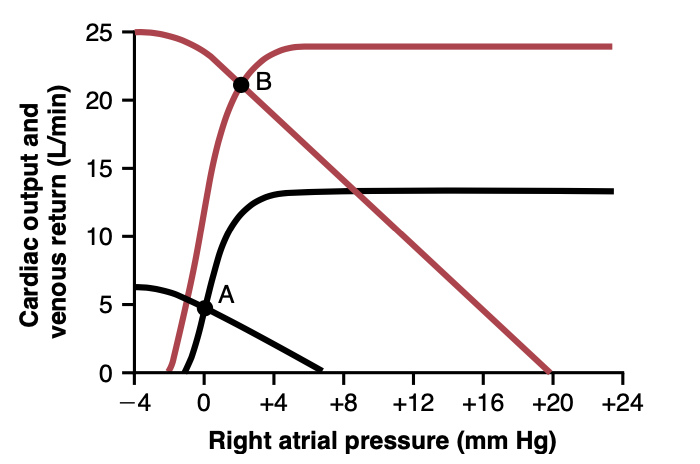
Figure 21-2. Graphic analysis of change in cardiac output, venous return, and right atrial pressure with the onset of strenuous exercise. Black curves, Normal circulation. Red curves, heavy exercise.
心拍出量曲線の増加レベルは簡単に理解できます。これはほぼ完全に心臓への交感神経の刺激によるもので、次の効果を引き起こします:(1) 心拍数の増加、最大で毎分170から190拍;(2) 心臓の収縮力の増加、通常の最大2倍。この心臓機能の増加レベルがなければ、心拍出量の増加は正常心のプラトー水準である約2.5倍の増加に限定され、訓練されていないランナーが一般的に達成できる4倍の増加や、一部のマラソンランナーが達成できる7倍の増加は達成できません。
静脈還流曲線を見てみましょう。通常の静脈還流曲線から変化がなかった場合、運動中に心拍出量はほとんど上昇できませんでした。なぜなら、通常の静脈還流曲線の上部プラトー水準は6 L/分だからです。しかし、重要な2つの変化が発生します:
- 重い運動の開始時に全身充填圧が上昇します。この効果は部分的には静脈と循環の他の容量部分を収縮させる交感神経の刺激によるものです。さらに、腹部や他の骨格筋の緊張は多くの内部血管を圧迫し、全体の容量性血管系をさらに圧迫して、全身充填圧をさらに大幅に上昇させます。最大運動中、これら2つの効果は合わせて全身充填圧を通常の7 mm Hgから最大30 mm Hgまで上昇させることができます。
- 静脈還流曲線の傾斜が上向きに回転します。この上向きの回転は、活動中の筋組織のほぼすべての血管で抵抗が減少し、それによって静脈還流への抵抗も減少するために生じます。これにより、静脈還流曲線の上向きの傾斜が増加します。
これらの変化に応じて、心拍出量曲線と静脈還流曲線の両方で新しい平衡点は図21-2の点Bとなり、通常の点Aとは異なります。特に、右心房圧はほとんど変わらず、わずかに1.5 mm Hg上昇したことに注意してください。実際には、強い心臓を持つ人では、非常に激しい運動中には心臓への交感神経の刺激が大幅に増加するため、右心房圧は通常よりも低下することがあります。対照的に、適度な運動レベルでも、心臓が弱っている患者では右心房圧が著しく上昇することがあります。
冠動脈循環(CORONARY CIRCULATION)
西洋諸国の先進国において、すべての死亡の約三分の一が冠動脈疾患(coronary artery disease)によるものであり、多くの高齢者が少なくとも何らかの冠動脈循環(coronary artery circulation)の障害を持っています。このため、冠動脈循環の正常および病理生理学(pathological physiology)を理解することは医学において最も重要な主題の一つです。
冠動脈血供給の生理解剖(PHYSIOLOGIC ANATOMY OF THE CORONARY BLOOD SUPPLY)
図21-3は、心臓とその冠動脈血供給(coronary blood supply)を示しています。主要な冠動脈(main coronary arteries)が心臓の表面に位置しており、小さな動脈が表面から心筋の塊に浸透していることに注意してください。心臓が栄養を受けるのはほぼ完全にこれらの動脈を通じてです。心内膜表面(endocardial surface)の内側一ミリメートルだけが心室内の血液から直接かなりの栄養を得ることができますが、この筋肉栄養源は微々たるものです。
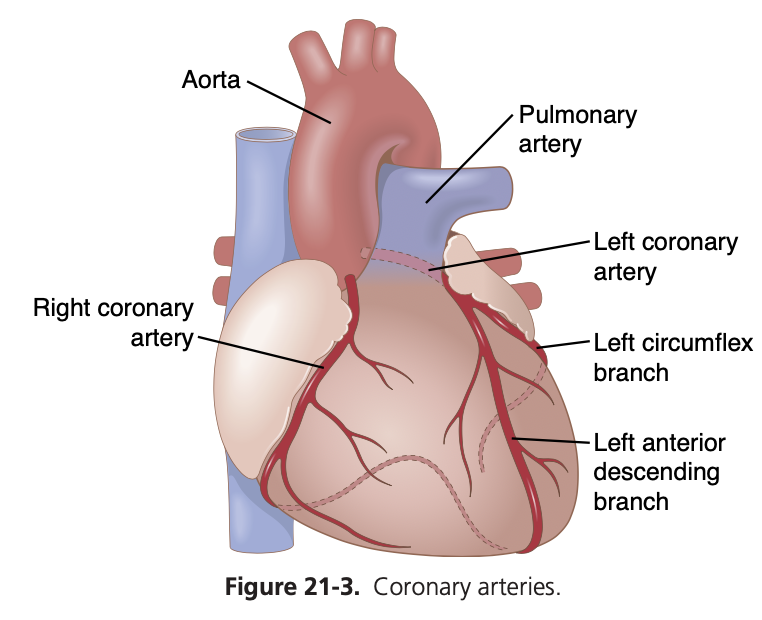
左冠動脈(left coronary artery)は主に左心室の前面および左側面を供給し、右冠動脈(right coronary artery)は右心室の大部分と、80%から90%の人々の左心室の後部を供給します。
左心室筋(left ventricular muscle)からの大部分の冠静脈血流(coronary venous blood flow)は、冠静脈洞(coronary sinus)を通じて心臓の右心房に戻り、これは総冠血流の約75%を占めます。一方、右心室筋(right ventricular muscle)からの大部分の冠静脈血は、冠静脈洞を通らずに、小さな前心筋静脈(small anterior cardiac veins)を通じて直接右心房に戻ります。非常に少量の冠静脈血も、非常に小さいテーベシアン静脈(thebesian veins)を通じて心臓のすべての室に直接戻ることがあります。
正常な冠血流は心拍出量の5%(NORMAL CORONARY BLOOD FLOW AVERAGES 5% OF CARDIAC OUTPUT)
休息時の正常な冠血流(coronary blood flow)は、心臓の重量100gあたり70 ml/分、または約225 ml/分で、これは総心拍出量(total cardiac output)の約4%から5%です。
若い成人では、激しい運動中に心臓の心拍出量(cardiac output)は4倍から7倍に増加し、この血液は通常より高い動脈圧(arterial pressure)に対してポンプされます。その結果、過酷な条件下での心臓の仕事量は6倍から9倍に増加することがあります。同時に、冠血流(coronary blood flow)も3倍から4倍に増加し、心臓に必要な追加の栄養を供給します。この増加は仕事量の増加と比べると少ないため、心臓のエネルギー消費と冠血流の比率が増加します。したがって、冠血流の相対的な不足を補うために、心臓のエネルギー利用効率が向上します。
心筋圧迫が収縮期および拡張期に冠血流に及ぼす位相変化(Cardiac Muscle Compression Causes Phasic Changes in Coronary Blood Flow During Systole and Diastole)
図21-4は、実験動物からの推定に基づいて、拡張期および収縮期の心臓の左心室冠動脈系(left ventricular coronary system)の栄養毛細血管を通る血流の変化をml/分で示しています。この図から、左心室筋(left ventricle muscle)の冠毛細血管血流は収縮期に低下し、これは体の他の血管床での流れとは反対です。この現象の理由は、収縮期の収縮による心筋内血管の強い圧迫です。
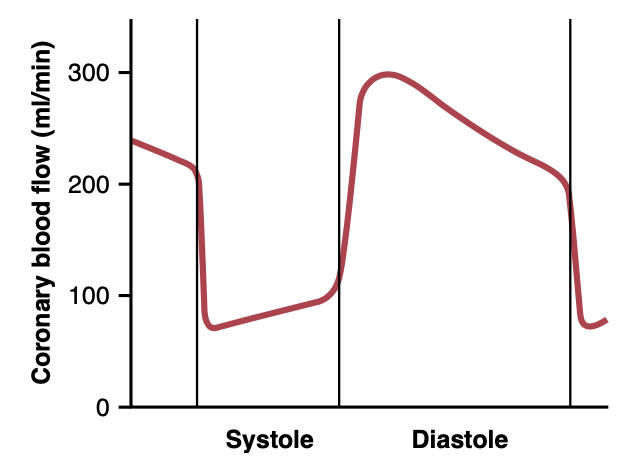
Figure 21-4. Phasic flow of blood through the coronary capillaries of the human left ventricle during cardiac systole and diastole (as extrapolated from measured flows in dogs).
拡張期には、心筋がリラックスし、左心室筋毛細血管を通る血流をもはや妨げませんので、拡張期の間、血流は迅速に流れます。
右心室の冠毛細血管を通る血流も心臓周期中に位相変化を起こしますが、右心室筋(right ventricular muscle)の収縮力は左心室筋よりもはるかに弱いため、左心室筋での位相変化と比較して部分的にのみ逆の位相変化が生じます。
心外膜対心内膜の冠血流—心筋内圧の影響(Epicardial Versus Subendocardial Coronary Blood Flow—Effect of Intramyocardial Pressure)
図21-5は心筋の異なる深さにある冠動脈の特別な配置を示しており、心筋の外表面に位置する心外膜冠動脈(epicardial coronary arteries)が大部分の筋肉に血液を供給しています。心外膜動脈から派生する小さな心筋内動脈が筋肉に必要な栄養を供給しています。心内膜直下には心内膜下動脈の叢(plexus of subendocardial arteries)があります。収縮期には、左心室の心筋内冠動脈が心室筋の収縮によって大きく圧迫されるため、心内膜下叢を通る血流は減少する傾向があります。しかしながら、心内膜下叢の追加の血管が通常この減少を補います。章の後半で、心外膜と心内膜下動脈の間の血流のこの特異な違いが、特定のタイプの冠動脈虚血(coronary ischemia)において重要な役割を果たす方法について説明します。
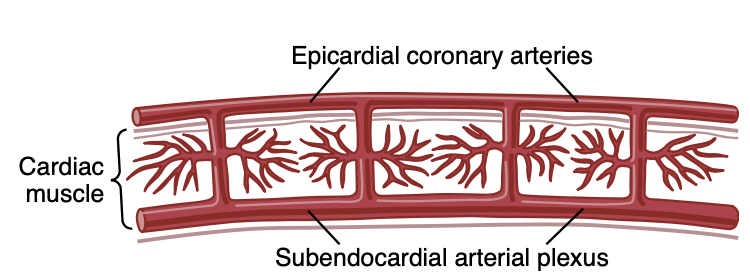
Figure 21-5. Diagram of the epicardial, intramuscular, and subendo- cardial coronary vasculature.
冠血流の制御(CONTROL OF CORONARY BLOOD FLOW)
局所筋肉代謝が冠流の主要なコントローラー(Local Muscle Metabolism Is the Primary Controller of Coronary Flow) 冠系を通る血流は、主に心筋の栄養ニーズに応じた局所小動脈の拡張によって調節されます。つまり、心臓の収縮の活発さが増すたびに、冠血流の速度も増加します。逆に、心臓の活動が減少すると冠流も減少します。この局所的な冠血流の調節は、体の多くの他の組織、特に骨格筋で起こるのと同様です。
酸素要求が局所冠血流調節の主要な要因(Oxygen Demand Is a Major Factor in Local Coronary Blood Flow Regulation)です。通常、冠動脈(coronary arteries)を通る血流は、心筋が酸素を必要とする量にほぼ正確に比例して調節されます。通常、冠動脈血中の酸素の約70%が心筋を通過するときに取り除かれます。残された酸素が少ないため、冠血流が増加しない限り心筋に追加の酸素を供給することはほとんどできません。幸いにも、心筋による追加の代謝酸素消費にほぼ直接比例して冠血流が増加します。
酸素消費の増加が冠拡張を引き起こす正確なメカニズムはまだ確定されていません。多くの研究者は、心臓内の酸素濃度の低下が筋細胞から血管拡張物質を放出させ、これらの物質が小動脈を拡張すると推測しています。強力な血管拡張作用を持つ物質にアデノシン(adenosine)があります。筋細胞内の酸素濃度が非常に低い状態では、細胞のATPの大部分がアデノシン一リン酸(AMP)に分解されます。この物質の小部分がさらに分解され、アデノシンを心筋の組織液に放出し、結果的に局所的な冠血流の増加が起こります。アデノシンによる血管拡張後、その多くは心筋細胞に再吸収され、ATPの生成に再利用されます。
アデノシンだけが特定された血管拡張産物ではありません。他にもアデノシンリン酸化合物、カリウムイオン、水素イオン、二酸化炭素、プロスタグランジン、一酸化窒素などがあります。心臓活動の増加中の冠血管拡張のメカニズムは、アデノシンだけでは完全には説明されていません。アデノシンの血管拡張効果をブロックする、または部分的にブロックする薬理学的薬剤は、心筋活動の増加による冠血管拡張を完全には防ぎません。骨格筋の研究では、アデノシンの持続的な注入が血管の拡張を1〜3時間維持することが示されましたが、アデノシンがそれ以上血管を拡張できなくても、筋活動は引き続き局所血管を拡張します。したがって、先に挙げた他の血管拡張メカニズムも覚えておくべきです。
冠血流の神経制御(Nervous Control of Coronary Blood Flow)
心臓への自律神経の刺激は、冠血流に直接および間接的に影響を与えることができます。直接的な影響は、迷走神経(vagus nerves)からのアセチルコリンと交感神経(sympathetic nerves)からのノルエピネフリンが冠動脈に作用することによるものです。間接的な効果は、心臓の活動の増加または減少によって引き起こされる冠血流の二次的な変化によるものです。
間接効果は、主に直接効果と反対の役割を果たし、通常の冠血流制御においてはるかに重要な役割を担います。したがって、交感神経の刺激は、副腎髄質(adrenal medullae)からのノルエピネフリンおよびエピネフリンの放出とともに、心拍数と心の収縮性を増加させ、心の代謝率を高めます。その結果、心の増加した代謝は、冠血管を拡張するための局所血流調節メカニズムを起動し、血流は心筋の代謝ニーズにほぼ比例して増加します。一方、迷走神経の刺激は、アセチルコリンの放出によって心臓を遅くし、心の収縮性にわずかな抑制効果をもたらします。これらの効果は心臓の酸素消費を減少させ、その結果、間接的に冠動脈を収縮させます。
冠動脈の神経刺激による直接効果(Direct Effects of Nervous Stimuli on Coronary Vasculature)
心室冠動脈系に対する副交感神経(vagal nerve)繊維の分布はそれほど多くありませんが、副交感神経の刺激によって放出されるアセチルコリンは冠動脈を直接拡張させる効果を持ちます。冠血管には遥かに広範な交感神経の支配があります。第61章で見るように、交感神経伝達物質のノルエピネフリンとエピネフリンは、血管収縮または血管拡張効果を持ち、これは血管壁に存在する収縮または拡張受容体の有無によります。収縮受容体はアルファ受容体(alpha receptors)と呼ばれ、拡張受容体はベータ受容体(beta receptors)と呼ばれます。冠血管にはアルファとベータの受容体が存在します。一般的に、心外膜冠動脈にはアルファ受容体が多く、心筋内動脈にはベータ受容体が多いかもしれません。したがって、理論上、交感神経の刺激は少なくとも全体的にはわずかな冠収縮または拡張を引き起こす可能性がありますが、通常は収縮です。一部の人々では、アルファ血管収縮効果が不釣り合いに強く、過度の交感神経刺激期間中に血管攣縮性心筋虚血を引き起こし、結果として狭心症の痛みが生じることがあります。
代謝因子、特に心筋の酸素消費が心筋血流の主要なコントローラーです(Metabolic factors, especially myocardial oxygen consumption, are the major controllers of myocardial blood flow)
神経刺激の直接効果が冠血流を減少させた場合でも、心筋の代謝制御が通常、直接の冠神経効果を数秒以内に上書きします。心臓活動の増加に伴う冠血管拡張はアデノシンによって完全には説明されていません。アデノシンの血管拡張効果をブロックする薬理学的エージェントが冠血管拡張を完全には防ぎませんが、心筋活動の増加による冠血管拡張を防ぐことはできません。骨格筋での研究でも、アデノシンの持続的な注入が血管拡張を1〜3時間維持することが示されましたが、アデノシンがもはや血管を拡張できなくても、筋活動は引き続き局所血管を拡張します。したがって、先に挙げた他の血管拡張メカニズムも重要です。
冠血流の神経制御(Nervous Control of Coronary Blood Flow)
心臓への自律神経の刺激は、冠血流に直接的および間接的な影響を与えることができます。直接効果は、神経伝達物質である迷走神経からのアセチルコリンと交感神経からのノルエピネフリンが冠動脈に作用することにより生じます。間接効果は、心臓の活動の増加または減少によって引き起こされる冠血流の二次的な変化によるものです。
間接効果は、主に直接効果と反対の作用を持ち、通常の冠血流制御においてより重要な役割を果たします。したがって、交感神経の刺激は、副腎髄質からのノルエピネフリンとエピネフリンの放出とともに心拍数と心の収縮性を増加させ、心の代謝率を高めます。これにより、心の増加した代謝は、冠血管を拡張するための局所血流調節メカニズムを起動し、血流は心筋の代謝ニーズにほぼ比例して増加します。一方、迷走神経の刺激は、アセチルコリンの放出によって心臓を遅くし、心の収縮性にわずかな抑制効果をもたらします。これらの効果は心臓の酸素消費を減少させ、その結果、間接的に冠動脈を収縮させます。
心筋の代謝の特殊性(SPECIAL FEATURES OF CARDIAC MUSCLE METABOLISM)
第68章から第73章で議論された細胞代謝の基本原則は、他の組織と同様に心筋にも適用されますが、いくつかの定量的な違いが存在します。最も重要な点は、休息時の条件下で、心筋は炭水化物よりも脂肪酸(fatty acids)をエネルギー供給源として通常より多く消費することです(エネルギーの約70%が脂肪酸から得られます)。しかし、他の組織と同様に、無酸素または虚血条件下では、心筋の代謝は無酸素解糖(anaerobic glycolysis)のメカニズムをエネルギー供給のために頼らなければなりません。しかし、解糖は大量の血糖(blood glucose)を消費し、同時に心筋組織内で大量の乳酸(lactic acid)を形成します。これは、この章で後ほど議論されるように、心筋虚血状態での心痛の原因の一つであると考えられます。
他の組織と同様に、食物から解放される代謝エネルギーの95%以上がミトコンドリアでATPの形成に使用されます。このATPは、心筋収縮およびその他の細胞機能のためのエネルギー伝達役として作用します。重度の冠動脈虚血では、ATPはまずアデノシン二リン酸(adenosine diphosphate、ADP)に、次にAMPおよびアデノシンに分解されます。心筋細胞膜はアデノシンにわずかに透過性があるため、多くのアデノシンが筋細胞から循環血液に拡散することができます。
放出されたアデノシンは、以前議論したように、冠動脈低酸素時に冠動脈小動脈を拡張させる物質の一つであると考えられています。しかし、アデノシンの喪失は深刻な細胞内結果をもたらします。心筋梗塞が発生した後、重度の冠動脈虚血が30分以内に発生すると、影響を受けた心筋細胞の約半分のアデニン塩基が失われることがあります。さらに、この損失は、新しいアデニンの合成が時速2%の割合でしか置き換えられないため、一度重度の冠動脈虚血が30分以上持続すると、虚血の解消が心細胞の損傷や死を防ぐには遅すぎる可能性があります。これは心筋虚血中の心細胞死の主要な原因の一つであるとほぼ確実に言えます。
虚血性心疾患(ISCHEMIC HEART DISEASE)
西洋諸国における死因の最も一般的な原因は虚血性心疾患であり、これは不十分な冠血流によるものです。アメリカ合衆国では65歳以上の約35%の人がこの原因で死亡します。急性冠動脈閉塞や心臓の細動により突然死が発生することもありますが、心臓ポンプ機能の進行性弱化により数週間から数年にわたってゆっくりと死亡することもあります。この章では、急性冠動脈閉塞と心筋梗塞によって引き起こされる急性冠動脈虚血について議論します。第22章では、徐々に増加する冠動脈虚血と心筋の弱化によって頻繁に引き起こされるうっ血性心不全について議論します。
アテローム性動脈硬化は虚血性心疾患の主な原因です(Atherosclerosis Is a Major Cause of Ischemic Heart Disease)
冠血流の減少の一般的な原因の一つはアテローム性動脈硬化(atherosclerosis)です。アテローム性動脈硬化の過程は、第69章で脂質代謝(lipid metabolism)と関連して議論されています。簡単に言うと、アテローム性動脈硬化の遺伝的素因を持つ人々、肥満または過体重で運動不足の人々、または高血圧があり冠血管の内皮細胞(endothelial cells of the coronary blood vessels)に損傷を与える人々では、体の至る所の動脈内の多くの点でコレステロール(cholesterol)が徐々に内皮下(beneath the endothelium)に堆積します。徐々に、これらの堆積箇所は線維組織(fibrous tissue)によって侵略され、しばしば石灰化(calcified)します。その結果、アテローム性プラーク(atherosclerotic plaques)が形成され、実際には血管腔(vessel lumens)に突出し、血流を遮断または部分的に遮断します。主要冠動脈(major coronary arteries)の最初の数センチメートルがアテローム性プラークの発達する一般的な場所です。
急性冠動脈閉塞(Acute Coronary Artery Occlusion)
冠動脈の急性閉塞は、通常、既存のアテローム性冠動脈心疾患(atherosclerotic coronary heart disease)を持つ人に発生し、正常な冠動脈循環(normal coronary circulation)を持つ人にはほとんど発生しません。急性閉塞はさまざまな原因で発生する可能性があり、以下の2つがその例です:
- アテローム性プラーク(atherosclerotic plaque)が動脈内に局所的な血栓(local blood clot、thrombus)を引き起こし、動脈を閉塞させることがあります。血栓は通常、動脈硬化性プラークが内皮を破って流れる血液と直接接触する場所で発生します。プラークが不均一な表面を提示するため、血小板(blood platelets)がそれに付着し、フィブリン(fibrin)が沈着し、赤血球が閉じ込められて血栓が形成され、血管が閉塞するまで成長します。時には、血栓がアテローム性プラークからその付着部位から離れ、冠動脈のより末梢の枝に移動してその地点で動脈を閉塞させます。このように動脈内を移動してより遠位で血管を閉塞させる血栓は冠動脈塞栓(coronary embolus)と呼ばれます。
- 多くの臨床医は、冠動脈の局所的な筋肉けいれんも発生すると考えています。このけいれんは、動脈硬化性プラークの縁による動脈壁の平滑筋への直接刺激または局所的な神経反射による過剰な冠血管壁収縮が原因で発生する可能性があります。その後、このけいれんは血管の二次的な血栓形成につながるかもしれません。
心臓の側副循環の救命的価値(Lifesaving Value of Collateral Circulation in the Heart)
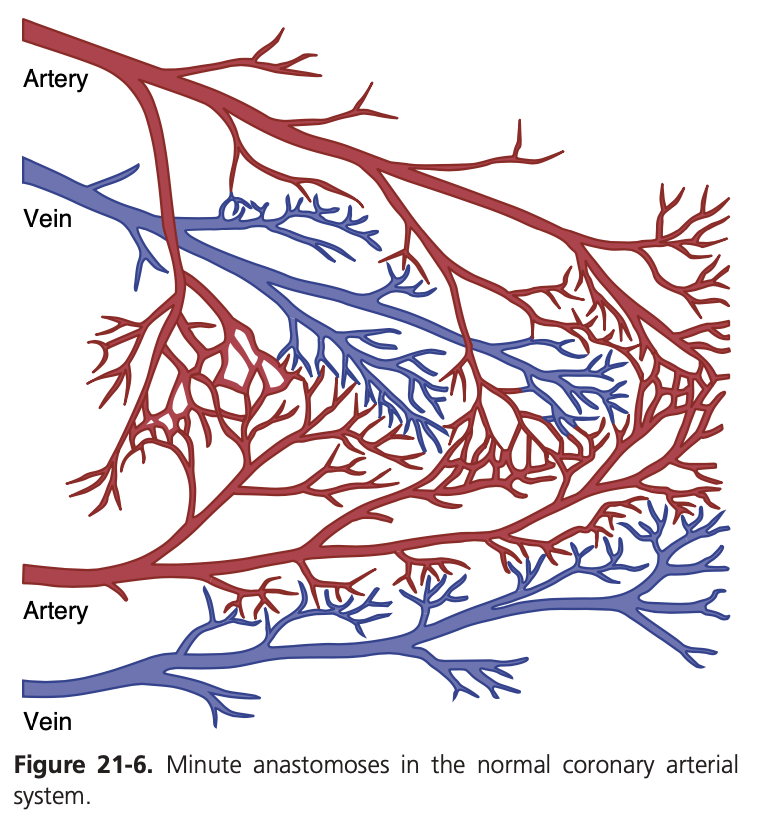
冠動脈の徐々に発達するアテローム性収縮や突然の冠動脈閉塞によって引き起こされる心筋への損傷の程度は、既に発達している側副循環(collateral circulation)の程度や閉塞後数分以内に開くことができる側副循環の程度によって大きく左右されます。正常な心臓では、大きな冠動脈間にはほとんど大きな連絡が存在しません。しかし、径が20〜250マイクロメートルの小さな動脈間には多くの吻合(anastomoses)が存在します(図21-6に示されています)。
大きな冠動脈の一つに突然閉塞が発生すると、小さな吻合は数秒以内に拡張を始めます。しかし、これら微小な側副血管を通る血流は通常、供給されるべき心筋を生存させるのに必要な量の半分以下です。側副血管の直径は次の8〜24時間でさらに大きくなることはほとんどありません。しかし、その後、側副血流は増加を始め、第二日や第三日までに倍増し、約1ヶ月以内に通常の冠血流またはほぼ通常の冠血流に達することがよくあります。これらの発達する側副チャネルのおかげで、多くの患者は、関与する筋肉の領域があまり大きくない場合、さまざまな程度の冠動脈閉塞からほぼ完全に回復します。
冠動脈の徐々に進行するアテローム性狭窄(Gradual Atherosclerotic Narrowing of the Coronary Arteries)
多年にわたりアテローム性動脈硬化が徐々に冠動脈を狭窄していく場合、側副血管が同時に発達する可能性があります。その結果、アテローム性狭窄がさらに重症化しても、その人は急性の心臓機能障害を経験することがないかもしれません。しかし、最終的には硬化過程が側副血流が必要とする血流を供給できる限界を超えることがあり、時には側副血管自体がアテローム性動脈硬化を発症します。このような場合、心筋はその働きを大幅に制限され、心臓は通常必要とされる血流量すらポンプできなくなります。これは高齢者における心不全の最も一般的な原因の一つです。
心筋梗塞(Myocardial Infarction)
急性冠動脈閉塞の直後、閉塞した冠動脈の先の血流は、周囲の血管からのわずかな側副血流を除き、ほとんど停止します。流れがほとんどないか、全くないために心筋機能を維持できない筋肉領域は、梗塞(infarcted)していると言われます。この全体の過程は心筋梗塞(myocardial infarction)と呼ばれます。
梗塞の発症直後、側副血流の小さな量が梗塞領域に浸透し始め、局所血管の進行的な拡張と組み合わせて、領域が停滞した血で過剰に満たされる原因となります。同時に、筋繊維は血中の酸素の最後の少量を使用し、ヘモグロビンを完全に脱酸素化させます。そのため、梗塞領域は青黒い褐色の色調を帯び、領域の血管が血流がないにもかかわらず充血しているように見えます。後の段階で、血管壁は高度に透過性を持ち、流体が漏れ出し、局所の筋組織は浮腫を起こし、心筋細胞は代謝の低下によって腫れ始めます。ほとんど血流がない状態が数時間続くと、心筋細胞は死にます。
心筋は、生きているためには100gの筋組織あたり毎分1.3mlの酸素が必要です。比較すると、通常の休息時の左心室には毎分100gあたり約8mlの酸素が供給されます。したがって、正常休息時の冠血流の15%から30%があれば、筋肉は死にません。しかし、大きな梗塞の中心部では、ほとんど側副血流がないため、筋肉は死にます。
心内膜下梗塞(Subendocardial Infarction)
心内膜下筋肉は、心の外表面部分に梗塞の証拠がない場合でも、しばしば梗塞します。これは、前述したように、心内膜下筋肉がより高い酸素消費を持ち、心臓の収縮期の圧縮によって血管が強く圧迫されるため、適切な血流を得るのが特に困難であるためです。したがって、心臓のどの領域の血流が低下するような状態があると、通常は最初に心内膜下領域で損傷が発生し、その後心外膜(epicardium)に向かって損傷が広がります。
急性冠動脈閉塞後の死因(CAUSES OF DEATH AFTER ACUTE CORONARY OCCLUSION)
急性心筋梗塞(acute myocardial infarction)後の最も一般的な死因は以下の通りです:
(1) 心拍出量の低下(decreased cardiac output);
(2) 肺血管(pulmonary blood vessels)での血液の鬱滞とそれに続く肺水腫(pulmonary edema)による死亡;
(3) 心臓の細動(fibrillation of the heart);時には
(4) 心臓破裂(rupture of the heart)。
心拍出量の低下—収縮期ストレッチと心臓ショック(Decreased Cardiac Output—Systolic Stretch and Cardiac Shock)
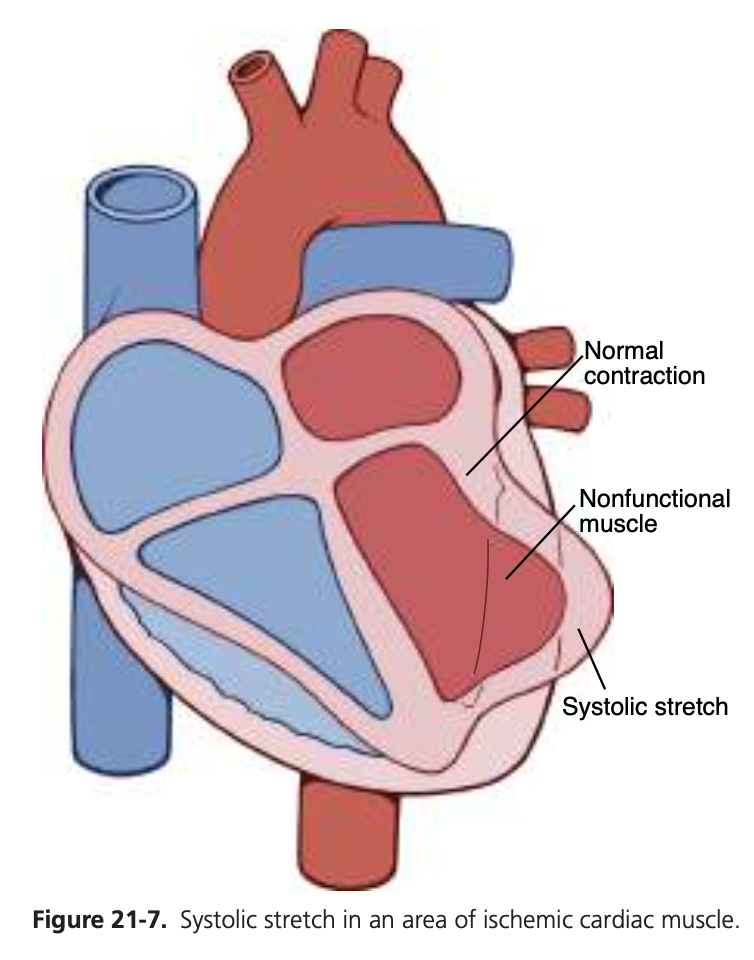
心筋の一部の繊維が機能していなかったり、他の繊維が十分な力で収縮するには弱すぎる場合、影響を受けた心室の全体的なポンピング能力は比例して低下します。心筋梗塞した心臓の全体的なポンピング力は、図21-7に示す収縮期ストレッチ(systolic stretch)という現象のため、予想以上に低下することがよくあります。つまり、心室筋の正常な部分が収縮するとき、虚血部分の筋肉は、死んでいるか単に機能していないかにかかわらず、収縮する代わりに心室内に発生する圧力によって外側に押し出されます。したがって、心室のポンピング力の多くは、機能しない心筋部分の膨らみによって失われます。
心臓が十分な力で収縮して末梢動脈樹(peripheral arterial tree)に十分な血液をポンプすることができなくなると、末梢の虚血(peripheral ischemia)により心不全(cardiac failure)と末梢組織の死が続きます。この状態は冠状動脈ショック(coronary shock)、心原性ショック(cardiogenic shock)、心臓ショック(cardiac shock)、または低心拍出量不全(low cardiac output failure)と呼ばれ、次の章で詳しく説明されます。
体の静脈系での血液の鬱滞(Damming of Blood in the Body’s Venous System)
心臓が血液を前方にポンプしない場合、それは心房(atria)および肺や全身循環の血管に血液を鬱滞させる必要があります。これにより、特に肺において毛細血管圧(capillary pressures)が上昇します。
静脈での血液の鬱滞は、心筋梗塞の最初の数時間で問題を引き起こすことはあまりありません。代わりに、症状は数日後に現れます。なぜなら、急性の心拍出量の低下が腎臓への血流を減少させるからです。その後、第22章で説明する理由により、腎臓は十分な尿を排出しなくなります。これにより、総血液量が徐々に増加し、うっ血症状(congestive symptoms)を引き起こします。その結果、心不全の発症後の最初の数日間に一見順調に見えていた多くの患者が、突然急性肺水腫を経験し、最初の肺の症状が現れてから数時間以内に死亡することがあります。
心筋梗塞後の心室細動(Fibrillation of the Ventricles After Myocardial Infarction)
冠動脈閉塞で死亡する多くの人々では、突然の心室細動(ventricular fibrillation)が死因となります。細動が発生する傾向は、大きな梗塞の後に特に強くなりますが、小さな閉塞後にも細動が発生することがあります。慢性冠不全(chronic coronary insufficiency)のある患者は、急性の梗塞を起こすことなく突然細動で死亡することもあります。
心筋梗塞後、特に危険な期間に細動が最も発生しやすくなります。最初の期間は、梗塞が発生した最初の10分間です。その後、相対的に安全な短期間が続き、次に1時間ほど後に始まる心臓の興奮性が高まる第二の期間が数時間続きます。細動は梗塞から数日後にも発生する可能性がありますが、その可能性は低くなります。
心臓が細動する傾向に関与する少なくとも4つの要因は次の通りです:
- 心筋への急性の血液供給の喪失が、虚血筋(ischemic musculature)からの急速なカリウム(potassium)枯渇を引き起こします。これにより、心筋繊維を取り巻く細胞外液(extracellular fluids)のカリウム濃度が上昇します。冠動脈系にカリウムを注入した実験では、細胞外カリウム濃度の上昇が心筋の興奮性を増加させ、その結果、細動の発生の可能性が高まることが示されています。
- 筋肉の虚血は損傷電流(injury current)を引き起こします。これは第12章で急性心筋梗塞患者の心電図(electrocardiograms)と関連して説明されています。つまり、虚血筋は心拍後に膜を完全に再分極できないことが多く、この筋肉の外部表面は心臓の他の正常な心筋膜電位と比較して負になります。したがって、この虚血領域から正常な心筋領域への電流が流れ、異常なインパルスを引き起こし、それが細動を引き起こすことがあります。
- 大規模な梗塞の後、主に心臓が動脈樹に十分な量の血液をポンプしないために血圧(blood pressure)が低下し、強力な交感神経反射(sympathetic reflexes)がしばしば発生します。交感神経の刺激も心筋の興奮性を増加させ、細動の発生を促進します。
- 心筋梗塞による心筋の弱化が、心室(ventricle)を過度に拡張させることがあります。この過度の拡張により心臓のインパルス伝導経路の長さが増加し、しばしば梗塞した心筋領域を取り囲む異常な伝導経路が発生します。この2つの効果は環行運動(circus movements)の発生を促進します。第13章で説明されているように、心室の伝導経路が過度に延長されると、インパルスが再び回復中の筋肉に再進入し、新たな興奮の循環運動サイクルを開始し、その過程が継続されます。
梗塞領域の破裂(Rupture of Infarcted Area)
急性梗塞の発生後最初の1日ほどは、虚血部分の心臓が破裂する危険はほとんどありませんが、数日後には死んだ筋肉繊維が変性し、心臓壁が非常に薄く引き伸ばされるようになります。これが起こると、死んだ筋肉が各心拍のたびに外側に大きく膨らみ、この収縮期ストレッチがますます大きくなり、最終的に心臓が破裂します。重度の心筋梗塞の進行を評価するために使用される方法の一つは、超音波心臓画像(echocardiography)、磁気共鳴画像(MRI)、またはコンピュータ断層撮影(CT)による心臓の画像記録を用いて、収縮期ストレッチの程度が悪化しているかどうかを確認することです。
心室が破裂すると、心膜腔(pericardial cavity)に血液が流れ込み、心タンポナーデ(cardiac tamponade)が急速に発生します。これは、心膜腔に血液が蓄積することによる心臓の圧迫です。この圧迫のために心臓に血液が流入せず、患者は急激な心拍出量の減少により死亡します。
急性心筋梗塞からの回復の段階(STAGES OF RECOVERY FROM ACUTE MYOCARDIAL INFARCTION)
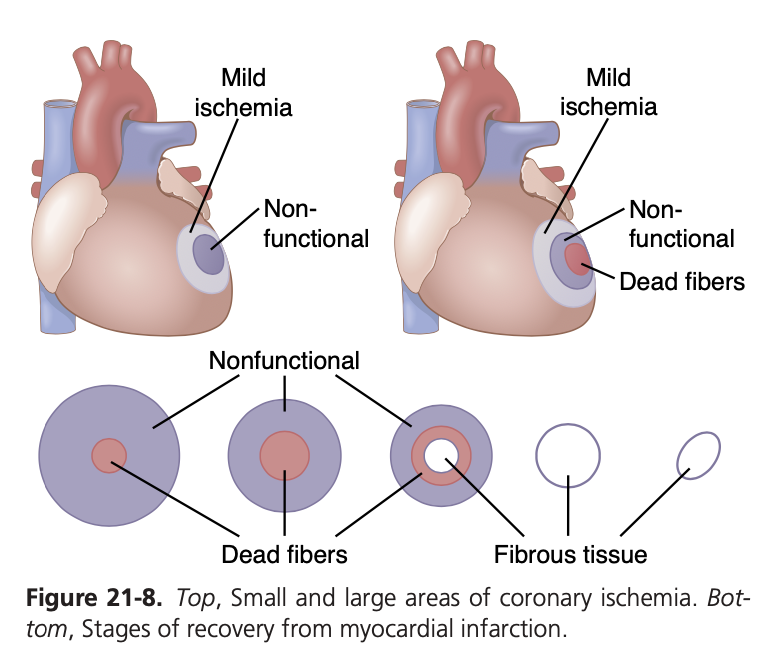
図21-8の左上部分には、小さな虚血領域を持つ患者の急性冠動脈閉塞の影響が示されており、右側には大きな虚血領域を持つ心臓が示されています。虚血領域が小さい場合、筋肉細胞の死がほとんどまたは全く起こらないことがありますが、栄養不足によって筋収縮を維持できないため、一部の筋肉は一時的に機能しなくなることがよくあります。
虚血領域が大きい場合、冠血流が完全に停止している中心部の筋繊維の一部は、1〜3時間以内に急速に死にます。死んだ領域の周囲には、収縮に失敗し、通常インパルスの伝導にも失敗する機能不全の領域が存在します。その外側には、軽度の虚血のために弱くしか収縮していない領域が周囲に広がっています。
死んだ筋肉の瘢痕組織への置換(Replacement of Dead Muscle by Scar Tissue)
図21-8の下部には、大きな心筋梗塞後のさまざまな回復段階が示されています。閉塞後すぐに、虚血領域の中心部の筋繊維が死にます。その後の数日間、この死んだ繊維の領域は拡大し、辺縁の繊維の多くが最終的に長期にわたる虚血に耐えきれず死ぬためです。同時に、梗塞領域の外側を供給する側副動脈の拡大により、機能しない筋肉の多くが回復します。数日から3週間の間に、機能不全の筋肉のほとんどが再び機能するようになるか、死にます。その間に線維芽細胞(fibroblasts)の増殖が促進され、死んだ繊維の間に線維組織(fibrous tissue)が発達し始めます。したがって、死んだ筋肉組織は次第に線維組織に置き換えられます。その後、線維組織は進行的に収縮し、数ヶ月から1年の間に瘢痕が小さくなることがあります。
最終的に、心臓の正常な領域は徐々に肥大して、死んだ心筋の損失を部分的に補います。これにより、心筋梗塞の重症度と心筋の死に応じて、心臓は数ヶ月以内に部分的またはほぼ完全に回復します。
心筋梗塞治療における安静の重要性(Value of Rest in Treating Myocardial Infarction)
心臓細胞の死の程度は、虚血の程度と心筋の負荷によって決まります。運動中、強い感情的ストレス、または疲労によって負荷が大幅に増加すると、心臓は生命を維持するために酸素と他の栄養素を必要とします。さらに、虚血領域に血液を供給する吻合血管(anastomotic blood vessels)も、通常は心臓の他の部分に血液を供給し続ける必要があります。心臓が過剰に活動すると、正常な筋肉の血管が大きく拡張します。この拡張により、冠動脈に流れ込む血液のほとんどが正常な筋肉組織を通過し、小さな吻合チャンネルを通して虚血領域に流れる血液がほとんど残りません。その結果、虚血状態が悪化し、これを冠動脈盗血症候群(coronary steal syndrome)と呼びます。そのため、心筋梗塞患者の治療において重要な要因は、回復過程で絶対的な身体の安静を守ることです。
心筋梗塞からの回復後の心機能(HEART FUNCTION AFTER RECOVERY FROM MYOCARDIAL INFARCTION)
時折、大きな心筋梗塞から回復した心臓はほぼ完全な機能能力に戻ることがありますが、より一般的には、そのポンピング能力は健康な心臓と比べて永続的に低下します。しかし、これは必ずしもその人が心臓の病者であることを意味するわけではなく、安静時の心拍出量が正常より低下していることを意味するわけでもありません。なぜなら、正常な心臓は休息時の体の要求を300%から400%以上の血液を1分間にポンプする能力を持っているからです。つまり、正常な人には300%から400%の心予備力(cardiac reserve)があります。心予備力が100%にまで減少しても、その人は通常の日常活動をほとんど行うことができますが、激しい運動は心臓に負担をかけるため行うことはできません。
冠動脈疾患における痛み(PAIN IN CORONARY HEART DISEASE)
通常、人は心臓を「感じる」ことはありませんが、虚血性心筋(ischemic cardiac muscle)はしばしば非常に強い痛みを引き起こすことがあります。この痛みの正確な原因は分かっていませんが、虚血によって心筋が酸性物質(lactic acidなど)や他の痛みを引き起こす物質(ヒスタミン(histamine)、キニン(kinins)、細胞プロテアーゼ(cellular proteolytic enzymes)など)を放出し、それが冠動脈の血流が遅くて迅速に取り除かれないことが原因であると考えられています。これらの異常な生成物の高濃度が心筋の痛みの神経終末を刺激し、感覚求心性神経線維を通じて中枢神経系に痛みのインパルスを送ります。
狭心症(Angina Pectoris, Cardiac Pain)
冠動脈が進行的に狭窄するほとんどの人で、狭心症(angina pectoris)と呼ばれる心臓の痛みが、心臓への負荷が冠血流に対して大きすぎるときに現れ始めます。この痛みは通常、心臓の上にある胸骨の下に感じられます。また、痛みは体の遠くの表面にも放散し、通常は左腕や左肩に、さらに首や顔の側面にも放散することがあります。この痛みの分布の理由は、胚発生期に心臓が首に起源を持つのと同様に、腕も首に起源を持つためです。したがって、心臓とこれらの表面領域の両方が同じ脊髄セグメントからの痛みの神経線維を受け取ります。
慢性的な狭心症を持つ多くの人は、運動をしたり、心臓の代謝を増加させたり、冠動脈が一時的に収縮したりするような感情を経験するときに痛みを感じます。狭心痛は寒冷環境や満腹状態によっても悪化し、これらはどちらも心臓の負担を増加させます。痛みは通常数分間続きますが、一部の患者は非常に重篤で持続的な虚血を持ち、痛みが常に存在することもあります。痛みはしばしば熱く、圧迫感があり、締め付けられるような性質で、通常、患者に不必要な身体活動をすべて停止させます。
狭心症の薬物治療(Drug Treatment of Angina Pectoris)
いくつかの血管拡張薬(vasodilator drugs)は、急性狭心症発作の際に投与されると、しばしば即時の痛みの軽減をもたらします。一般的に使用される短時間作用型の血管拡張薬には、ニトログリセリン(nitroglycerin)や他の硝酸薬(nitrate drugs)があります。他にも、アンジオテンシン変換酵素阻害薬(ACEi:angiotensin-converting enzyme inhibitors)、アンジオテンシン受容体遮断薬(ARBs:angiotensin receptor blockers)、カルシウム拮抗薬(CCB:calcium channel blockers)、ラノラジン(ranolazine)などが、慢性安定狭心症の治療に有益とされています。
狭心症の長期治療に使用される別の薬剤クラスは、β遮断薬(beta blockers)です。プロプラノロール(propranolol)のようなこれらの薬剤は、交感神経性βアドレナリン受容体(sympathetic beta-adrenergic receptors)を遮断し、運動や感情的なエピソード中の心拍数や心臓代謝の交感神経増強を防ぎます。したがって、β遮断薬を用いた治療は、ストレスの多い状況下での心臓の酸素代謝の需要を減少させます。この治療により、狭心症発作の回数やその重症度も減少することができます。
冠動脈疾患の外科的治療(Surgical Treatment of Coronary Artery Disease)
大動脈-冠動脈バイパス手術(Aortic-Coronary Bypass Surgery)
冠動脈虚血を持つ多くの患者では、冠動脈の狭窄部分は動脈硬化症(atherosclerotic disease)によって閉塞された離散的な数か所にあり、他の冠動脈は正常またはほぼ正常です。1960年代に、大動脈-冠動脈バイパス手術(aortic-coronary bypass surgery)または冠動脈バイパス移植術(coronary artery bypass grafting, CABG)と呼ばれる外科的手技が開発されました。この手技では、腕や脚から皮下静脈(subcutaneous vein)の一部を取り出し、大動脈の根元から動脈硬化の閉塞点を超えた末梢冠動脈の側面に移植します。このような移植が通常1〜5か所行われ、それぞれが閉塞を超えた末梢冠動脈に血液を供給します。
冠動脈バイパス手術後、多くの患者の狭心痛は緩和されます。また、手術前に心臓があまりにも酷く損傷していない患者では、このバイパス手術により患者の通常の寿命が確保されることもあります。しかし、心臓がすでに酷く損傷している場合、このバイパス手術はほとんど価値がないことがあります。
冠動脈形成術(Coronary Angioplasty)
1980年代以降、冠動脈が完全に閉塞する前に部分的に閉塞した冠動脈を開くための手技が使用されてきました。この手技は冠動脈形成術(coronary artery angioplasty)と呼ばれ、次のように実施されます。直径約1ミリメートルの小さなバルーン先端付きカテーテル(balloon-tipped catheter)がX線透視下で冠動脈に導入され、部分的に閉塞した動脈を通過して、カテーテルのバルーン部分が部分的閉塞点をまたぐまで押し進められます。その後、バルーンは高圧で膨らまされ、病変動脈を著しく拡張させます。この手技の後、血管を通る血流は通常3倍から4倍に増加し、この手技を受けた患者の75%以上が、少なくとも数年間は冠動脈虚血症状から解放されますが、多くの患者は最終的に冠動脈バイパス手術を必要とすることもあります。
冠動脈形成術で拡張された冠動脈内には、ステント(stent)と呼ばれる小さなステンレス鋼のメッシュチューブが設置されることがあり、これにより動脈を開いたままにし、再狭窄(restenosis)を防ぎます。冠動脈にステントが設置されてから数週間以内に、通常ステントの金属表面に内皮細胞(endothelium)が成長し、血液がスムーズに流れることができます。しかし、冠動脈形成術を受けた患者の約25%から40%で冠動脈の再狭窄が発生し、しばしば最初の手技から6か月以内に再発します。再狭窄は通常、ステント上に成長した健康な新しい内皮の下に過剰に形成される瘢痕組織によるものです。薬剤を徐放するステント(drug-eluting stents)は、瘢痕組織の過剰な成長を防ぐのに役立つかもしれません。
動脈硬化した冠動脈を開くための新しい手技が常に実験的に開発されています。これらの手技の一つには、冠動脈カテーテルの先端から動脈硬化病変に向けてレーザービームを使用するものがあります。このレーザーは病変を実質的に損傷することなく溶解します。


コメント