Contents
- 0.1 押さえるポイント
- 0.2 目的 (OBJECTIVES)
- 0.3 生物医学的重要性 (BIOMEDICAL IMPORTANCE)
- 0.4 特定の酵素はミトコンドリア膜によって分けられた区画に存在している (SPECIFIC ENZYMES ARE ASSOCIATED WITH COMPARTMENTS SEPARATED BY THE MITOCHONDRIAL MEMBRANES)
- 0.5 呼吸鎖は還元当量を酸化し、プロトンポンプとして機能する (THE RESPIRATORY CHAIN OXIDIZES REDUCING EQUIVALENTS & ACTS AS A PROTON PUMP)
- 0.6 呼吸鎖を介した電子輸送がプロトン勾配を作り、ATP合成を駆動する (ELECTRON TRANSPORT VIA THE RESPIRATORY CHAIN CREATES A PROTON GRADIENT WHICH DRIVES THE SYNTHESIS OF ATP)
- 0.7 呼吸鎖は異化過程で捕らえられるエネルギーの大部分を提供する (THE RESPIRATORY CHAIN PROVIDES MOST OF THE ENERGY CAPTURED DURING CATABOLISM)
- 0.8 多くの毒物は呼吸鎖を阻害する (MANY POISONS INHIBIT THE RESPIRATORY CHAIN)
- 0.9 化学浸透説は呼吸制御とアンカップラーの作用を説明できる (THE CHEMIOSMOTIC THEORY CAN ACCOUNT FOR RESPIRATORY CONTROL AND THE ACTION OF UNCOUPLERS)
- 1 ミトコンドリア内膜の選択的透過性により交換輸送体が必要となる (THE SELECTIVE PERMEABILITY OF THE INNER MITOCHONDRIAL MEMBRANE NECESSITATES EXCHANGE TRANSPORTERS)
押さえるポイント
- Biologic Oxidation(生物学的酸化)
● Key feature of biologic oxidation(生物学的酸化の主要な特徴は何ですか?)
生物学的酸化は、分子の電子(electrons)の移動を伴う酸化還元反応(oxidation-reduction reactions)です。このプロセスにおいてエネルギーが解放され、ATP生成のために使われます。
● Role of oxygen in these reactions(酸素はこれらの反応でどのような役割を果たしますか?)
酸素(Oxygen)は、電子伝達系(electron transport chain)の最終的な電子受容体(terminal electron acceptor)として機能し、水(H2O)を生成します。
● Where in the cell does biologic oxidation primarily occur?(生物学的酸化は細胞のどこで主に行われますか?)
ミトコンドリア(mitochondria)の内膜(inner membrane)で行われます。 - Role of NAD+ in Oxidation Reactions(酸化反応におけるNAD+の役割)
● Function of NAD+(NAD+の役割は何ですか?)
NAD+(ニコチンアミドアデニンジヌクレオチド)は、酸化還元反応で電子を受け取り還元型のNADHとなり、エネルギー生成に重要な役割を果たします。
● NAD+ and electrons in the electron transport chain(NAD+は電子伝達系でどのように電子と相互作用しますか?)
NADHは電子伝達系の複合体I(Complex I)に電子を供給し、エネルギー生成のためのプロトンポンプ活動を引き起こします。 - Enzymes in Electron Transfer(電子移動に関与する酵素)
● Enzymes involved in transferring electrons during cellular respiration(細胞呼吸中に電子を移動させる酵素は何ですか?)
主に複合体I(Complex I)、複合体II(Complex II)、複合体III(Complex III)、複合体IV(Complex IV)が関与します。
● Role of cytochrome c oxidase (Complex IV)(シトクロムcオキシダーゼの役割は何ですか?)
シトクロムcオキシダーゼ(cytochrome c oxidase)は、電子を酸素に転送し、水を生成します。同時にプロトンをミトコンドリア膜間スペースに移動させ、プロトン勾配を形成します。 - Electron Transport Chain (ETC)(電子伝達系)
● Function of Complex II(複合体IIの役割は何ですか?)
複合体II(Complex II)は、FADH2から電子を受け取り、それを電子伝達系に供給しますが、プロトンポンプとしては機能しません。
● How do electrons from FADH2 enter the electron transport chain?(FADH2からの電子はどのように電子伝達系に入りますか?)
FADH2は複合体IIに電子を供給し、これが後の複合体に移動します。 - Proton Gradient Contributors(プロトン勾配の寄与因子)
● Which complexes contribute to the proton gradient?(どの複合体がプロトン勾配に寄与しますか?)
複合体I、III、IVがプロトンをミトコンドリア内膜を越えて汲み上げ、プロトン勾配を形成します。
● Why is Complex II unique?(複合体IIが他と異なるのはなぜですか?)
複合体IIはプロトンを汲み上げないため、他の複合体とは異なります。 - Primary Electron Source in ETC(電子伝達系における主な電子源)
● What are the primary sources of electrons?(主な電子源は何ですか?)
NADHとFADH2が主な電子源です。これらはそれぞれ複合体Iと複合体IIに電子を供給します。
● How do NADH and FADH2 contribute to energy production?(NADHとFADH2はエネルギー生成にどのように寄与しますか?)
NADHは複合体Iを通じて、FADH2は複合体IIを通じて電子伝達系に電子を供給し、プロトン勾配を形成しATP合成を促進します。 - Mobile Electron Carrier(可動性電子キャリア)
● Which coenzymes act as mobile electron carriers?(どの補酵素が可動性電子キャリアとして働きますか?)
ユビキノン(コエンザイムQ、coenzyme Q)とシトクロムc(cytochrome c)が電子伝達系における可動性電子キャリアです。
● How do cytochrome c and coenzyme Q function?(シトクロムcとコエンザイムQはどのように機能しますか?)
コエンザイムQは複合体IやIIから複合体IIIへ、シトクロムcは複合体IIIからIVへ電子を移動させます。 - Cyanide Inhibition(シアン化物阻害)
● How does cyanide inhibit cellular respiration?(シアン化物はどのように細胞呼吸を阻害しますか?)
シアン化物(cyanide)はシトクロムcオキシダーゼ(複合体IV)を阻害し、酸素への電子の移動を妨げます。
● Which complex is affected by cyanide?(シアン化物に影響される複合体はどれですか?)
複合体IVが影響を受け、その結果ATP生成が停止します。 - ATP Synthesis Channel(ATP合成チャネル)
● What is the name of the enzyme complex that synthesizes ATP?(ATPを合成する酵素複合体の名称は何ですか?)
ATP合成酵素(ATP synthase)です。
● How does the proton gradient drive ATP synthesis?(プロトン勾配はどのようにATP合成を促進しますか?)
プロトンがATP合成酵素を通過するとき、そのエネルギーがATPの生成に使われます。 - ATP Yield in Aerobic Respiration(好気性呼吸におけるATP生成量)
● Which process produces the most ATP?(最も多くのATPを生成する過程はどれですか?)
酸化的リン酸化(oxidative phosphorylation)が最も多くのATPを生成します。
● How does oxidative phosphorylation compare to glycolysis and the citric acid cycle?(酸化的リン酸化は解糖系およびクエン酸回路と比べてどのようにATP生成量が異なりますか?)
酸化的リン酸化は、解糖系(glycolysis)やクエン酸回路(citric acid cycle)よりもはるかに多くのATPを生成します。 - Terminal Electron Acceptor(終末電子受容体)
● What molecule serves as the terminal electron acceptor?(終末電子受容体として働く分子は何ですか?)
酸素(Oxygen)が終末電子受容体として機能し、水(H2O)を生成します。
● Why is the terminal electron acceptor important?(終末電子受容体はなぜ重要ですか?)
酸素が電子を受け取ることにより、電子伝達系を通じてエネルギーが効率的に放出され、ATP合成が可能となります。酸素の受け取りがないと、電子伝達系が停止し、ATPの生成も停止します。 - Regulation of Oxidative Phosphorylation(酸化的リン酸化の調節)
● What factors regulate the rate of oxidative phosphorylation?(酸化的リン酸化の速度を調節する要因は何ですか?)
ADP濃度(ADP concentration)、酸素供給量、NADHとFADH2の供給量が主な調節因子です。
● How does ADP concentration affect ATP production?(ADP濃度はATPの生成にどのように影響しますか?)
ADP濃度が高いほどATP合成が促進されます。ADPが不足している場合、酸化的リン酸化の速度は低下します。 - Mitochondrial Uncoupling(ミトコンドリアの脱共役)
● Effect of mitochondrial uncoupling on ATP synthesis and heat production(ミトコンドリアの脱共役がATP合成と熱産生に与える影響は何ですか?)
脱共役(uncoupling)により、プロトンがATP合成酵素を通過せずにミトコンドリア内膜を横切るため、ATP合成が減少し、そのエネルギーが熱として放出されます。
● Why is uncoupling important for thermogenesis?(脱共役が熱生成にとって重要なのはなぜですか?)
脱共役は、体温を維持するために熱を生成する役割を果たします。特に褐色脂肪組織(brown adipose tissue)での熱生成に寄与します。 - P/O Ratio for NADH(NADHのP/O比)
● What is the P/O ratio for NADH oxidation?(NADH酸化のP/O比は何ですか?)
NADHのP/O比はおよそ2.5です。これはNADHが酸化される際に、約2.5分子のATPが生成されることを意味します。
● How does the P/O ratio reflect the efficiency of ATP production?(P/O比はATP生成の効率をどのように反映しますか?)
P/O比は、酸化的リン酸化におけるエネルギー効率を示し、高いP/O比はATP生成が効率的であることを意味します。 - Function of Complex III(複合体IIIの機能)
● Role of Complex III in electron transport(電子伝達における複合体IIIの役割は何ですか?)
複合体III(Complex III)は、ユビキノン(coenzyme Q)からシトクロムcへ電子を転送します。
● How does Complex III contribute to both electron transfer and proton pumping?(複合体IIIはどのように電子移動とプロトンポンピングに寄与しますか?)
複合体IIIは電子の移動と同時に、ミトコンドリア内膜を越えてプロトンを汲み上げ、プロトン勾配を形成します。 - ΔG°’ and Reaction Energetics(ΔG°’と反応のエネルギー特性)
● What does a negative ΔG°’ value indicate?(負のΔG°’値は生化学反応の方向について何を示しますか?)
負のΔG°’値は、反応が自発的(spontaneous)に進むことを示します。
● How does ΔG°’ relate to the spontaneity of a reaction?(ΔG°’は反応の自発性にどのように関係しますか?)
負のΔG°’は反応がエネルギーを放出し自発的に進むことを示し、正のΔG°’は反応がエネルギーを必要とすることを意味します。 - ΔG°’ and Keq Relationship(ΔG°’と平衡定数Keqの関係)
● Relationship between ΔG°’ and Keq(ΔG°’と平衡定数の関係は何ですか?)
ΔG°’はKeqと対数関数で関係しています。Keqが1より大きい場合、ΔG°’は負になります。
● How can you use Keq to predict the direction of a reaction?(Keqを使って反応の方向を予測するにはどうすればよいですか?)
Keqが1より大きければ、生成物が優勢で反応は前進します。Keqが1より小さければ、反応物が優勢で逆方向に進む傾向があります。 - Substrate-Level Phosphorylation(基質レベルのリン酸化)
● What is substrate-level phosphorylation?(基質レベルのリン酸化とは何ですか?)
基質レベルのリン酸化(substrate-level phosphorylation)は、酵素によって基質から直接リン酸基が転移され、ATPが生成される過程です。
● In which metabolic pathways does it occur?(基質レベルのリン酸化はどの代謝経路で行われますか?)
解糖系(glycolysis)とクエン酸回路で行われます。 - Energy Conservation in Biological Systems(生物系におけるエネルギー保存)
● How is energy conserved during biochemical reactions?(生化学反応中にエネルギーはどのように保存されますか?)
エネルギーはATPやNADHの形で保存され、これによりエネルギーが後で使用される際に効率的に供給されます。
● How is chemical energy stored in biological molecules?(生物分子において化学エネルギーはどのように保存されますか?)
化学エネルギーは、主に高エネルギーリン酸結合(ATP)や還元型補酵素(NADH、FADH2)に保存されます。 - Enzyme for High-Energy Phosphate Transfer(高エネルギーリン酸転移を行う酵素)
● Which enzymes are responsible?(高エネルギーリン酸結合の転移を担う酵素はどれですか?)
ホスホキナーゼ(phosphokinases)やクレアチンキナーゼ(creatine kinase)などが含まれます。
● Role in energy metabolism(これらの酵素はエネルギー代謝でどのような役割を果たしますか?)
これらの酵素はATPの合成やクレアチンリン酸からのエネルギー供給により、細胞内でエネルギーを迅速に提供します。 - Role of Creatine Phosphate(クレアチンリン酸の役割)
● Function of creatine phosphate in muscle cells(筋細胞におけるクレアチンリン酸の役割は何ですか?)
クレアチンリン酸(creatine phosphate)は、ATPを迅速に再合成するための高エネルギーリン酸供給源として機能します。これにより、筋収縮時の短時間の高エネルギー需要に対応します。
● How does creatine phosphate help maintain ATP levels?(クレアチンリン酸はどのようにしてATPレベルを維持しますか?)
高エネルギーのクレアチンリン酸は、クレアチンキナーゼ(creatine kinase)によってADPにリン酸基を供与し、ATPを迅速に生成します。 - Energy Released from ATP Hydrolysis(ATP加水分解によるエネルギーの放出)
● How much energy is released by the hydrolysis of ATP?(ATPの加水分解でどのくらいのエネルギーが放出されますか?)
標準条件下で、ATPの加水分解により約7.3 kcal/molのエネルギーが放出されます。
● Why is ATP hydrolysis considered a high-energy reaction?(なぜATP加水分解は高エネルギー反応と見なされるのですか?)
ATPの末端リン酸基の結合は不安定であり、その加水分解によりエネルギーが大きく放出されるため、ATP加水分解は高エネルギー反応とされます。 - Highest Phosphoryl Transfer Potential(最高のリン酸転移ポテンシャル)
● Which molecules have high phosphoryl transfer potential?(高いリン酸転移ポテンシャルを持つ分子はどれですか?)
ホスホエノールピルビン酸(PEP)、1,3-ビスホスホグリセリン酸(1,3-BPG)、クレアチンリン酸(creatine phosphate)が高いリン酸転移ポテンシャルを持ちます。
● How is phosphoryl transfer potential related to energy transfer?(リン酸転移ポテンシャルはエネルギー移転とどのように関係しますか?)
高いリン酸転移ポテンシャルを持つ分子は、リン酸基を他の分子に容易に転移し、エネルギーを供給することができます。 - Primary Driver of ATP Synthesis(ATP合成の主な駆動因子)
● What drives the synthesis of ATP in mitochondria?(ミトコンドリアでのATP合成を駆動するものは何ですか?)
プロトン駆動力(proton motive force)がATP合成酵素を通じてATPの生成を駆動します。
● How does the proton motive force relate to ATP production?(プロトン駆動力はどのようにATP生成に関係しますか?)
ミトコンドリア内膜を越えてプロトンがATP合成酵素を通過する際に、そのエネルギーを利用してADPと無機リン酸(Pi)からATPを生成します。 - Role of Thermodynamics in Bioenergetics(熱力学の生物エネルギー学における役割)
● How does thermodynamics predict the direction of biochemical reactions?(熱力学はどのように生化学反応の方向を予測しますか?)
自由エネルギー変化(ΔG)が負であれば反応は自発的に進み、正であれば外部からのエネルギーが必要となります。
● What role does free energy (ΔG) play in bioenergetic processes?(自由エネルギー(ΔG)は生物エネルギー学の過程でどのような役割を果たしますか?)
自由エネルギー(ΔG)は、反応の進行の方向性とエネルギーの供給または必要性を示し、反応の可逆性やATP生成の効率を評価する上で重要です。
目的 (OBJECTIVES)
この章を学んだ後、以下のことができるようになります:
- ミトコンドリアの二重膜構造を説明し、各酵素の位置を示すことができる。
- 燃料基質(脂肪、炭水化物、アミノ酸)の酸化からのエネルギーがほぼ全てミトコンドリアで生成されること、そしてこの過程が「電子伝達 (electron transport)」と呼ばれることを理解する。ここで電子は一連の複合体(呼吸鎖)を通過し、最終的に酸素と反応して水を形成する。
- 電子伝達に関与する4つのタンパク質複合体を説明し、フラボタンパク質 (flavoproteins)、鉄-硫黄タンパク質 (iron-sulfur proteins)、コエンザイムQ (coenzyme Q) の役割を説明する。
- コエンザイムQがどのようにしてNADHからComplex Iを経由して、FADH2からComplex IIを経由して電子を受け取るのかを説明する。
- 還元型コエンザイムQがどのようにしてComplex IIIを介してシトクロムc (cytochrome c) に電子を渡すのかを示す。
- 還元型シトクロムcが酸化され、酸素が還元されて水になる過程をComplex IVを通じて説明する。
- 電子伝達がどのようにしてミトコンドリア内膜にプロトン勾配を生成し、それが酸化的リン酸化 (oxidative phosphorylation) によってATPを生成するプロトン駆動力を生み出すのかを説明する。
- ATP合成酵素 (ATP synthase) の構造を説明し、どのようにしてADPと無機リン酸 (Pi) からATPを生成する回転モーターとして機能するのかを説明する。
- 通常、還元当量の酸化(呼吸鎖を介しての)と酸化的リン酸化が密接に結合しており、どちらか一方が機能していなければもう一方も進行しないことを説明する。
- 呼吸または酸化的リン酸化を阻害する一般的な毒物の例を挙げ、それらの作用部位を示す。
- アンカップラー (uncouplers) がどのようにして呼吸鎖を介した酸化と酸化的リン酸化を分離して毒物として作用するのか、また身体の熱を生成する生理的役割も持つ場合があることを例と共に説明する。
- ミトコンドリア内膜に存在する交換輸送体 (exchange transporters) の役割を説明し、イオンや代謝物が通過できるようにしながら電気化学的および浸透平衡を保つ。
ミトコンドリアの二重膜構造
ミトコンドリアは外膜 (outer membrane) と内膜 (inner membrane) の二重膜構造を持っています。
- 外膜 (Outer Membrane): 外膜には大きなチャネルタンパク質(ポリン)が存在し、比較的透過性が高く、小さな分子が自由に通過できます。
- 内膜 (Inner Membrane): 内膜はクリステ (cristae) と呼ばれる折りたたみ構造があり、非常に選択的で、プロトンや特定の分子だけが輸送体を介して通過します。内膜にはATP合成酵素 (ATP synthase)、電子伝達系 (electron transport chain) の複合体、輸送体などの重要な酵素が存在しています。
燃料基質の酸化と電子伝達
脂肪、炭水化物、アミノ酸などの燃料基質は、ミトコンドリアで酸化され、エネルギーを生成します。このエネルギー生成過程は電子伝達 (electron transport) と呼ばれ、電子は一連のタンパク質複合体(呼吸鎖、respiratory chain)を通過し、最終的に酸素と結合して水を形成します。
電子伝達に関与する4つのタンパク質複合体
- Complex I (NADH: Ubiquinone oxidoreductase)
NADHから電子を受け取り、フラボタンパク質 (flavoprotein) と鉄-硫黄タンパク質 (iron-sulfur protein) を介してコエンザイムQ (Coenzyme Q) に電子を渡します。 - Complex II (Succinate dehydrogenase)
FADH₂から電子を受け取り、鉄-硫黄タンパク質を介してコエンザイムQに電子を渡します。Complex IIはクエン酸回路 (citric acid cycle) と呼吸鎖の一部として機能します。 - Complex III (Cytochrome bc1 complex)
コエンザイムQから電子を受け取り、シトクロムc (Cytochrome c) に電子を渡します。この過程ではプロトンが内膜を越えてミトコンドリア間質から膜間空間に移動します。 - Complex IV (Cytochrome c oxidase)
シトクロムcから電子を受け取り、酸素を水に還元します。この複合体でもプロトンが内膜を越えて移動し、プロトン勾配を強化します。
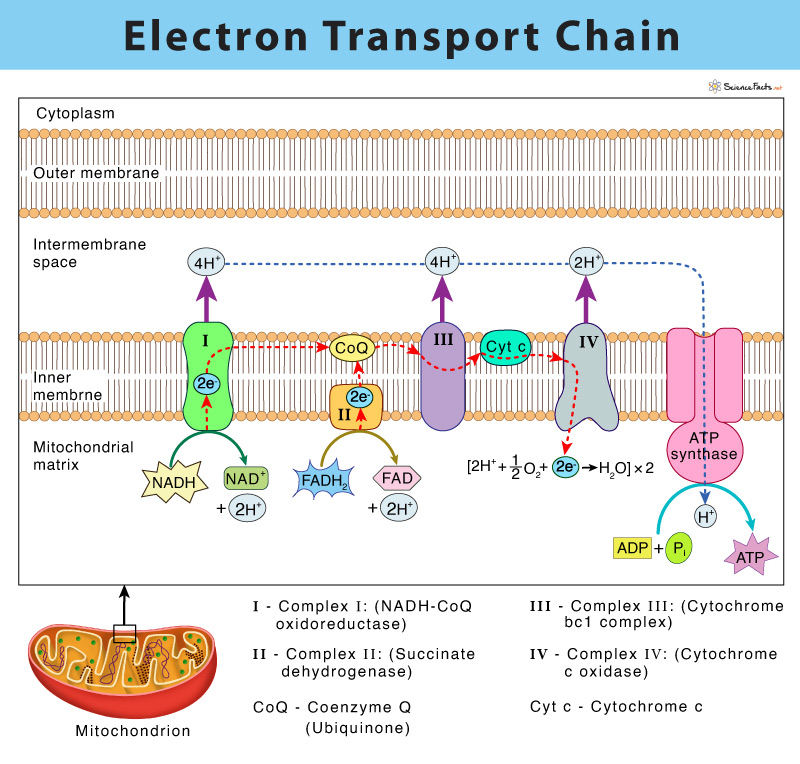
電子伝達とプロトン勾配の生成
電子伝達系では、電子が各複合体を通過する際に、プロトンがミトコンドリア内膜を越えてミトコンドリア基質(マトリックス)から膜間空間に汲み出されます。このプロトンの移動により、ミトコンドリア内膜を挟んでプロトン勾配(濃度差と電気的差)が生成されます。このプロトン勾配は、酸化的リン酸化 (oxidative phosphorylation) によってATPを生成するためのエネルギー源、すなわちプロトン駆動力 (proton motive force) を形成します。
ATP合成酵素 (ATP Synthase) の構造と機能
ATP合成酵素 (ATP synthase) は、ミトコンドリア内膜に存在する大きな複合体で、F₀とF₁の2つの部分で構成されています。
- F₀部分: プロトンが内膜を通過する通路を提供します。このプロトンの流れがATP合成酵素の回転を引き起こします。
- F₁部分: 回転運動を化学エネルギーに変換し、ADPと無機リン酸 (Pi) からATPを生成します。このプロセスは、まるで「回転モーター」のように機能し、ATPが生成されます。
還元当量の酸化と酸化的リン酸化の結合
通常、電子伝達系(呼吸鎖)を介した還元当量(NADHやFADH₂)の酸化と酸化的リン酸化は密接に結合しており、電子伝達によって生成されるプロトン勾配がATPの合成に利用されます。このため、どちらか一方のプロセスが阻害されると、もう一方のプロセスも停止します。
呼吸または酸化的リン酸化を阻害する毒物の例
- シアン化物 (Cyanide) と一酸化炭素 (Carbon monoxide): Complex IVを阻害し、酸素への電子の伝達を防ぎます。
- ロテノン (Rotenone): Complex Iを阻害し、NADHからの電子の流れを止めます。
- アンチマイシンA (Antimycin A): Complex IIIを阻害し、電子のシトクロムcへの伝達を阻止します。
アンカップラー (Uncouplers) の作用と役割
アンカップラー (uncouplers) は、プロトン勾配を破壊することで、電子伝達系を介した酸化と酸化的リン酸化を分離します。例えば、2,4-ジニトロフェノール (2,4-Dinitrophenol, DNP) はプロトンを内膜を通じて運搬し、プロトン駆動力を消散させます。これによりATP合成が阻害され、エネルギーが熱として放出されます。生理的な例としては、褐色脂肪組織 (Brown adipose tissue) に存在するサーモゲニン (Thermogenin) というアンカップラーがあり、体温調節のために熱を生成します。
ミトコンドリア内膜に存在する交換輸送体 (Exchange Transporters) の役割
ミトコンドリア内膜には、ATP-ADPトランスロカーゼ (ATP-ADP translocase) やリン酸輸送体 (Phosphate carrier) などの交換輸送体が存在し、ATP、ADP、無機リン酸、プロトンなどのイオンや代謝物の移動を調整しています。これらの輸送体は、ミトコンドリア内外の電気化学的および浸透平衡を保ちながら、細胞のエネルギー供給を支えています。
生物医学的重要性 (BIOMEDICAL IMPORTANCE)
好気性生物は嫌気性生物よりも呼吸基質の利用可能な自由エネルギーをはるかに多く捕らえることができる。ほとんどのエネルギーはミトコンドリア内で生成され、ミトコンドリアは「細胞の発電所 (powerhouse)」と呼ばれている。呼吸は酸化的リン酸化を介して高エネルギー中間体であるATPの生成と結びついている(Chapter 11参照)。いくつかの薬物(例えば、アモバルビタール (amobarbital))や毒物(例えば、シアン化物 (cyanide)、一酸化炭素 (carbon monoxide))は酸化的リン酸化を阻害し、通常は致命的な結果をもたらす。呼吸鎖および酸化的リン酸化に関与するミトコンドリアのいくつかの遺伝的欠陥も報告されており、患者は筋症 (myopathy) と脳症 (encephalopathy) を呈し、しばしば乳酸アシドーシス (lactic acidosis) を伴う。
特定の酵素はミトコンドリア膜によって分けられた区画に存在している (SPECIFIC ENZYMES ARE ASSOCIATED WITH COMPARTMENTS SEPARATED BY THE MITOCHONDRIAL MEMBRANES)
ミトコンドリアのマトリックス(内部区画)は二重膜で囲まれています。外膜はほとんどの代謝物に対して透過性があり、内膜は選択的透過性を持っています(Figure 13–1)。外膜にはアシルCoAシンテターゼ (acyl-CoA synthetase)(Chapter 22参照)やグリセロールリン酸アシルトランスフェラーゼ (glycerol phosphate acyltransferase)(Chapter 24参照)などの酵素が存在します。他の酵素としてはアデニル酸キナーゼ (adenylyl kinase)(Chapter 11参照)やクレアチンキナーゼ (creatine kinase)(Chapter 51参照)が膜間スペースに存在します。リン脂質であるカルジオリピン (cardiolipin) は内膜に集中しており、呼吸鎖の酵素、ATP合成酵素、さまざまな膜輸送体と共に存在しています。
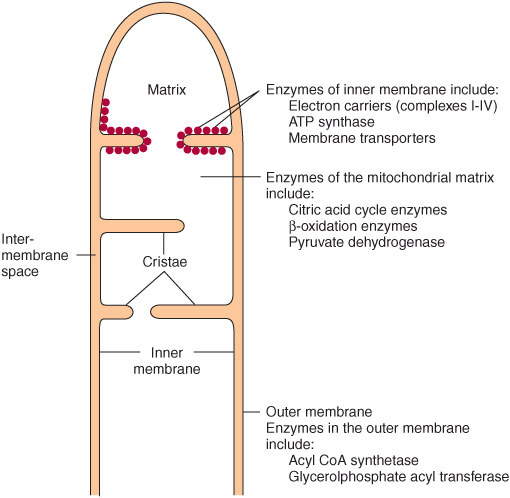
呼吸鎖は還元当量を酸化し、プロトンポンプとして機能する (THE RESPIRATORY CHAIN OXIDIZES REDUCING EQUIVALENTS & ACTS AS A PROTON PUMP)
炭水化物、脂肪酸、アミノ酸の酸化中に放出されるエネルギーのほとんどは、還元当量(—Hまたは電子)としてミトコンドリア内で利用可能になります(Figure 13–2)。クエン酸回路 (citric acid cycle) やβ酸化 (β-oxidation)(Chapters 22と16参照)、呼吸鎖複合体、酸化的リン酸化の機構はすべてミトコンドリアに存在します。呼吸鎖は還元当量を集めて輸送し、最終的に酸素と反応させて水を形成し、酸化的リン酸化は解放された自由エネルギーを高エネルギーリン酸(ATP)として捕えるプロセスです。
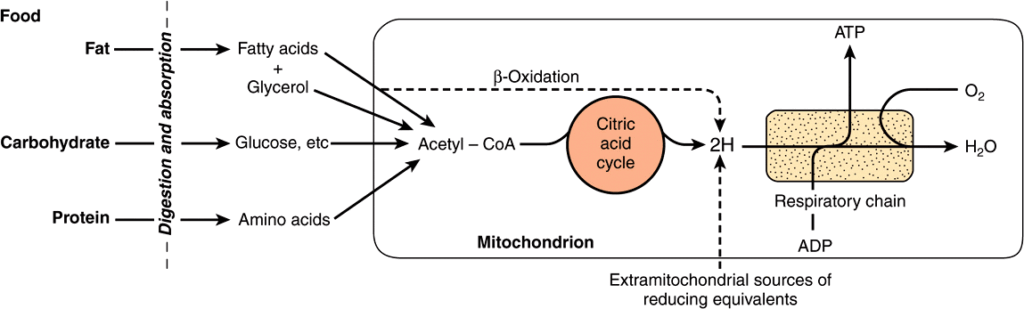
FIGURE13–2 RoleoftherespiratorychainofmitochondriaintheconversionoffoodenergytoATP.Oxidationofthemajorfoodstuffs leads to the generation of reducing equivalents (2H) that are collected by the respiratory chain for oxidation and coupled generation of ATP.
呼吸鎖の構成要素は内ミトコンドリア膜に埋め込まれた4つの大きなタンパク質複合体に含まれている (Components of the Respiratory Chain Are Contained in Four Large Protein Complexes Embedded in the Inner Mitochondrial Membrane)
電子は呼吸鎖を通って、NAD+/NADHからO2/2H2Oまでの1.1 Vのレドックススパン(Table 12–1参照)を通過します。この際、3つの大きなタンパク質複合体を経由します:NADH-Q酸化還元酵素 (NADH-Q oxidoreductase)(Complex I)、ここで電子はNADHからコエンザイムQ(Q)に移されます(ユビキノンとも呼ばれる);Q-シトクロムc酸化還元酵素 (Q-cytochrome c oxidoreductase)(Complex III)、電子をシトクロムcに渡す;そしてシトクロムc酸化酵素 (cytochrome c oxidase)(Complex IV)、電子をO2に渡し、水に還元します(Figure 13–3)。NAD+/NADHよりも正のレドックス電位を持つ基質(例えばコハク酸)は、Complex IではなくComplex II(コハク酸-Q還元酵素 (succinate-Q reductase))を経由してQに電子を渡します。4つの複合体は内ミトコンドリア膜に埋め込まれていますが、Qとシトクロムcは可動です。Qは膜内を急速に拡散し、シトクロムcは可溶性タンパク質です。
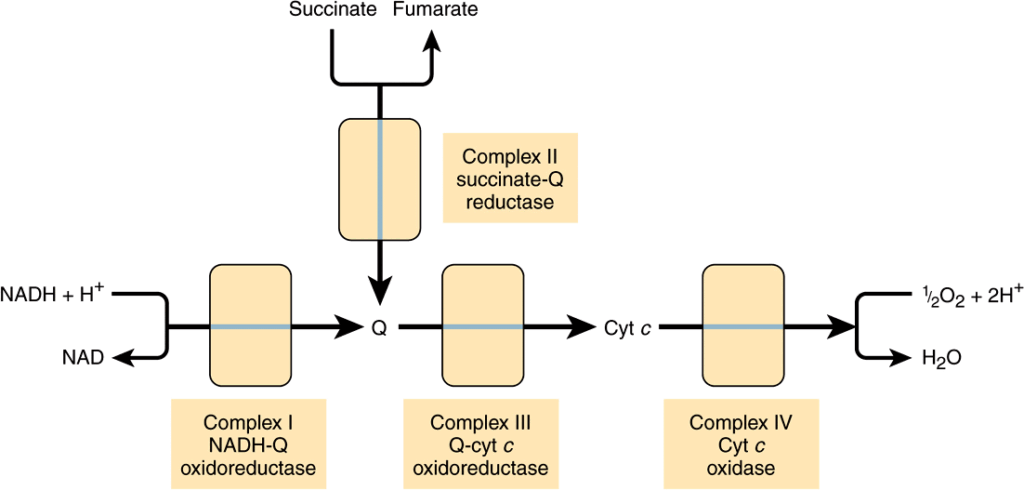
フラボタンパク質と鉄-硫黄タンパク質 (Fe-S) は呼吸鎖複合体の構成要素である (Flavoproteins & Iron-Sulfur Proteins (Fe-S) Are Components of the Respiratory Chain Complexes)
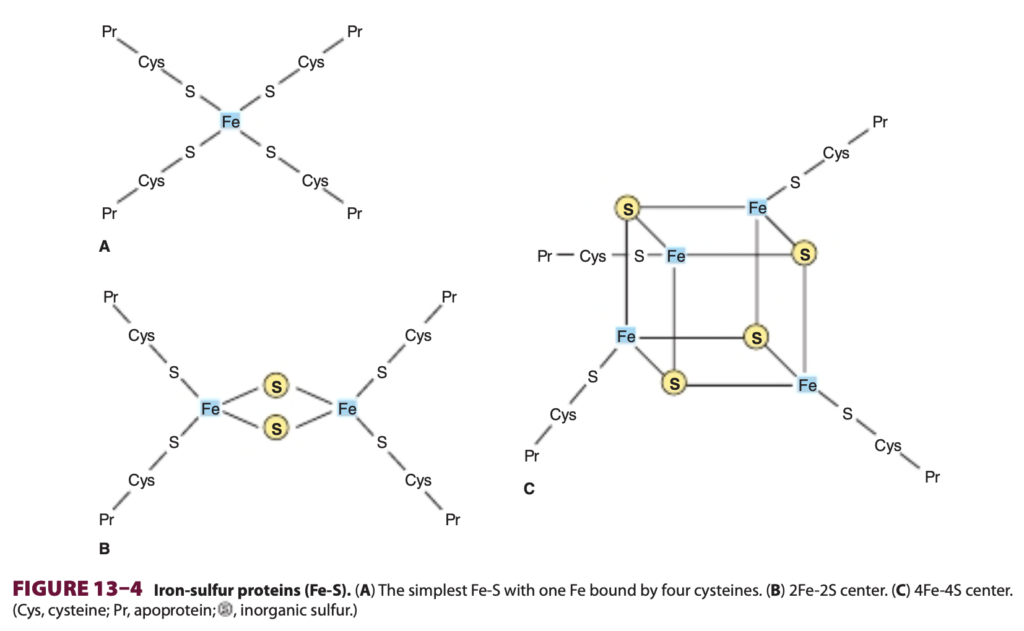
フラボタンパク質(Chapter 12参照)は、Complexes IおよびIIの重要な構成要素です。酸化型フラビンヌクレオチド(フラビンモノヌクレオチド [FMN] またはフラビンアデニンジヌクレオチド [FAD])は、2つの電子の移動を伴う反応で還元される(FMNH2またはFADH2を形成)ことができますが、1つの電子を受け取ってセミキノンを形成することもできます(Figure 12–2参照)。鉄-硫黄タンパク質(非ヘム鉄タンパク質、Fe-S)はComplexes I、II、およびIIIに存在します。これらは1、2、または4つの鉄原子を無機硫黄原子および/またはシステイン-SH基を介してタンパク質に結合した形で含んでいます(Figure 13–4参照)。Fe-Sは、Fe原子がFe2+とFe3+の間で酸化還元を行う単一の電子移動反応に関与しています。
QはComplexes IおよびIIを介して電子を受け取る (Q Accepts Electrons via Complexes I & II)
NADH-Q酸化還元酵素またはComplex Iは、大きなL字型の多サブユニットタンパク質で、NADHからQへの電子移動を触媒し、その過程で4つのH+が膜を越えて膜間スペースに移動されます: NADH + Q + 5H+ → NAD+ + QH2 + 4H+ (マトリックス → 膜間スペース)
電子はまずNADHからFMNに移され、その後、一連のFe-Sセンターを経て、最終的にQに移されます(Figure 13–5参照)。Complex II(コハク酸-Q還元酵素)では、コハク酸がクエン酸回路でフマル酸に変換される際にFADH2が形成され、その後いくつかのFe-Sセンターを介してQに電子が移されます(Figure 13–5参照)。グリセロール-3-リン酸(トリアシルグリセロールの分解または解糖から生成;Figure 17–2参照)およびアシルCoAもフラボタンパク質を介して異なる経路でQに電子を渡します(Figure 13–5参照)。
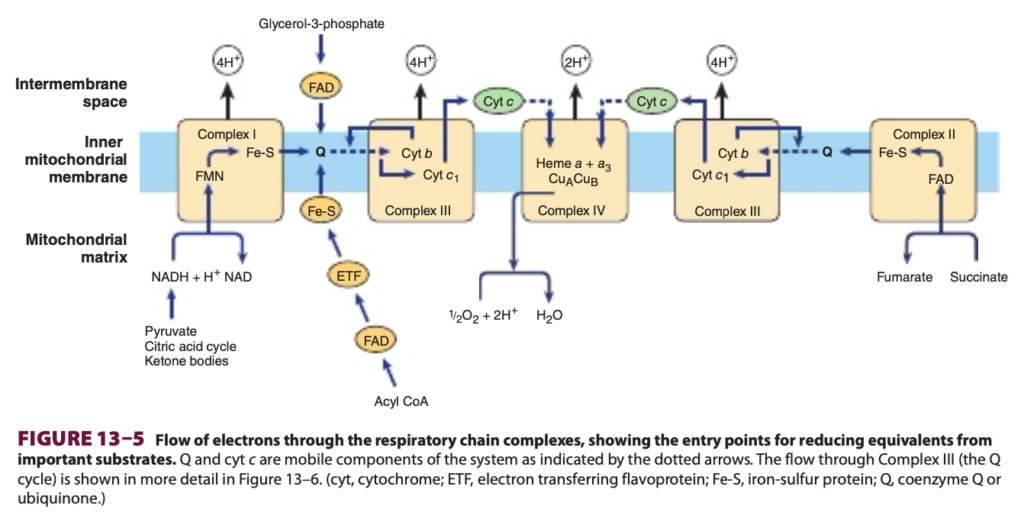
QサイクルはComplex IIIで電子移動をプロトン輸送に結合させる (The Q Cycle Couples Electron Transfer to Proton Transport in Complex III)
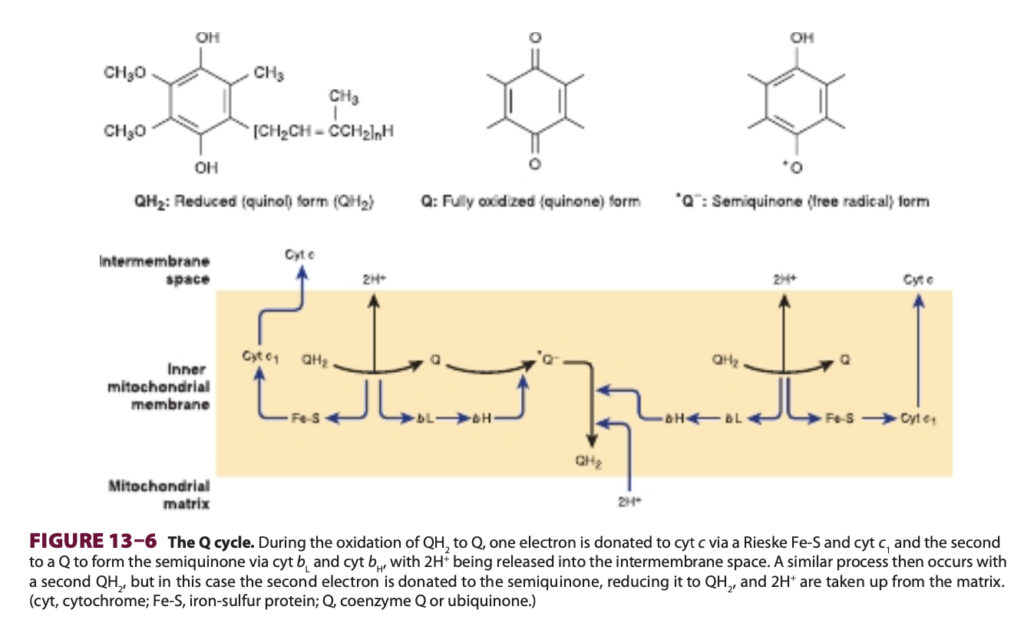
電子はQH2からComplex III(Q-シトクロムc酸化還元酵素)を介してシトクロムcに移されます:
QH2 + 2Cytc(酸化型) + 2H+(マトリックス) → Q + 2Cytc(還元型) + 4H+(膜間スペース)
この過程はシトクロムc1、bL、およびbHおよびRieske Fe-S(Fe原子の1つが2つのヒスチジン残基に結合している通常とは異なるFe-S;Figure 13–4参照)を含むと考えられ、Qサイクルとして知られています(Figure 13–6参照)。Qは酸化型キノン、還元型キノール、セミキノンの3つの形態で存在することができます(Figure 13–6参照)。Qサイクルの1回転により、2QH2の酸化がQに、4H+が膜間スペースに放出され、1Qの還元がQH2に、2H+がマトリックスから取り込まれます(Figure 13–6参照)。Qは2つの電子を運びますが、シトクロムは1つしか運ばないため、1QH2の酸化はQサイクルを介して2分子のシトクロムcの還元に結びつけられます。
分子状酸素はComplex IVを介して水に還元される (Molecular Oxygen Is Reduced to Water via Complex IV)
還元型シトクロムcはComplex IV(シトクロムc酸化酵素)によって酸化され、同時に酸素が2分子の水に還元されます: 4Cytc(還元型) + O2 + 8H+(マトリックス) → 4Cytc(酸化型) + 2H2O + 4H+(膜間スペース)
電子はまずCu中心(CuA)に渡され、CuAは2つのCu原子を持ち、それらは2つのタンパク質のシステイン-SH基に結合しています(Fe-Sに似ている)。次に、電子は順番にヘムa、ヘムa3、第2のCu中心(CuB)に渡され、最終的に酸素に到達します。電子がNADHまたはFADH2から鎖を経て2つずつ通過するごとに、2H+がComplex IVによって膜を越えて移動されます。酸素は完全に還元されるまでComplex IVにしっかりと結合しており、酸素が1つまたは2つの電子を受け取ることで生成される過酸化物アニオンや過酸化水素のような有害な中間体の放出を最小限に抑えます(Chapter 12参照)。
呼吸鎖を介した電子輸送がプロトン勾配を作り、ATP合成を駆動する (ELECTRON TRANSPORT VIA THE RESPIRATORY CHAIN CREATES A PROTON GRADIENT WHICH DRIVES THE SYNTHESIS OF ATP)
呼吸鎖を通る電子の流れは、酸化的リン酸化 (oxidative phosphorylation) によってATPを生成します。1961年にピーター・ミッチェル (Peter Mitchell) によって提唱された化学浸透説 (chemiosmotic theory) は、2つの過程がミトコンドリア内膜を横断するプロトン勾配によって結びついており、電気化学ポテンシャル差(マトリックス側が負)によって引き起こされるプロトン駆動力がATP合成のメカニズムを駆動するとしています。Complex I、III、IVはプロトンポンプとして働き、H+をミトコンドリアのマトリックスから膜間スペースに移動させます。ミトコンドリア内膜は一般にイオンに対して透過性がなく、特にプロトンに対しては透過性がないため、これらは膜間スペースに蓄積され、化学浸透説で予測されるプロトン駆動力を生み出します。
膜に位置するATP合成酵素は回転モーターとしてATPを生成する (A Membrane-Located ATP Synthase Functions as a Rotary Motor to Form ATP)
プロトン駆動力は膜に位置するATP合成酵素 (ATP synthase) を駆動し、PiとADPの存在下でATPを生成します。ATP合成酵素は呼吸鎖複合体と共に内膜に埋め込まれています(Figure 13–7)。タンパク質のいくつかのサブユニットはF1と呼ばれる軸の周りにボール状の形で配置されており、これはマトリックスに突き出てリン酸化メカニズムを持っています(Figure 13–8)。F1はF0と呼ばれる膜タンパク質複合体に接続しており、これもいくつかのタンパク質サブユニットから成ります。F0は膜を横断し、プロトンチャネルを形成しています。プロトンがプロトン勾配によってF0を通って流れると、それが回転し、F1複合体でATPが生成されます(Figures 13–7および13–8参照)。これは、F1内のβサブユニットのコンフォメーションが変化する結合変化メカニズムによって起こると考えられており、ATPをしっかりと結合するものから、ATPを放出し、ADPとPiを結合して次のATPを形成するものに変わります。前述のように、NADHが酸化されるごとにComplex IおよびIIIがそれぞれ4つのプロトンを輸送し、Complex IVが2つのプロトンを輸送します。
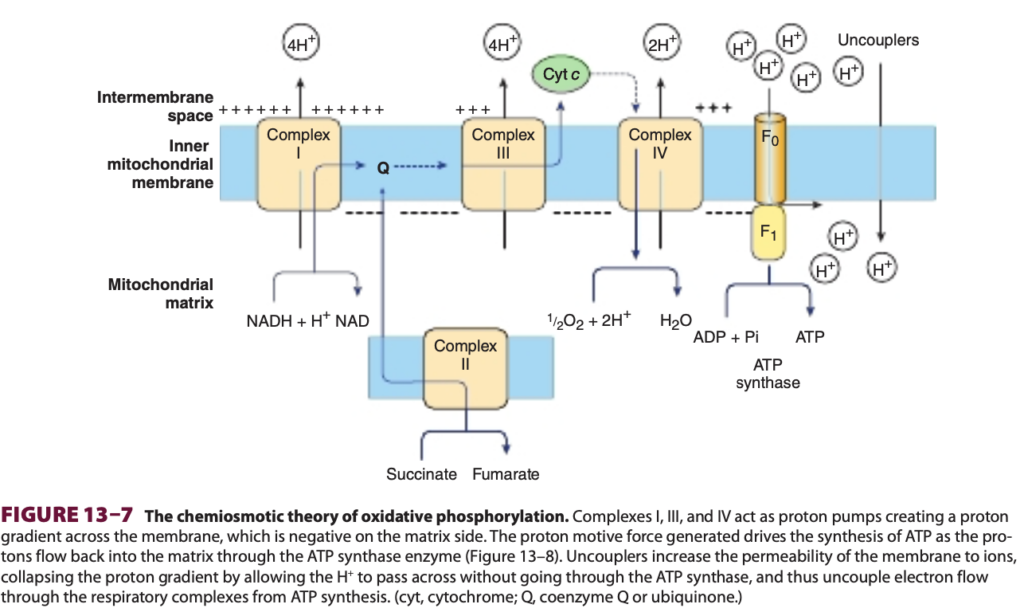
Figure 13–7 酸化的リン酸化の化学浸透説 (The chemiosmotic theory of oxidative phosphorylation)
Complex I、III、およびIVはプロトンポンプとして働き、膜を横断するプロトン勾配を作り出し、マトリックス側が負になります。生成されたプロトン駆動力は、ATP合成酵素 (ATP synthase) を通ってプロトンがマトリックスに戻る際にATPの合成を駆動します(Figure 13–8参照)。アンカップラー (uncouplers) は膜のイオン透過性を高め、H+がATP合成酵素を通らずに膜を通過することでプロトン勾配を崩壊させ、呼吸複合体を通る電子の流れとATP合成を分離します。(cyt: シトクロム、Q: コエンザイムQまたはユビキノン)
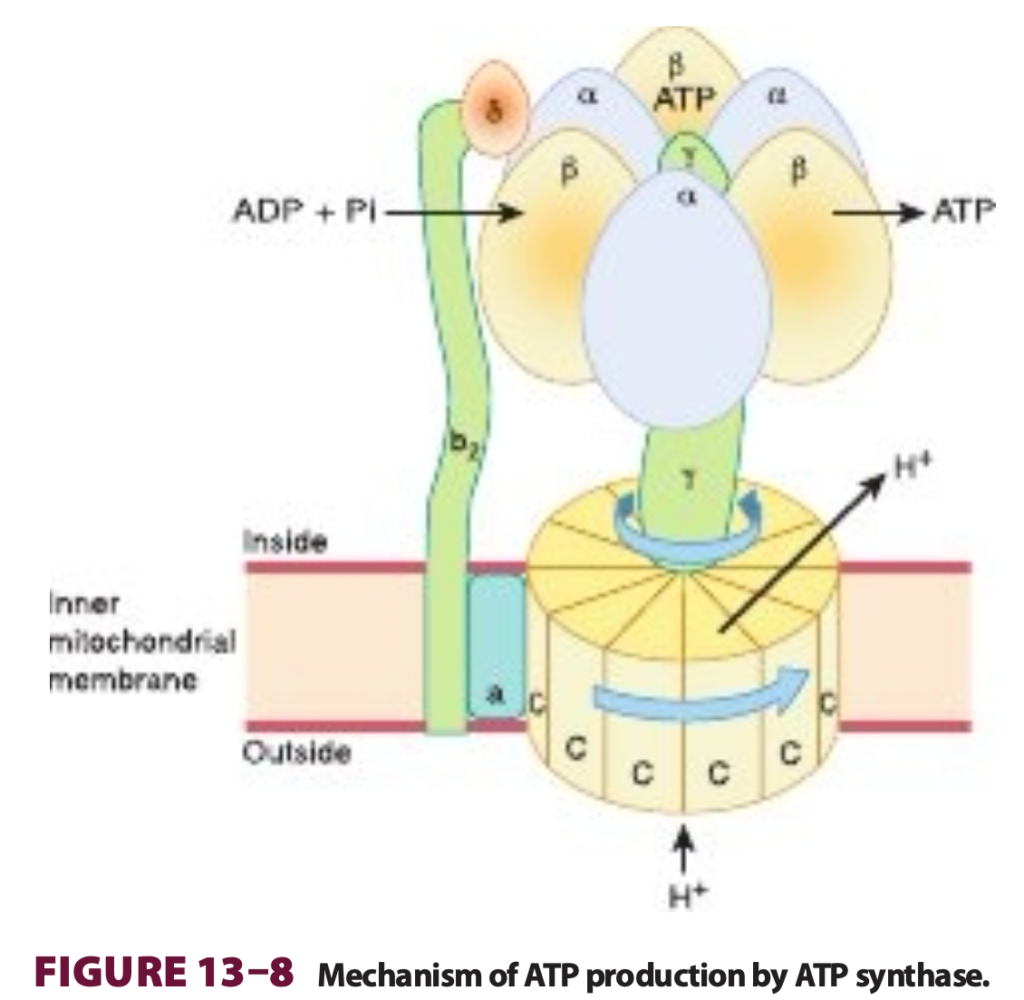
Figure 13–8 ATP合成酵素によるATP生成のメカニズム (Mechanism of ATP production by ATP synthase)
この酵素複合体は「C」タンパク質サブユニットの円盤で構成されるF0サブ複合体から成ります。付随するのは「曲がった軸」の形をしたγサブユニットです。「C」ユニットの円盤を通過するプロトンが、それとγサブユニットを回転させます。γサブユニットはF1サブ複合体内に収まっており、F1は3つのαサブユニットと3つのβサブユニットから構成されていて、これらは膜に固定されており回転しません。ADPと無機リン酸 (Pi) はβサブユニットによって順次取り込まれ、ATPを形成し、回転するγサブユニットが順に各βサブユニットを絞ってそのコンフォメーションを変えることでATPが放出されます。このようにして、1回転ごとに3分子のATPが生成されます。明確にするために、同定されているすべてのサブユニットは表示されていません—例えば「軸」にはεサブユニットも含まれています。
呼吸鎖は異化過程で捕らえられるエネルギーの大部分を提供する (THE RESPIRATORY CHAIN PROVIDES MOST OF THE ENERGY CAPTURED DURING CATABOLISM)
ADPは、高エネルギーリン酸 (high-energy phosphate) の形で異化過程で放出される自由エネルギーのかなりの部分を捕らえます。その結果生じるATPは、細胞のエネルギー「通貨 (currency)」と呼ばれており、エネルギーを必要とするプロセスを駆動するためにこの自由エネルギーを供給します(Figure 11–5参照)。解糖反応では、高エネルギーリン酸基が2つ直接捕らえられます(Table 17–1参照)。クエン酸回路では、コハク酸CoAがコハク酸に変換される際に、さらに2つの高エネルギーリン酸が捕らえられます(Chapter 16参照)。これらのリン酸化はすべて基質レベルで行われます。Complex I、III、IVを介して呼吸鎖で酸化される基質1モル(つまりNADHを介して)ごとに、0.5モルの酸素が消費されるごとに2.5モルのATPが形成されます(Figure 13–7参照)。一方、Complex II、III、IVを介して基質1モル(例えばコハク酸や3-ホスホグリセリン酸)が酸化される場合、1.5モルのATPしか形成されません(P比 = 1.5)。これらの反応は呼吸鎖レベルでの酸化的リン酸化として知られています。これらの値を考慮すると、グルコース1モルの完全酸化から生成される高エネルギーリン酸の約90%が、呼吸鎖に結合した酸化的リン酸化によって得られると推定されます(Table 17–1参照)。
呼吸調節はATPの一定供給を保証する (Respiratory Control Ensures a Constant Supply of ATP)
ミトコンドリアの呼吸速度はADPの供給量によって制御されます。これは酸化とリン酸化が密接に結びついているためです。つまり、ADPのリン酸化が伴わないと呼吸鎖を介した酸化は進行できません。Table 13–1には、ミトコンドリアにおける呼吸速度を制御する5つの条件が示されています。多くの細胞は安静時に第4状態 (state 4) にあり、このとき呼吸はADPの供給量によって制御されます。仕事を行うと、ATPがADPに変換され、より多くの呼吸が行われてATPの蓄えが補充されます。特定の条件下では、無機リン酸 (inorganic phosphate) の濃度も呼吸鎖の機能速度に影響を与えることがあります。呼吸が増加する(運動時など)と、細胞は第3状態または第5状態 (states 3 or 5) に近づき、呼吸鎖の容量が飽和するか、またはPO2がヘムa3のKm以下に低下することがあります。また、細胞質のADPをミトコンドリア内に取り込み、ATPを外に送り出すADP/ATPトランスポーター (transporter) が速度を制限する可能性もあります。

State 1(ステート1): 酸素のみの存在
- 酸素のみが存在する状態です。酸素はあるが、ADP(アデノシン二リン酸)や基質(炭水化物、脂肪酸など)は存在しません。このため、呼吸活動は行われません。エネルギー消費が最小限である状態ではありません。
State 2(ステート2): 基質の存在のみ
- 基質のみが存在する状態です。この場合、酸素はあるが、ATP合成に必要なADPがありません。したがって、電子伝達系は基質の酸化を開始できず、呼吸速度は非常に低いままです。
State 3(ステート3): ADPおよび基質の存在
- ADPと基質の両方が存在する状態です。ミトコンドリアは酸化的リン酸化を行うことができるため、呼吸は非常に活発になります。ATPが生成される際の最も活発な状態です。
State 4(ステート4): ADPの存在のみ
- ADPのみが存在する状態です。基質はありませんので、ATP合成に必要なエネルギーを供給することができず、呼吸速度は低い状態です。
State 5(ステート5): 呼吸鎖自体の能力
- すべての基質と酸素が飽和量で存在する場合の呼吸鎖自体の能力を示します。つまり、呼吸鎖の最大能力を評価するために用いられる状態です。
したがって、生物の酸化過程が食物の酸化によって得られる自由エネルギーを利用可能にし、捕える方法は段階的で効率的かつ制御されています。これは、多くの非生物的な過程に見られるような爆発的で非効率的、かつ制御されていないものではありません。捕えられなかった残りの自由エネルギーは熱として放出されますが、これは「無駄」と考える必要はありません。なぜなら、呼吸系全体が十分に発エネルギー的で平衡状態から離れていることを保証し、一方向の連続的な流れとATPの一定供給を可能にするからです。また、体温の維持にも寄与します。
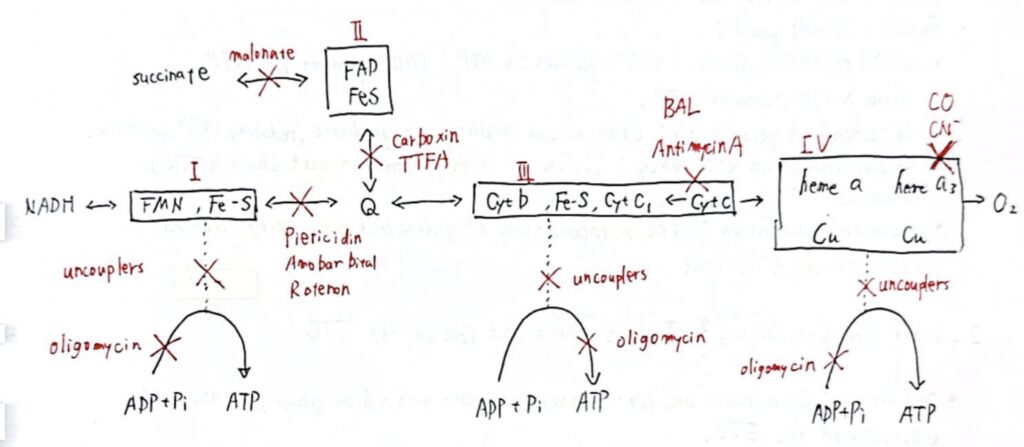
多くの毒物は呼吸鎖を阻害する (MANY POISONS INHIBIT THE RESPIRATORY CHAIN)
呼吸鎖に関する多くの情報は阻害剤を使用して得られており、逆にこれによりいくつかの毒物の作用機序についての知識も得られています(Figure 13–9)。これらは呼吸鎖の阻害剤、酸化的リン酸化の阻害剤、または酸化的リン酸化のアンカップラー (uncouplers) に分類されます。
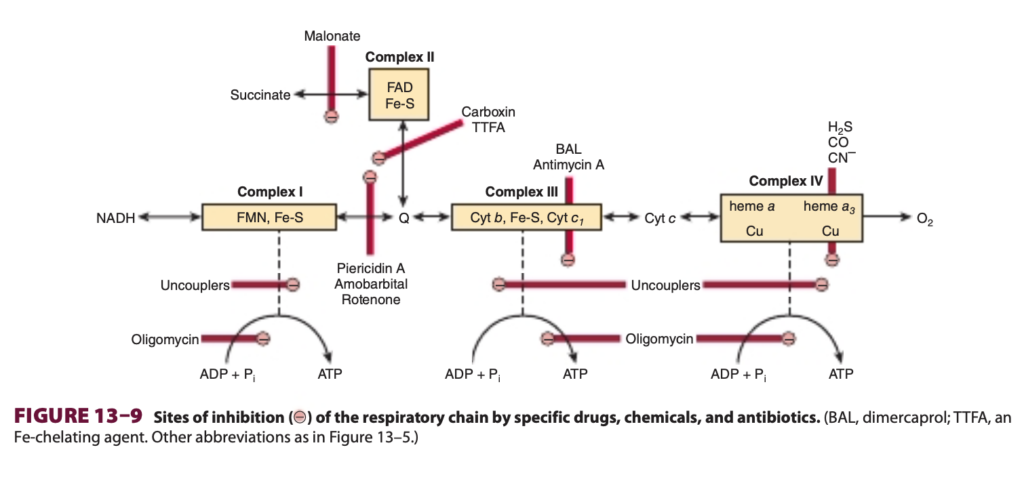
バルビツール酸塩 (barbiturates) であるアモバルビタール (amobarbital) は、Complex IにおけるFe-SからQへの電子移動を阻止することで電子伝達を阻害します。十分な投与量で致命的となります。アンチマイシンA (antimycin A) とジメルカプロール (dimercaprol) は、Complex IIIで呼吸鎖を阻害します。古典的な毒物である硫化水素 (H2S)、一酸化炭素 (carbon monoxide)、シアン化物 (cyanide) はComplex IVを阻害し、呼吸を完全に停止させることができます。マロン酸 (malonate) はComplex IIの競争的阻害剤です。
アトラクリロシド (atractyloside) は、ADPのミトコンドリア内への輸送とATPの外への輸送を阻害することにより、酸化的リン酸化を阻害します(Figure 13–10)。抗生物質オリゴマイシン (oligomycin) は、ATP合成酵素を通るプロトンの流れを阻止することで、酸化とリン酸化の両方を完全にブロックします(Figure 13–8参照)。
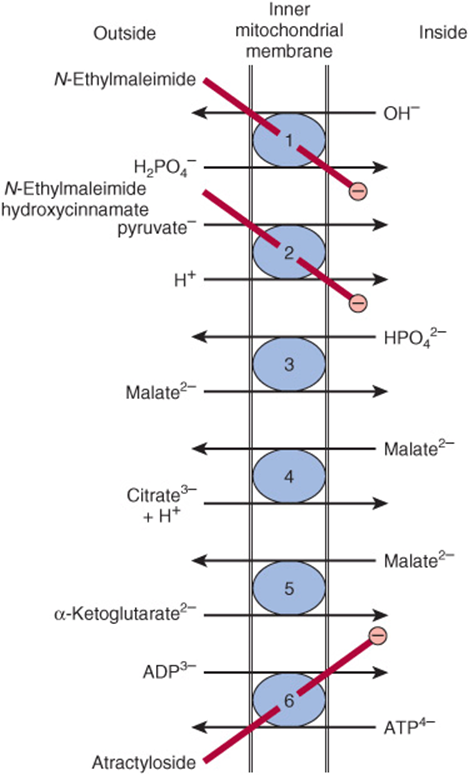
FIGURE 13–10 ミトコンドリア内膜の輸送体システム。
➀ リン酸輸送体 (Phosphate transporter)、
➁ ピルビン酸共輸送体 (Pyruvate symport)、
➂ ジカルボン酸輸送体 (Dicarboxylate transporter)、
➃ トリカルボン酸輸送体 (Tricarboxylate transporter)、
➄ α-ケトグルタル酸輸送体 (α-Ketoglutarate transporter)、
➅ アデニンヌクレオチド輸送体 (Adenine nucleotide transporter)。
N-エチルマレイミド (N-Ethylmaleimide)、ヒドロキシシンナメート (Hydroxycinnamate)、およびアトラクチロシド (Atractyloside) は、指定されたシステム () を阻害します。また(図には示されていませんが)、グルタミン酸/アスパラギン酸 (Figure 13–13)、グルタミン、オルニチン、中性アミノ酸、カルニチン (Figure 22–1) のための輸送体システムも存在します。
アンカップラーは呼吸鎖での酸化とリン酸化を分離します(Figure 13–7参照)。これらの化合物は有毒であり、呼吸がADPやPiの濃度によって制限されなくなるため、呼吸が制御されなくなります。呼吸鎖の研究で最も頻繁に使用されるアンカップラーは2,4-ジニトロフェノール (2,4-dinitrophenol) ですが、他の化合物も同様に作用します。サーモゲニン (thermogenin)(またはアンカップリングタンパク質1 [UCP1])は褐色脂肪組織に存在する生理的アンカップラーであり、特に新生児や動物の冬眠時に体熱を生成する役割を持っています(Chapter 25参照)。
化学浸透説は呼吸制御とアンカップラーの作用を説明できる (THE CHEMIOSMOTIC THEORY CAN ACCOUNT FOR RESPIRATORY CONTROL AND THE ACTION OF UNCOUPLERS)
プロトンの輸送によって膜に確立された電気化学的ポテンシャル差は、ATP合成酵素を通るプロトンの逆輸送によって放電されない限り、呼吸鎖を通る還元当量のさらなる輸送を抑制します。このプロトンの逆輸送は、ADPとPiの供給に依存しています。
ジニトロフェノール (dinitrophenol) のようなアンカップラーは両親媒性 (amphipathic) であり(Chapter 21参照)、ミトコンドリア内膜の脂質に対するプロトンの透過性を高めます。一方、サーモゲニン (UCP1) のような生理的アンカップラーは膜を横断するタンパク質であり、同様の効果を持ち、これにより電気化学的ポテンシャルが減少し、ATP合成酵素がショートされます(Figure 13–7参照)。このような状況では、リン酸化が行われない状態で酸化が進行することが可能です。
ミトコンドリア内膜の選択的透過性により交換輸送体が必要となる (THE SELECTIVE PERMEABILITY OF THE INNER MITOCHONDRIAL MEMBRANE NECESSITATES EXCHANGE TRANSPORTERS)
膜を横断するトランスポータータンパク質を含む交換拡散系 (exchange diffusion systems) は、OH⁻イオンに対するアニオンやH⁺イオンに対するカチオンの交換のために膜内に存在します。このような系は、電気的および浸透平衡を保ちながらイオン化された代謝物の取り込みと排出を行うために必要です。ミトコンドリア内膜は酸素、水、二酸化炭素、アンモニアなどの無電荷の小分子、そしてモノカルボン酸(例えば3-ヒドロキシ酪酸、アセト酢酸、酢酸)には自由に透過性がありますが、特に非解離型で脂溶性が高い形で容易に透過します。長鎖脂肪酸はカルニチン系 (carnitine system) を介してミトコンドリアに輸送され(Figure 22–1参照)、ピルビン酸にはH⁺勾配を利用するシンポート (symport) による特別なキャリアが存在します(Figure 13–10参照)。しかし、ジカルボン酸およびトリカルボン酸アニオン(例えばマレート、クエン酸)やアミノ酸には、それらの膜を通過させるための特定のトランスポーターやキャリア系が必要です。
ジカルボン酸およびトリカルボン酸アニオンの輸送は、無機リン酸 (inorganic phosphate) の輸送と密接に関連しており、これはH₂PO₄⁻イオンとしてOH⁻と交換されて容易に膜を通過します。ジカルボン酸トランスポーターによるマレートの正味の取り込みには、逆方向に交換される無機リン酸が必要です。トリカルボン酸トランスポーターによるクエン酸、イソクエン酸、またはシスアコニット酸の正味の取り込みには、マレートが交換に必要です。α-ケトグルタル酸の輸送にもマレートとの交換が必要です。アデニンヌクレオチドトランスポーターはATPとADPの交換を可能にしますが、AMPは交換できません。ATPがミトコンドリアから外部利用の場に移動し、ADPがミトコンドリア内でのATP生成のために戻ることは非常に重要です(Figure 13–11参照)。この移動において、ミトリックスから4つの負電荷が除去され、3つが取り込まれるため、膜を越える電気化学的勾配(プロトン駆動力)はATPの輸出を有利にします。Na⁺はプロトン勾配によってH⁺と交換されることができます。ミトコンドリアによるCa²⁺の能動的取り込みは、1(Ca²⁺ユニポート)の正味電荷移動を伴うと考えられており、おそらくCa²⁺/H⁺アンチポートを介して行われます。ミトコンドリアからのカルシウム放出はNa⁺との交換によって促進されます。
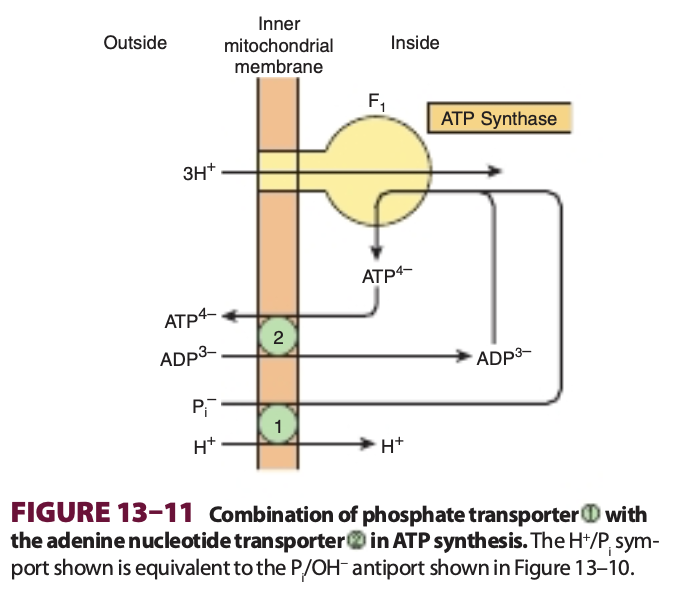
イオノフォアは特定のカチオンが膜を通過することを可能にする (Ionophores Permit Specific Cations to Penetrate Membranes)
イオノフォア (ionophores) は、特定のカチオンと複合体を形成し、それらの生物学的膜を通過させる脂溶性分子です。例えば、バリノマイシン (valinomycin) はK⁺に対して作用します。古典的なアンカップラーであるジニトロフェノールも、実際にはプロトンイオノフォア (proton ionophore) です。
プロトン移動トランスヒドロゲナーゼはミトコンドリア内のNADPHの供給源である (Proton-Translocating Transhydrogenase Is a Source of Intramitochondrial NADPH)
プロトン移動トランスヒドロゲナーゼ (proton-translocating transhydrogenase)(NAD(P)トランスヒドロゲナーゼとも呼ばれる)は、内ミトコンドリア膜のタンパク質であり、プロトンが電気化学勾配に沿ってミトコンドリア内に移動することと、ミトコンドリア内のNADHからNADPへの水素移動を結びつけ、ミトコンドリア内の酵素(例えば、グルタミン酸脱水素酵素やステロイド合成に関与する水酸化酵素)に必要なNADPHを形成します。
ミトコンドリア外のNADHの酸化は基質シャトルによって媒介される (Oxidation of Extramitochondrial NADH Is Mediated by Substrate Shuttles)
NADHはミトコンドリア膜を透過することができませんが、グリセルアルデヒド-3-リン酸脱水素酵素(解糖系の酵素、Figure 17–2参照)によって細胞質で連続的に生成されます。しかし、好気条件下では、ミトコンドリア外のNADHは蓄積せず、ミトコンドリアで呼吸鎖によって酸化されると考えられています。還元当量をミトコンドリア膜を通じて移動させるためには、ミトコンドリア膜の両側で適切な脱水素酵素で結びつけられた基質対が必要です。グリセロリン酸シャトルを使用した移動のメカニズムはFigure 13–12に示されています。
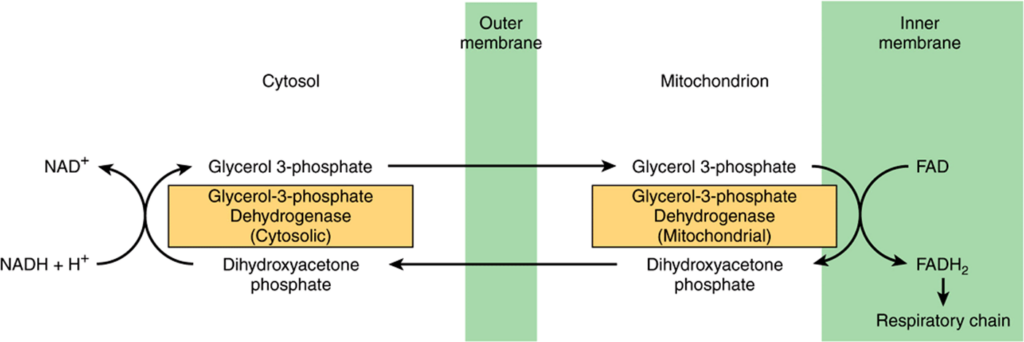
FIGURE13–12 Glycerophosphateshuttlefortransferofreducingequivalentsfromthecytosolintothemitochondrion.
ミトコンドリア酵素はNADではなくフラボタンパク質を介して呼吸鎖に結びついているため、消費された酸素1原子あたり2.5モルではなく1.5モルのATPが生成されます。このシャトルは一部の組織(例えば脳、白筋)に存在しますが、他の組織(例えば心筋)では不足しています。そのため、マレートシャトル系(Figure 13–13)がより普遍的に利用されると考えられています。この系の複雑さは、ミトコンドリア膜がオキサロ酢酸に透過しないためです。これを克服するために、グルタミン酸とのトランスアミネーション反応によってアスパラギン酸とα-ケトグルタル酸が形成され、それらが特定のトランスポーターを介して膜を通過し、細胞質でオキサロ酢酸に再形成されます。
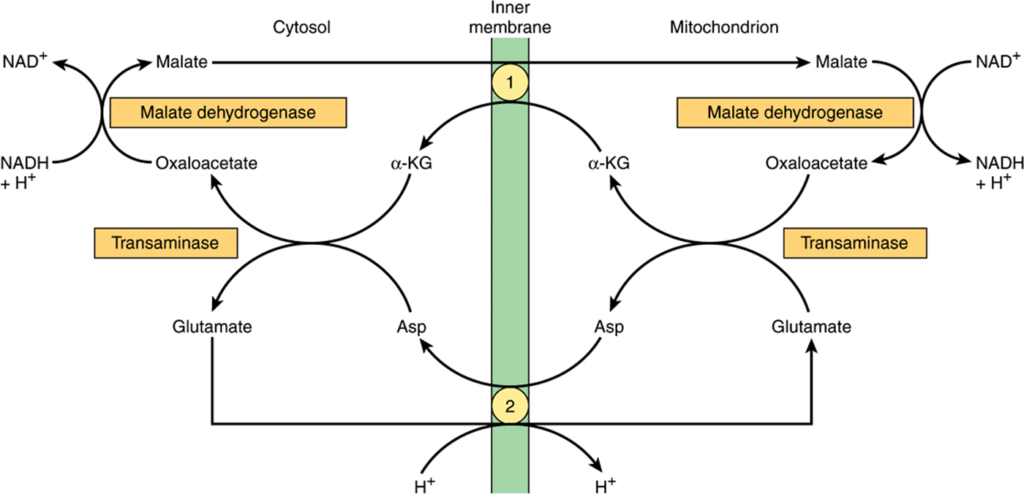
FIGURE 13–13 細胞質からミトコンドリアへの還元当量の移動を行うマレートシャトル(Malate shuttle)。
α-ケトグルタル酸輸送体 (α-Ketoglutarate transporter) およびグルタミン酸/アスパラギン酸輸送体 (glutamate/aspartate transporter)(グルタミン酸とのプロトン共輸送に注目)。α-KG は α-ケトグルタル酸 (α-ketoglutarate) を示します。ミトコンドリアの外側でオキサロ酢酸 (Oxaloacetate) からマレート (Malate) が形成されることで NADH から NAD+ が生成されます。マレートは内膜を横断してα-KGと交換し、マトリックス内でオキサロ酢酸に戻り、NADH を放出します。その後、オキサロ酢酸とグルタミン酸からトランスアミナーゼ酵素により (Asp)(アスパラギン酸)とα-KGが生成され、細胞質に運ばれ、第二のトランスアミナーゼにより再びオキサロ酢酸が形成され、NADHから別のNAD+を生成するために使用されます。
クレアチンリン酸シャトルは高エネルギーリン酸のミトコンドリアからの輸送を促進する (The Creatine Phosphate Shuttle Facilitates Transport of High-Energy Phosphate From Mitochondria)
クレアチンリン酸シャトル (creatine phosphate shuttle)(Figure 13–14)は、クレアチンリン酸のエネルギーバッファとしての機能を補完し、心臓や骨格筋などの活動的な組織におけるミトコンドリアからの高エネルギーリン酸の移動のための動的システムとして機能します。クレアチンキナーゼ (creatine kinase, CKm) のアイソザイムはミトコンドリアの膜間スペースに存在し、アデニンヌクレオチドトランスポーターから出てくるATPからクレアチンへの高エネルギーリン酸の移動を触媒します。その後、クレアチンリン酸は外ミトコンドリア膜のタンパク質孔を通って細胞質に輸送され、ミトコンドリア外のATP生成に利用されます。
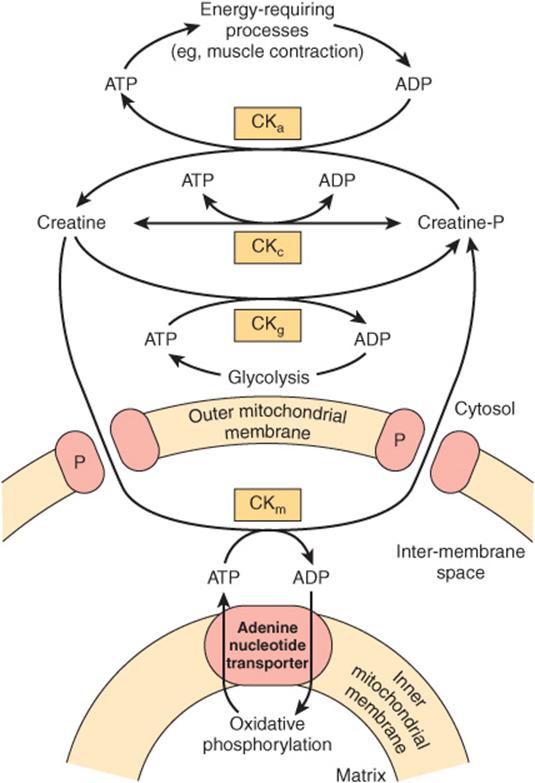
FIGURE 13–14 心筋および骨格筋におけるクレアチンリン酸シャトル(Creatine phosphate shuttle)。
このシャトルは、ミトコンドリアマトリックスから細胞質への高エネルギーリン酸の迅速な輸送を可能にします。(CKa:大量のATPを必要とする状況、例えば筋収縮に関与するクレアチンキナーゼ (Creatine kinase);CKc:クレアチンとクレアチンリン酸およびATP/ADPの平衡を維持するクレアチンキナーゼ;CKg:解糖系とクレアチンリン酸合成を結びつけるクレアチンキナーゼ;CKm:酸化的リン酸化で生成されたATPからクレアチンリン酸の生成を仲介するミトコンドリアクレアチンキナーゼ;P:外ミトコンドリア膜のポアタンパク質)。
臨床的側面 (CLINICAL ASPECTS)
致死性乳児ミトコンドリア筋症および腎機能障害として知られる状態では、呼吸鎖のほとんどの酸化還元酵素が著しく減少または欠如しています。MELAS(ミトコンドリア脳症、乳酸アシドーシス、脳卒中)は、NADH-Q酸化還元酵素 (Complex I) またはシトクロム酸化酵素 (Complex IV) の欠乏による遺伝性疾患で、ミトコンドリアDNAの変異によって引き起こされ、アルツハイマー病や糖尿病に関与する可能性があります。また、多くの薬物や毒物が酸化的リン酸化の阻害によって作用します(前述参照)。
要約 (SUMMARY)
- 炭水化物、脂肪、タンパク質の酸化から放出されるほぼすべてのエネルギーは、還元当量(—Hまたはe⁻)としてミトコンドリア内で利用可能になります。これらは呼吸鎖に流れ込み、キャリアのレドックス勾配を通って酸素と最終反応し、水を形成します。
- レドックスキャリアは内ミトコンドリア膜に4つの呼吸鎖複合体にまとめられています。この4つの複合体のうち3つは、レドックス勾配で放出されたエネルギーを利用してプロトンを膜外にポンプし、マトリックスと内膜スペースの間に電気化学的ポテンシャルを生み出します。
- ATP合成酵素は膜を横断しており、プロトン勾配またはプロトン駆動力のポテンシャルエネルギーを利用してADPとPiからATPを合成する回転モーターとして機能します。この方法で、酸化は細胞のエネルギー需要を満たすためにリン酸化と密接に結びついています。
- ミトコンドリア内膜はプロトンや他のイオンに透過しないため、OH⁻、ATP⁴⁻、ADP³⁻、代謝物などのイオンが電気化学的勾配を崩すことなく膜を通過できるように、特別な交換輸送体が膜を横断しています。
- シアン化物のような多くのよく知られた毒物は呼吸鎖の阻害によって呼吸を停止させます。


コメント