Contents
- 1 第16章
- 2 毛細血管循環と毛細血管系の構造
- 3 毛細血管壁の構造
- 4 水、栄養素、その他の物質の血液と間質液間の交換
- 5 間質および間質液(INTERSTITIUM AND INTERSTITIAL FLUID)
- 6 間質内の自由水(Free Fluid in the Interstitium)
- 7 毛細血管を越えた液体のろ過(FLUID FILTRATION ACROSS CAPILLARIES)
- 8 血漿膠質浸透圧(Plasma Colloid Osmotic Pressure)
- 9 毛細血管膜を介した液体の体積交換(Fluid Volume Exchange Through the Capillary Membrane)
- 10 スターリングの毛細血管交換平衡(Starling Equilibrium for Capillary Exchange)
- 11 毛細血管ろ過係数(Capillary Filtration Coefficient)
- 12 リンパ系(Lymphatic System)
- 13 身体のリンパ管(Lymph Channels of the Body)
- 14 終末リンパ毛細血管とその透過性(Terminal Lymphatic Capillaries and Their Permeability)
- 15 リンパの形成(Formation of Lymph)
- 16 リンパの流量(Rate of Lymph Flow)
- 17 リンパポンプによるリンパ流量の増加(Lymphatic Pump Increases Lymph Flow)
- 18 外部からの断続的なリンパ管圧縮によるポンピング(Pumping Caused by External Intermittent Compression of the Lymphatics)
- 19 リンパ毛細血管ポンプ(Lymphatic Capillary Pump)
- 20 リンパ流量を決定する要因のまとめ(Summary of Factors That Determine Lymph Flow)
- 21 リンパ系が間質液タンパク質濃度、体積、および圧力を制御する上での重要な役割(Lymphatic System Plays a Key Role in Controlling Interstitial Fluid Protein Concentration, Volume, and Pressure)
- 22 組織を結びつけるための間質液の負圧の重要性(Significance of Negative Interstitial Fluid Pressure for Holding Body Tissues Together)
第16章
毛細血管循環とリンパ系:毛細血管の体液交換、間質液、リンパ流
毛細血管循環の最も目的にかなった機能は、栄養(nutrients)を組織に輸送し、細胞の排泄物を除去することです。小動脈は各組織への血流を制御し、組織内の局所的な状態が小動脈の直径を制御します。したがって、ほとんどの場合、各組織は自身の必要に応じて血流を調整しています。この点については第17章で説明されています。 毛細血管の壁は薄く(thin)、単層(single-layer)の非常に透過性の高い内皮細胞(endothelial cells)で構成されています。したがって、水、栄養素、排泄物は、組織と循環血液の間で迅速かつ容易に交換されます。 全身の末梢循環には約100億の毛細血管があり、その総表面積は500〜700平方メートル(フットボールフィールドの約8分の1)と推定されています。体内の単一の機能細胞が毛細血管から20〜30マイクロメートル以上離れていることは稀です。
毛細血管循環と毛細血管系の構造
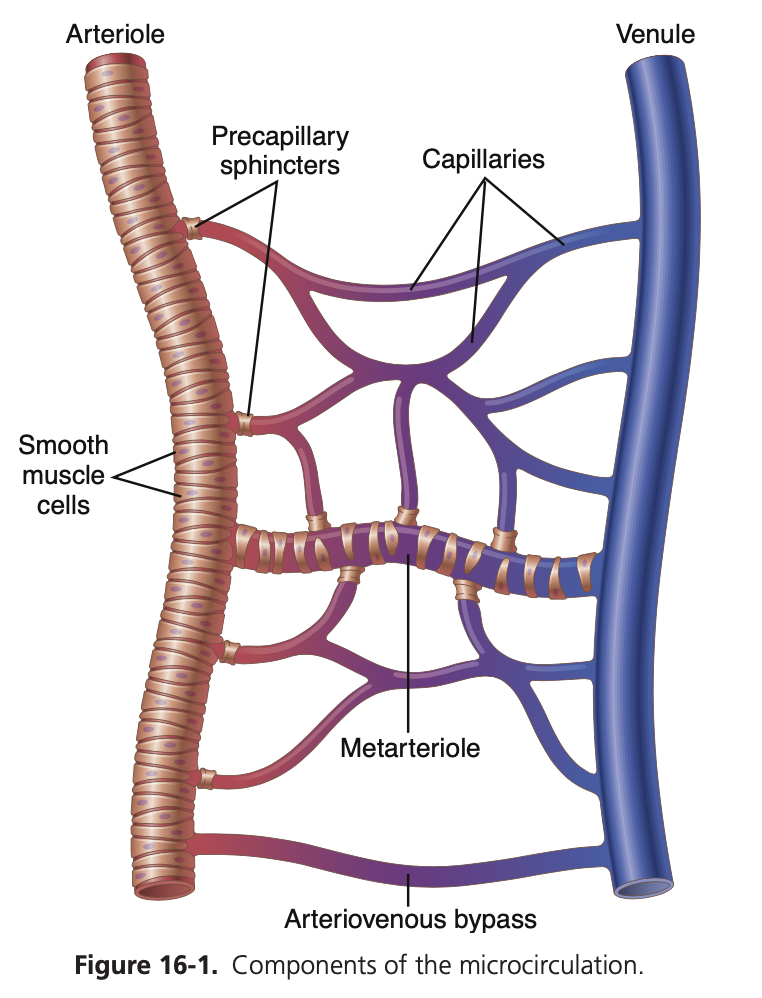
各器官の毛細血管循環は、その器官の特定のニーズに応じて組織化されています。一般に、器官に入る栄養動脈(nutrient artery)は、6〜8回枝分かれし、細動脈(arterioles)と呼ばれるほどに小さくなります。細動脈はさらに2〜5回枝分かれし、最終的に直径(diameter)は5〜9マイクロメートルになります。そこから毛細血管に血液を供給します。 細動脈は非常に筋肉質で、その直径は何倍にも変化します。終末細動脈(metarterioles)は連続した筋肉層を持っていませんが、滑らかな筋肉線維(smooth muscle fibers)が所々で血管を取り巻いています(図16-1参照)。各真の毛細血管(true capillary)が終末細動脈から始まる地点では、通常、毛細血管は平滑筋線維(smooth muscle fiber)で取り囲まれています。この構造は前毛細血管括約筋(precapillary sphincter)と呼ばれ、毛細血管への入り口を開閉することができます。 細静脈(venules)は細動脈よりも大きく、筋肉層はかなり弱いです。しかし、細静脈の圧力は細動脈よりもはるかに低いため、筋肉が弱いにもかかわらず、細静脈はかなり収縮することができます。 このような毛細血管床の典型的な配置は、体のすべての部分に見られるわけではありませんが、同様の配置が同じ目的に役立つ場合があります。最も重要なのは、終末細動脈や前毛細血管括約筋がそれぞれの組織と密接に接していることです。したがって、組織内の栄養素(nutrients)、代謝産物(metabolites)、水素イオン(hydrogen ions)の濃度などの局所的な状態が血管に直接的な影響を与え、各小さな組織領域での局所血流を制御します。
Aorta-> arteries (div 6-8x)-> arterioles (div 2-5x) metarteriole-> capillaries….
毛細血管壁の構造
図16-2は、ほとんどの器官、特に筋肉や結合組織(connective tissue)に見られる典型的な毛細血管壁(capillary wall)の超微細構造を示しています。毛細血管の壁は単一細胞層(unicellular layer)の内皮細胞で構成されており、外側には薄い基底膜(basement membrane)が取り囲んでいます。毛細血管壁の総厚さはわずか約0.5マイクロメートルです。毛細血管の内径は4〜9マイクロメートルで、赤血球や他の血液細胞が通過するのにぎりぎりの大きさです。
毛細血管膜の孔
図16-2には、毛細血管の内部と外部を接続する2つの小さな通路が示されています。そのうちの1つは細胞間裂孔(intercellular cleft)で、図の上部に隣接する内皮細胞の間にある薄い曲がったチャンネルです。この裂孔は、タンパク質結合(protein attachments)の短い隆起によって定期的に遮られ、内皮細胞がしっかり結合していますが、これらの隆起の間を通じて液体(fluid)が自由に浸透できます。裂孔の幅は通常6〜7ナノメートル(60〜70オングストローム)で、これはアルブミン(albumin)タンパク質分子の直径よりもわずかに小さいです。
細胞間裂孔は内皮細胞の端にしか存在しないため、毛細血管壁全体の表面積の1/1000にも満たないことが多いです。それにもかかわらず、水分子(water molecules)の熱運動(thermal motion)や、ほとんどの水溶性イオン(water-soluble ions)および小分子は非常に高速で拡散し、これらの裂孔(細胞間裂孔)を通じて毛細血管内外で容易に拡散します。
内皮細胞には、プラズマ膜小胞(plasmalemmal vesicles)またはカベオラ(caveolae)と呼ばれる無数の小さな小胞が存在します。これらのプラズマ膜小胞は、カベオリン(caveolins)というオリゴマー(oligomers)で構成されており、コレステロールやスフィンゴ脂質(sphingolipids)分子と関連しています。カベオラの正確な機能はまだ明確ではありませんが、エンドサイトーシス(endocytosis)(細胞が外部から物質を取り込む過程)やトランスサイトーシス(transcytosis)(高分子が内皮細胞内を通過する過程)に関与していると考えられています。図16-2に示されているように、これらの小胞の一部は小胞性チャネル(vesicular channels)を形成し、内皮細胞全体を貫通することがあります。
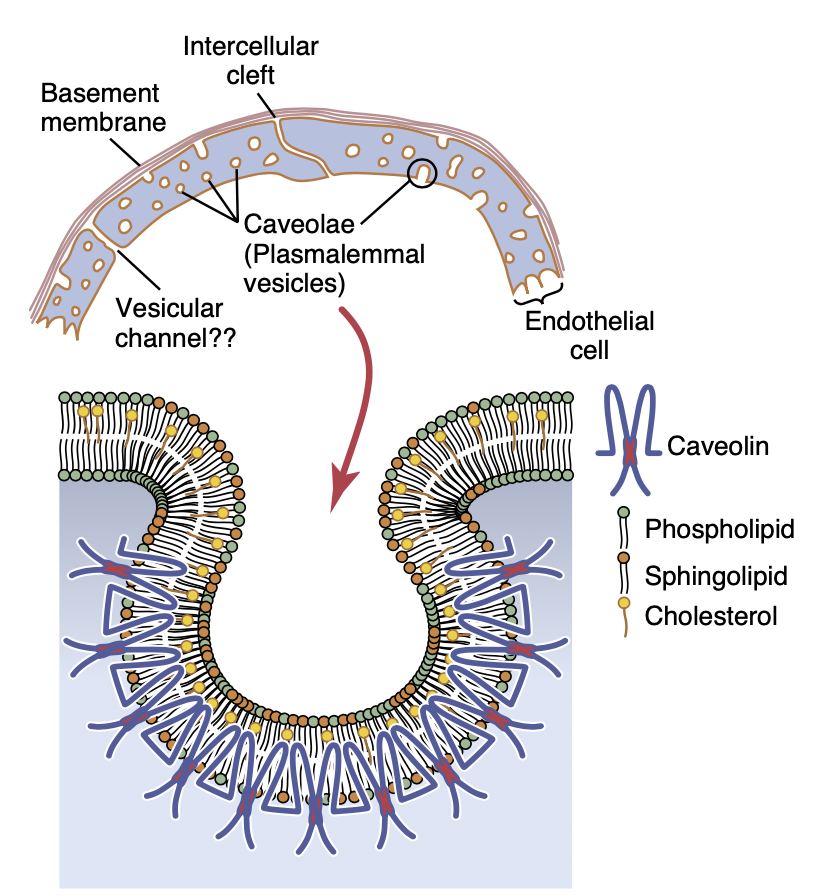
Figure 16-2. Structure of the capillary wall. Note especially the in- tercellular cleft at the junction between adjacent endothelial cells. It is believed that most water-soluble substances diffuse through the capillary membrane along the clefts. Small membrane invaginations, called caveolae, are believed to play a role in transporting macromol- ecules across the cell membrane. Caveolae contain caveolins, which are proteins that interact with cholesterol and polymerize to form the caveolae.
特定の器官における毛細血管孔の特殊な種類
一部の器官の毛細血管にある孔には、その器官の特定のニーズに対応する特殊な特徴があります。以下はその特徴のいくつかです:
- 脳(brain)では、毛細血管内皮細胞の接合部は主に密着結合(tight junctions)で構成されており、水(water)、酸素(oxygen)、二酸化炭素(carbon dioxide)などの非常に小さな分子だけが脳組織に出入りできます。
- 肝臓(liver)では、毛細血管内皮細胞間の裂孔はほぼ開放されており、血漿タンパク質(plasma proteins)を含むほぼすべての血漿中の溶解物が血液から肝組織に移行できます。
- 消化管毛細血管膜(gastrointestinal capillary membranes)の孔は、筋肉(muscles)と肝臓の中間の大きさです。
- 腎臓の糸球体毛細血管(glomerular capillaries of the kidney)には、小さな楕円形の窓(フェネストラ(fenestrae))が内皮細胞の中央部を貫通しており、血漿タンパク質(plasma proteins)を除く大量の小分子やイオン物質が糸球体を通過して濾過されます。
毛細血管内の血液流—血管運動(Vasomotion)
血液は通常、毛細血管を連続的に(continuously)流れるわけではありません。代わりに、数秒から数分ごとに断続的に(intermittently)流れます。この断続性の原因は、血管運動(vasomotion)という現象にあり、これは終末細動脈や前毛細血管括約筋(場合によっては非常に小さな細動脈さえも)の断続的な収縮(contraction)を意味します。
血管運動の調節
前毛細血管括約筋(precapillary sphincters)の開閉に影響を与える最も重要な要因は、組織内の酸素濃度(oxygen concentration)です。組織の酸素使用率が高い場合、つまり組織の酸素濃度が正常値を下回ると、毛細血管血流の断続的な期間がより頻繁に発生し、各血流期間の持続時間が長くなります。これにより、毛細血管血液が組織により多くの酸素と栄養素を供給できるようになります。この効果やその他の局所組織血流を制御する多くの要因については、第17章で詳しく説明されています。
このように、毛細血管血流が断続的であるにもかかわらず、組織には非常に多くの毛細血管が存在するため、それらの全体的な機能は平均化されます。すなわち、各組織の毛細血管床を通過する平均血流速度、毛細血管内の平均毛細血管圧、および血液と周囲の間質液(interstitial fluid)との間の物質移動の平均速度が存在します。
水、栄養素、その他の物質の血液と間質液間の交換
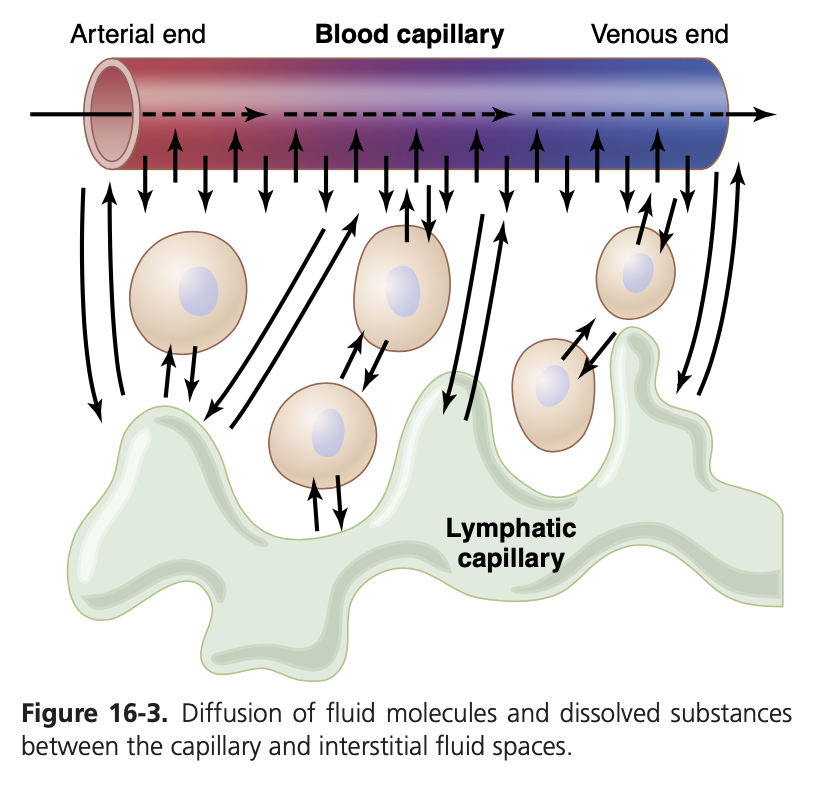
毛細血管膜を通じた拡散(Diffusion Through the Capillary Membrane)は、血漿(plasma)と間質液(interstitial fluid)の間で物質を移動させる最も重要な手段です。図16-3は、血液が毛細血管の内腔を流れる間に、多数の水分子や溶解した粒子が毛細血管壁を行き来し、間質液と血漿が絶えず混合される様子を示しています。電解質(electrolytes)、栄養素(nutrients)、代謝廃棄物(waste products of metabolism)はすべて、毛細血管膜を容易に拡散します。タンパク質(proteins)は、血漿や間質液の中で溶解している成分の中で唯一、毛細血管膜を容易に通過しません。
脂溶性物質の拡散(Diffusion of Lipid-Soluble Substances)
もし物質が脂溶性(lipid-soluble)であれば、毛細血管の細胞膜(cell membrane)を直接拡散して通過することができます。これには、酸素(oxygen)や二酸化炭素(carbon dioxide)が含まれます。これらの物質は毛細血管膜のあらゆる部分を透過できるため、脂溶性ではない物質、例えばナトリウムイオン(sodium ions)やグルコース(glucose)の場合に比べて、毛細血管膜を通過する速度ははるかに速くなります。
水溶性・非脂溶性物質の拡散(Diffusion of Water-Soluble, Non-Lipid-Soluble Substances)
多くの物質、特に組織が必要とする物質は水溶性(water-soluble)ですが、内皮細胞の脂質膜を通過することはできません。これには、水分子、ナトリウムイオン、塩化物イオン(chloride ions)、グルコースなどが含まれます。毛細血管の表面積のうち、内皮細胞間の細胞間裂孔(intercellular clefts)は全体の1/1000にすぎませんが、分子の熱運動の速度が非常に速いため、この小さな面積でも水分や水溶性物質が大量に拡散するのに十分です。たとえば、水分子が毛細血管膜を拡散する速度は、血漿そのものが毛細血管内を線形に流れる速度の約80倍にも達します。つまり、血漿の水分は毛細血管を流れる途中で、間質液との間で80回も交換されます。
分子の大きさが孔の通過に与える影響(Effect of Molecular Size on Passage Through the Pores)
毛細血管の細胞間裂孔の幅である6〜7ナノメートルは、水分子の直径の約20倍です。水分子は、通常毛細血管孔を通過する最小の分子です。血漿タンパク質分子の直径は、裂孔の幅をわずかに上回ります。ナトリウムイオン、塩化物イオン、グルコース、尿素(urea)などの他の物質は、中間的な直径を持っています。したがって、毛細血管孔の透過性は分子の直径に応じて異なります。
表16-1には、さまざまな物質に対する骨格筋の毛細血管孔の相対透過性が示されています。たとえば、グルコース分子に対する透過性は水分子に対する透過性の0.6倍であり、アルブミン(albumin)分子に対する透過性は水分子に対する透過性のわずか1/1000です。
| 物質 (Substance) | 分子量 (Molecular Weight) | 透過性 (Permeability) |
|---|---|---|
| 水 (Water) | 18 | 1.00 |
| 塩化ナトリウム (NaCl) | 58.5 | 0.96 |
| 尿素 (Urea) | 60 | 0.80 |
| グルコース (Glucose) | 180 | 0.60 |
| スクロース (Sucrose) | 342 | 0.40 |
| イヌリン (Inulin) | 5000 | 0.20 |
| ミオグロビン (Myoglobin) | 17600 | 0.03 |
| ヘモグロビン (Hemoglobin) | 68000 | 0.01 |
| アルブミン (Albumin) | 69000 | 0.001 |
注意点として、各組織の毛細血管の透過性には大きな違いがあります。たとえば、肝臓毛細血管洞(liver capillary sinusoids)の膜は非常に透過性が高く、血漿タンパク質を含むほとんどの物質が水や他の物質とほぼ同じように通過します。また、腎臓の糸球体膜は、水や電解質に対して筋肉の毛細血管膜の500倍の透過性を持っていますが、これは血漿タンパク質には当てはまりません。タンパク質に対する毛細血管の透過性は他の組織や臓器と同様に非常に低いです。後の章でこれらの器官について学ぶ際に、なぜ一部の組織では毛細血管の透過性が他の組織よりも高い必要があるのかが理解できるでしょう。たとえば、肝臓では、血液と肝細胞の間で大量の栄養素を移動させるために高い透過性が必要です。また、腎臓では、大量の液体を濾過し、尿を形成するために、より多くの透過性が必要です。
毛細血管膜を通じた拡散は、膜の両側の濃度差に比例する(Diffusion Through the Capillary Membrane Is Proportional to the Concentration Difference Between the Two Sides of the Membrane)
毛細血管膜の両側の濃度差が大きいほど、膜を通じて物質が一方向に移動する速度が速くなります。たとえば、毛細血管血液(capillary blood)中の酸素濃度は、通常、間質液よりも高いため、通常、大量の酸素が血液から組織に向かって移動します。逆に、二酸化炭素(carbon dioxide)の濃度は組織で血液よりも高く、これが余分な二酸化炭素を血液に移動させ、組織から運び去ることになります。
毛細血管膜を通じた栄養素の拡散速度は非常に速いため、わずかな濃度差でも血漿と間質液の間で十分な物質の移動が行われます。たとえば、毛細血管外部の間質液における酸素濃度は、血液中の濃度よりも数%低いにすぎませんが、このわずかな差でも、必要な酸素を組織に供給するのに十分な量の酸素が血液から間質に移動します。体が非常に活発な状態にあるときには、毎分数リットルもの酸素が供給されることさえあります。
間質および間質液(INTERSTITIUM AND INTERSTITIAL FLUID)
体の総体積の約6分の1は、細胞間の空間(spaces between cells)であり、これらは総称して間質(interstitium)と呼ばれます。この空間にある液体は間質液(interstitial fluid)と呼ばれます。
間質の構造は、図16-4に示されているように、2つの主要な固体構造(solid structures)を含んでいます:
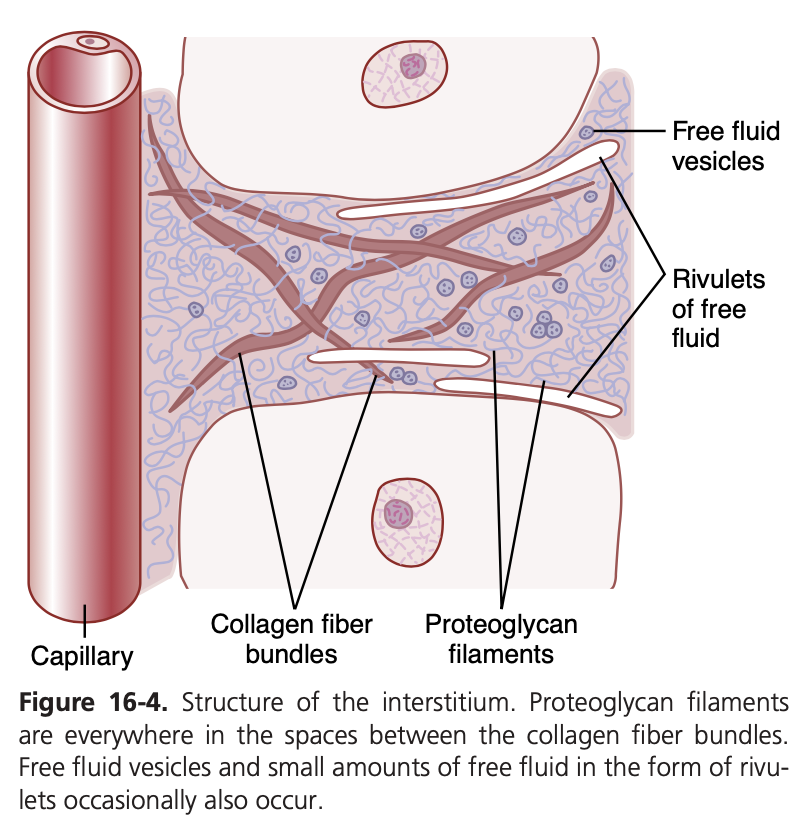
- コラーゲン線維束(collagen fiber bundles)
- プロテオグリカン線維(proteoglycan filaments)
コラーゲン線維束は間質内で長い距離にわたって伸びており、非常に強力で、組織の引張強度のほとんどを提供します。一方、プロテオグリカン線維は非常に細く、約98%がヒアルロン酸(hyaluronic acid)、2%がタンパク質(protein)で構成された巻き付いた分子です。これらの分子は非常に細いため、光学顕微鏡では見えず、電子顕微鏡でも確認が難しいです。それにもかかわらず、これらは非常に細かい網目状の網状線維(reticular filaments)を形成しており、これをブラシ状(brush pile)として適切に表現されています。
間質内のゲル(Gel in the Interstitium)
間質内の液体は、主に毛細血管からの濾過や拡散によって供給されます。その成分は血漿とほぼ同じですが、毛細血管の孔を通り抜けるタンパク質が少ないため、タンパク質の濃度ははるかに低いです。この間質液は、主にプロテオグリカン線維の間の微細な空間に閉じ込められています。このプロテオグリカン線維とそれに閉じ込められた液体の組み合わせは、ゲルの特性を持っているため、組織ゲル(tissue gel)と呼ばれます。
プロテオグリカン線維が大量に存在するため、液体が組織ゲルを容易に流れることは困難です。代わりに、液体は主にゲルを拡散し、すなわち分子が熱運動によって一つ一つ移動します。
間質内の自由水(Free Fluid in the Interstitium)
間質液のほとんどは通常、組織ゲル(tissue gel)に閉じ込められていますが、時折、少量の自由水や小さな自由水小胞(free fluid vesicles)も存在します。これらは、プロテオグリカン分子から自由であり、自由に流れることができます。色素を血流に注入すると、通常、自由水がコラーゲン線維や細胞表面に沿って流れる様子が観察されます。
正常な組織における自由水の量はわずかであり、通常1%未満です。逆に、組織が浮腫(edema)を発症すると、これらの小さなポケットや自由水の流れが大幅に拡大し、浮腫液の半分以上がプロテオグリカン線維に結びついていない自由流動性液(free-flowing fluid)となります。
毛細血管を越えた液体のろ過(FLUID FILTRATION ACROSS CAPILLARIES)
毛細血管内の静水圧(hydrostatic pressure)は、液体と溶解した物質を毛細血管の孔を通して間質空間(interstitial spaces)に押し出そうとする力です。反対に、血漿タンパク質(plasma proteins)によって引き起こされる浸透圧(osmotic pressure)は、膠質浸透圧(colloid osmotic pressure)と呼ばれ、間質空間から血液中へ液体を浸透(osmosis)させる働きをします。通常、この膠質浸透圧は、血液から間質空間への顕著な液体損失を防ぐ役割を果たします。
また、重要なのは、リンパ系(lymphatic system)です。このリンパ系は、血液から間質空間に漏れ出た少量の余分なタンパク質と液体を血流に戻す役割を果たします。本章の残りの部分では、毛細血管ろ過(capillary filtration)とリンパ流の機能が、血漿(plasma)と間質液(interstitial fluid)のそれぞれの体積を調整するためにどのように協力して働くのかについて説明します。
液体の移動を決定する静水圧および膠質浸透力(Hydrostatic and Colloid Osmotic Forces Determine Fluid Movement Through the Capillary Membrane)
図16-5に示されているように、液体が血液から間質液に移動するか、またはその逆方向に移動するかを決定する主な4つの力があります。これらの力はスターリング力(Starling forces)と呼ばれ、これは生理学者のアーネスト・スターリング(Ernest Starling)がその重要性を最初に明らかにしたことにちなんでいます。
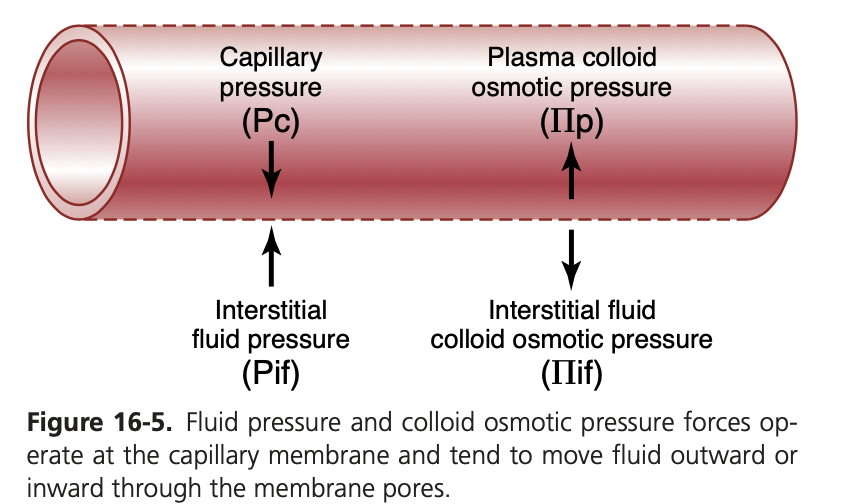
- 毛細血管静水圧(Capillary hydrostatic pressure, Pc):これは毛細血管膜を通して液体を外側に押し出そうとする圧力です。
- 間質液静水圧(Interstitial fluid hydrostatic pressure, Pif):Pifが正である場合、液体を内側に押し戻そうとし、負の場合、液体を外側に押し出そうとします。
- 毛細血管血漿膠質浸透圧(Capillary plasma colloid osmotic pressure, Πp):これは毛細血管膜を通して液体を内側に引き込む力として働きます。
- 間質液膠質浸透圧(Interstitial fluid colloid osmotic pressure, Πif):これは毛細血管膜を通して液体を外側に引き出そうとします。
これらの力の合計、すなわち正味ろ過圧(net filtration pressure, NFP)が正の場合、毛細血管を越えて液体がろ過(filtration)されます。逆に、スターリング力の合計が負の場合、間質空間から毛細血管内へ液体が吸収(absorption)されます。正味ろ過圧(NFP)は次の式で計算されます:
NFP = Pc − Pif − Πp + Πif
後述するように、正常条件下ではNFPはわずかに正となり、ほとんどの臓器で毛細血管を越えて間質空間に向けて液体がろ過されます。また、組織における液体のろ過速度は、各毛細血管の孔(pores)の数と大きさ、および血液が流れている毛細血管の数によっても決まります。これらの要因は通常、毛細血管ろ過係数(capillary filtration coefficient, Kf)として一括して表現されます。Kfは、特定のNFPに対して毛細血管膜が水をろ過する能力の尺度であり、通常はml/min per mm Hg NFPという単位で表されます。
したがって、毛細血管での液体ろ過速度は以下の式で決定されます:
ろ過(Filtration) = Kf × NFP
次のセクションでは、毛細血管での液体ろ過速度を決定する各力について詳しく説明します。
毛細血管静水圧(CAPILLARY HYDROSTATIC PRESSURE)
毛細血管の静水圧を推定するさまざまな方法があり、代表的な方法は以下の2つです:
- 直接マイクロピペットカニュレーション法(Direct micropipette cannulation):これは、動物の露出した組織や人間の爪甲の基部(eponychium)の大きな毛細血管ループにガラス製のマイクロピペットを挿入して圧力を測定する方法です。毛細血管の動脈端では30〜40 mmHg、静脈端では10〜15 mmHg、中央部分では約25 mmHgの圧力が得られます。
- 間接的機能測定法(Indirect functional measurement):この方法では、骨格筋や腸管の毛細血管で平均約17 mmHgの圧力が得られます。
このように、毛細血管内圧は組織や生理的条件によって大きく異なることがわかります。
間質液静水圧(INTERSTITIAL FLUID HYDROSTATIC PRESSURE)
間質液の静水圧を測定する方法は複数あり、それぞれ若干異なる値を提供します。皮下組織(subcutaneous tissue)のような緩い組織では、測定方法に関わらず、間質液圧は大気圧よりも数mmHg低く、通常は負の圧力になります。これは負の間質液圧(negative interstitial fluid pressure)と呼ばれます。一方、腎臓(kidney)のような被膜(capsule)に囲まれた組織では、間質圧は通常正であり、大気圧よりも高くなります。
間質圧測定方法(Methods for Measuring Interstitial Fluid Pressure)
- マイクロピペット法(Micropipette method):これは毛細血管圧の測定に用いられるのと同じピペットで、自由液体のポケット(free fluid pocket)内の圧力を測定します。この方法で測定された圧力は、通常、皮膚のような緩い組織で-2から+2 mmHgの範囲であり、平均してわずかに大気圧より低いです。
- 中空カプセル法(Perforated hollow capsule method):皮下組織でこの方法を使用した場合、通常は-6 mmHg程度の圧力が測定されますが、小さなカプセルを使用すると-2 mmHgに近い値が得られます。
圧力が正の組織(Interstitial Fluid Pressures in Tightly Encased Tissues)
一部の組織は、頭蓋骨(cranial vault)や腎臓の線維性被膜(fibrous capsule)、筋肉を囲む筋膜(fibrous sheaths)、眼球の強膜(sclera)のように、強固な構造物に囲まれています。これらの組織では、間質液圧は正であることが一般的です。しかし、それでも被膜外部からの圧力よりは低い傾向にあります。たとえば、脳(brain)の脳脊髄液圧(cerebrospinal fluid pressure)は+10 mmHgですが、脳の間質圧は+4〜+6 mmHgです。
全体的な間質液圧のまとめ(Summary: Interstitial Fluid Pressure in Loose Subcutaneous Tissue Usually Subatmospheric)
さまざまな方法による測定値は若干異なりますが、ほとんどの生理学者は、正常な皮下組織の間質液圧は通常わずかに負圧であり、平均約-3 mmHgであると考えています。
リンパ系による汲み上げ:間質液圧を負に保つ基本的な要因(Pumping by the Lymphatic System—Basic Cause of the Negative Interstitial Fluid Pressure)
リンパ系は、過剰な液体(excess fluid)、過剰なタンパク質分子(excess protein molecules)、細胞の破片(debris)などを組織間隙から取り除く役割を果たします。この過程により、間質空間における液体の圧力はわずかに負の圧力に保たれています。
血漿膠質浸透圧(PLASMA COLLOID OSMOTIC PRESSURE)
血漿タンパク質(plasma proteins)が膠質浸透圧を引き起こします。タンパク質は毛細血管の孔を通り抜けにくいため、膠質浸透圧(colloid osmotic pressure)は毛細血管膜を介して液体を内側に引き戻す主要な力として機能します。
血漿膠質浸透圧(Plasma Colloid Osmotic Pressure)
血漿膠質浸透圧(colloid osmotic pressure)は、血漿タンパク質によって引き起こされます。第4章で説明したように、半透膜の孔を通過できない分子やイオンだけが浸透圧を発生させます。したがって、血漿と間質液(interstitial fluid)に含まれるタンパク質が、毛細血管膜の両側における浸透圧の原因となります。この浸透圧は、細胞膜で生じる浸透圧と区別するために、膠質浸透圧(colloid osmotic pressure)またはオンコティック圧(oncotic pressure)と呼ばれます。
血漿膠質浸透圧の正常値(Normal Values for Plasma Colloid Osmotic Pressure)
正常なヒト血漿の膠質浸透圧は、平均して約28 mmHgです。このうち、19 mmHgは溶解したタンパク質分子の分子効果によるもので、残りの9 mmHgはドナン効果(Donnan effect)によるものです。ドナン効果とは、ナトリウムイオン、カリウムイオン、および他のカチオンが血漿タンパク質に結合していることによって引き起こされる追加の浸透圧のことです。
各種血漿タンパク質が膠質浸透圧に与える影響(Effect of the Different Plasma Proteins on Colloid Osmotic Pressure)
血漿タンパク質は、アルブミン(albumin)、グロブリン(globulin)、およびフィブリノーゲン(fibrinogen)という3つの主要な種類の混合物です。これらのタンパク質の平均分子量は、アルブミンが69,000、グロブリンが140,000、フィブリノーゲンが400,000です。したがって、1グラムのグロブリンは1グラムのアルブミンの半分の分子数を持ち、1グラムのフィブリノーゲンはアルブミンの約6分の1の分子数を持ちます。第4章で説明したように、浸透圧は、分子の質量ではなく、溶液中に溶けている分子の数によって決定されます。次の表では、正常な血漿に含まれる各種類のタンパク質の相対的な質量濃度(g/dL)と、それぞれが血漿膠質浸透圧(Πp)にどれだけ寄与しているかを示しています。これらの値には、タンパク質に結合しているイオンによるドナン効果も含まれます。
| タンパク質の種類 | g/dL | 膠質浸透圧(Πp)mmHg |
|---|---|---|
| アルブミン(Albumin) | 4.5 | 21.8 |
| グロブリン(Globulin) | 2.5 | 6.0 |
| フィブリノーゲン(Fibrinogen) | 0.3 | 0.2 |
| 合計(Total) | 7.3 | 28.0 |
間質液膠質浸透圧(Interstitial Fluid Colloid Osmotic Pressure)
間質液(interstitial fluid)中のタンパク質濃度は、組織ごとに異なりますが、全体としては血漿中のタンパク質量の約40%に相当します。つまり、間質液中のタンパク質濃度は通常約3 g/dLです。これにより、間質液の膠質浸透圧は約8 mmHgとなります。
毛細血管膜を介した液体の体積交換(Fluid Volume Exchange Through the Capillary Membrane)
これまで説明してきた毛細血管膜を介した液体の移動に影響を与える要因をすべてまとめて、毛細血管系がどのようにして血漿と間質液の正常な体積分布を維持するかを見てみましょう。
毛細血管の動脈端の平均圧力は、静脈端よりも15~25 mmHg高くなっています。この圧力差のために、毛細血管の動脈端では液体が毛細血管から間質空間にろ過されますが、静脈端では液体が再吸収されます(図16-3参照)。したがって、実際には毛細血管の動脈端から静脈端に向けて液体が組織を「流れ」ていることになります。次に、この流れの力学を分析してみましょう。
動脈端におけるろ過を引き起こす力の分析(Analysis of the Forces Causing Filtration at the Arterial End of the Capillary)テスト出る!(圧の計算のところ)
毛細血管の動脈端での液体移動に関与する力は次の通りです:
| 外向きの力(Forces Tending to Move Fluid Outward) | |
|---|---|
| 毛細血管静水圧(動脈端) Capillary pressure (arterial end of capillary) | 30 |
| 間質液静水圧(負) Negative interstitial free fluid pressure | 3 |
| 間質液膠質浸透圧 Interstitial fluid colloid osmotic pressure | 8 |
| 合計外向きの力(Total Outward Force) | 41 |
| 内向きの力(Forces Tending to Move Fluid Inward) | |
|---|---|
| 血漿膠質浸透圧 | 28 |
| 合計内向きの力(Total Inward Force) | 28 |
| 合計の力の合計(Summation of Forces) | |
|---|---|
| 外向きの力(Outward) | 41 |
| 内向きの力(Inward) | 28 |
| 正味外向きの力(Net Outward Force) | 13 |
したがって、動脈端での力の合計を示すと、毛細血管孔を通して外向きに液体を移動させる正味ろ過圧が13 mmHgとなります。この13 mmHgのろ過圧により、流れる血漿の約1/200が毛細血管の動脈端から間質空間にろ過されます。
静脈端における再吸収の分析(Analysis of Reabsorption at the Venous End of the Capillary)
毛細血管の静脈端での血圧が低いため、力のバランスが再吸収に有利に働きます。静脈端での力の内訳は次の通りです:
| 内向きの力(Forces Tending to Move Fluid Inward) | |
|---|---|
| 血漿膠質浸透圧 | 28 |
| 合計内向きの力(Total Inward Force) | 28 |
| 外向きの力(Forces Tending to Move Fluid Outward) | |
|---|---|
| 毛細血管静水圧(静脈端) | 10 |
| 間質液静水圧(負) | 3 |
| 間質液膠質浸透圧 | 8 |
| 合計外向きの力(Total Outward Force) | 21 |
| 合計の力の合計(Summation of Forces) | |
|---|---|
| 内向きの力(Inward) | 28 |
| 外向きの力(Outward) | 21 |
| 正味内向きの力(Net Inward Force) | 7 |
したがって、静脈端では7 mmHgの正味再吸収圧が存在します。この再吸収圧は動脈端のろ過圧よりも小さいですが、静脈側の毛細血管は数が多く、また透過性も高いため、これらの条件下でも液体が内向きに移動します。
再吸収圧により、動脈端から毛細血管にろ過された液体の約90%が静脈端で再吸収されます。残りの10%はリンパ管に入り、血液循環に戻されます。
スターリングの毛細血管交換平衡(Starling Equilibrium for Capillary Exchange)
エルネスト・スターリング(Ernest Starling)は100年以上前に、正常な条件下ではほとんどの毛細血管でほぼ平衡状態が存在することを指摘しました。すなわち、毛細血管の動脈端から外向きにろ過される液体の量は、静脈端で吸収される液体の量とほぼ等しくなります。実際には若干の不均衡が存在し、このわずかな不均衡がリンパ系によって最終的に循環に戻される液体を引き起こします。
次の表では、スターリングの平衡の原則を示しています。この表では、毛細血管の動脈側と静脈側の圧力を平均して、毛細血管全体の平均機能的圧力を計算しています。この平均機能的毛細血管圧は、17.3 mmHgと計算されています。
毛細血管交換におけるスターリングの平衡(Starling Equilibrium for Capillary Exchange)
Mean Forces Tending to Move Fluid Outward | mmHg |
|---|---|
| Tending to Move Fluid Outward | |
| Mean capillary pressure | 17.3 |
| Negative interstitial fluid hydrostatic pressure | 3.0 |
| Interstitial fluid colloid osmotic pressure | 8.0 |
| TOTAL OUTWARD FORCE | 28.3 |
| Tending to Move Fluid Inward | |
| Plasma colloid osmotic pressure | 28.0 |
| TOTAL INWARD FORCE | 28.0 |
| Summation of Mean Forces | |
| Outward | 28.3 |
| Inward | 28.0 |
| NET OUTWARD FORCE | 0.3 |
したがって、全毛細血管循環では、外向きの総力が28.3 mmHg、内向きの総力が28.0 mmHgであり、ほぼ平衡状態にあります。このわずかな力の不均衡(0.3 mmHg)は、毛細血管から間質空間に対してわずかに多くの液体がろ過される原因となります。このわずかな過剰ろ過が正味ろ過(net filtration)と呼ばれ、この液体は最終的にリンパ系を通じて循環に戻されます。体全体での通常の正味ろ過速度は、腎臓を除いて約2 ml/分に過ぎません。
毛細血管ろ過係数(Capillary Filtration Coefficient)
前の例では、毛細血管膜での平均正味力の不均衡が0.3 mmHgであるとき、体全体での正味ろ過速度は2 ml/分でした。したがって、1 mmHgの不均衡に対しての正味ろ過速度を表すと、体全体でのろ過速度は6.67 ml/分/mmHgとなります。この値は体全体の毛細血管ろ過係数(whole body capillary filtration coefficient)と呼ばれます。
ろ過係数は、個々の部位ごとに、100グラムの組織あたり1 mmHgの圧力差に対して1分間あたりのろ過速度としても表すことができます。平均的な組織の毛細血管ろ過係数は、約0.01 ml/分/mmHg/100gの組織です。しかし、異なる組織の毛細血管系における透過性や表面積の極端な違いにより、この係数は組織によって100倍以上の差があります。例えば、脳や筋肉では非常に小さく、皮下組織では中程度の大きさであり、腸では大きく、肝臓や腎臓の糸球体では非常に大きいです。これらの部位では、毛細血管の表面積が大きく、孔が多数あるか、広く開いています。
| 組織 | 毛細血管ろ過係数(Kf) |
|---|---|
| 脳、筋肉 | 非常に小さい |
| 皮下組織 | 中程度 |
| 腸 | 大きい |
| 肝臓、腎臓の糸球体 | 非常に大きい |
同様に、毛細血管膜を通過するタンパク質の浸透度も大きく異なります。筋肉の間質液中のタンパク質濃度は約1.5 g/dLで、皮下組織では2 g/dL、腸では4 g/dL、肝臓では6 g/dLです。
毛細血管膜における力の不均衡の影響(Effect of Abnormal Imbalance of Forces at the Capillary Membrane)
もし毛細血管圧が平均値である17 mmHgを大幅に上回ると、組織空間への液体のろ過を引き起こす正味力が増加します。例えば、毛細血管圧が20 mmHg上昇すると、正味ろ過圧が0.3 mmHgから20.3 mmHgに増加し、正味ろ過速度は通常の68倍に増加します。このような大量の液体がリンパ系に運ばれるのを防ぐためには、リンパ系が68倍の流量で液体を処理する必要がありますが、これはリンパ系が処理できる量の2~5倍の量です。その結果、液体が間質空間に蓄積し、**浮腫(edema)**が発生します。
逆に、毛細血管圧が非常に低くなると、正味吸収が行われ、毛細血管から液体が再吸収されることになります。この結果、血液量が増加し、間質液の体積が減少します。この毛細血管膜での力の不均衡が浮腫の異なるタイプの発生に関連していることについては、第25章でさらに詳しく説明されます。
リンパ系(Lymphatic System)
リンパ系は、間質空間から血液への余剰の液体やタンパク質を運ぶための補助的な経路を表しています。特に重要なのは、リンパ系が組織空間からタンパク質や大きな粒子状物質を運び出すことができる点で、これらは直接血液の毛細血管に再吸収されることはありません。この間質空間からのタンパク質の血液への再吸収は重要であり、これがなければ人は24時間以内に死亡することになります。
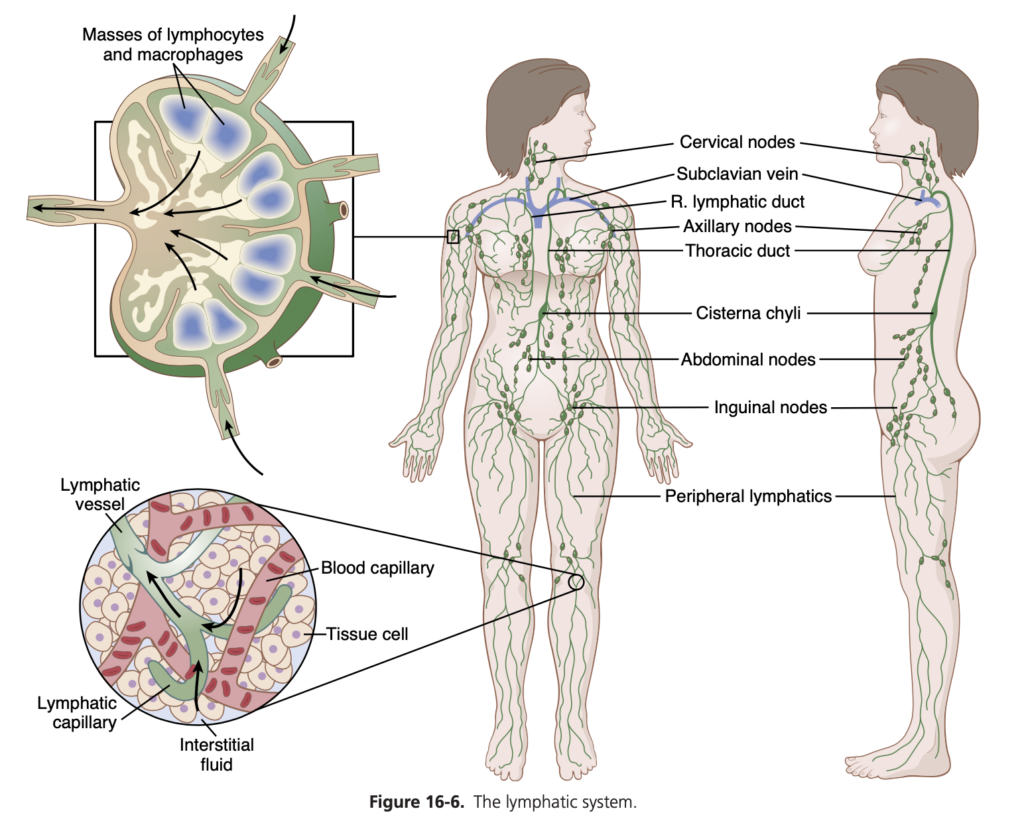
身体のリンパ管(Lymph Channels of the Body)
ほぼすべての体組織には、間質空間から余剰の液体を直接排出するための特殊なリンパ管があります。例外には、皮膚の表面部分、中枢神経系(CNS)、筋肉の内膜(endomysium)、骨などがあります。しかし、これらの組織でさえも、リンパ前管(prelymphatics)と呼ばれる微小な間質チャンネルがあり、これらを通じて間質液が流れ、最終的にはリンパ管に排出されるか、脳の場合は**脳脊髄液(CSF)**に入り、直接血液に戻ります。
身体の下部からのほぼすべてのリンパ管は最終的に**胸管(thoracic duct)**に排出され、この胸管は左内頸静脈と左鎖骨下静脈の合流部で静脈血系に排出されます。図16-6に示すように、左頭部、左腕、胸部の一部からのリンパも胸管に入り、静脈に排出されます。
右側の頸部と頭部、右腕、胸部の一部からのリンパは、右リンパ管(thoracic ductよりはるかに小さい)に入り、右鎖骨下静脈と内頸静脈の合流部で静脈系に排出されます。
終末リンパ毛細血管とその透過性(Terminal Lymphatic Capillaries and Their Permeability)
血液毛細血管の動脈端からろ過された液体のほとんどは細胞の間を通り、最終的には血液毛細血管の静脈端に再吸収されますが、平均して約10分の1の液体がリンパ毛細血管に入り、静脈毛細血管ではなくリンパ系を通じて血液に戻ります。このリンパの総量は通常、1日に2~3リットルです。
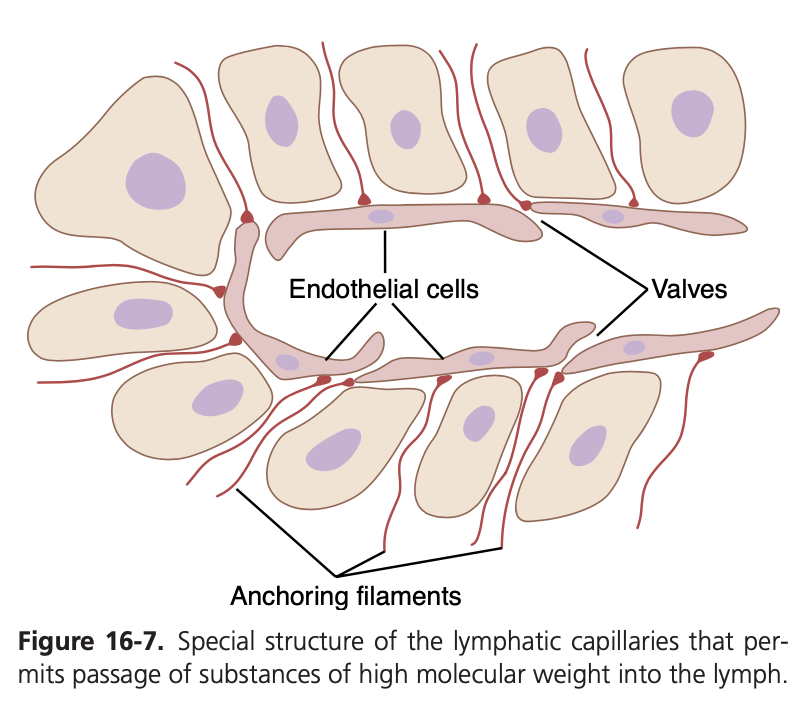
リンパ系を通じて循環に戻る液体は非常に重要です。なぜなら、タンパク質のような分子量の大きい物質は、他の方法では組織から吸収されることができないためです。しかし、これらはリンパ毛細血管にほとんど妨げられることなく入ることができます。この仕組みは、リンパ毛細血管の特別な構造によるものです。図16-7では、リンパ毛細血管の**内皮細胞(endothelial cells)**が、周囲の結合組織に固定フィラメント(anchoring filaments)で付着していることが示されています。隣接する内皮細胞の接合部では、一方の内皮細胞の端が隣接する細胞の端を重ね合わせるように配置されており、この重ね合わせた端は内側に開く小さな弁を形成し、リンパ毛細血管の内部に通じています。**間質液(interstitial fluid)**とそれに含まれる浮遊粒子はこの弁を押し開け、リンパ毛細血管内に直接流れ込みます。しかし、一度入った液体は逆流するのが難しく、逆流すると弁が閉じます。このため、リンパ系はリンパ毛細血管の先端部で弁を備えているだけでなく、より大きなリンパ管の全長にも弁が備わっており、最終的に血液循環に排出されるまでその役割を果たしています。
リンパの形成(Formation of Lymph)
リンパは、リンパ管に流入する間質液から派生しています。したがって、リンパはリンパ管に最初に入る時点では、ほぼ間質液と同じ成分を持っています。
ほとんどの組織の間質液中のタンパク質濃度は平均して約2 g/dLであり、これに由来するリンパのタンパク質濃度もこれに近い値です。肝臓で形成されるリンパは、タンパク質濃度が6 g/dLに達することもあり、腸から形成されるリンパは3~4 g/dLに達することもあります。体内のリンパの約3分の2は通常、肝臓と腸から供給されているため、胸管リンパ(thoracic duct lymph)のタンパク質濃度は通常3~5 g/dLです。
リンパ系はまた、特に食物中の脂肪のほとんどを吸収するための主要な経路の1つでもあります。食後、胸管リンパには1~2%の脂肪が含まれることがあります。
さらに、細菌のような大きな粒子も、リンパ毛細血管の内皮細胞の間を押し広げて入り込むことができます。このようにしてリンパ内に細菌が取り込まれますが、リンパがリンパ節(lymph nodes)を通過する際、これらの粒子はほぼ完全に除去され、破壊されます(詳細は第34章で説明します)。
リンパの流量(Rate of Lymph Flow)
人間が安静にしている場合、胸管を通るリンパ流量は約100 ml/時で、他のリンパ管を通る流量も約20 ml/時です。したがって、リンパの総流量は約120 ml/時、または2~3リットル/日です。
間質液圧がリンパ流量に与える影響(Effect of Interstitial Fluid Pressure on Lymph Flow)
図16-8では、異なるレベルの間質液静水圧がリンパ流量に与える影響を動物で測定した結果を示しています。注目すべきは、間質液圧が正常の−6 mmHgよりも低い場合、リンパ流量はほとんどないことです。そして、間質液圧が0 mmHg(大気圧)に達すると、流量が20倍以上に増加します。したがって、間質液圧を増加させる要因は、リンパ管が正常に機能している場合にはリンパ流量を増加させます。これらの要因には以下が含まれます。
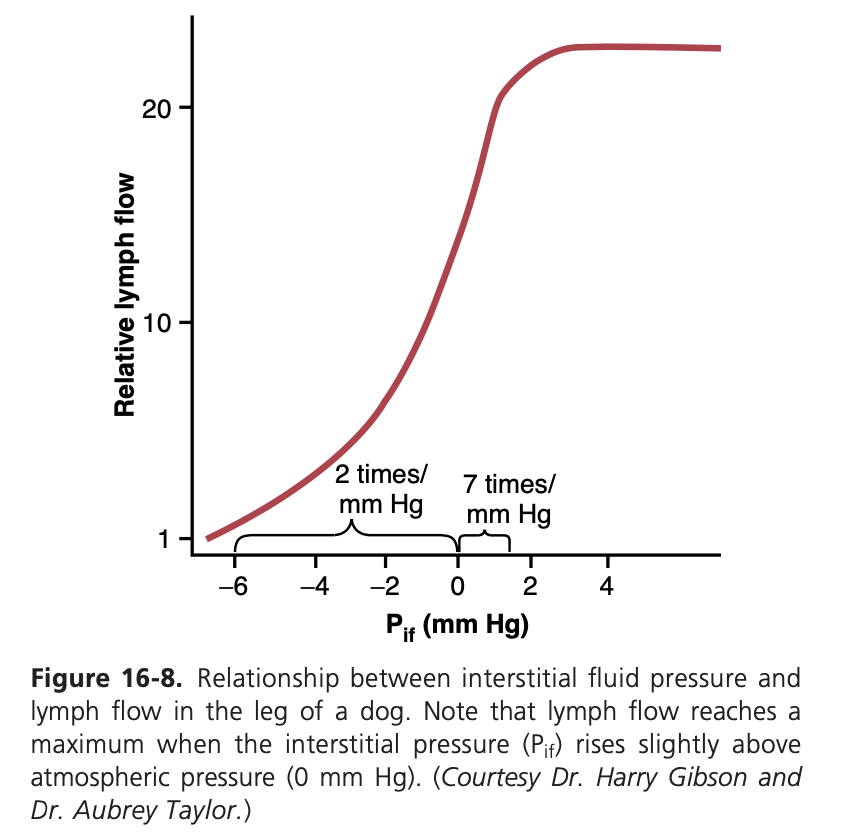
- 毛細血管静水圧の上昇(Elevated capillary hydrostatic pressure)
- 血漿膠質浸透圧の減少(Decreased plasma colloid osmotic pressure)
- 間質液膠質浸透圧の増加(Increased interstitial fluid colloid osmotic pressure)
- 毛細血管の透過性の増加(Increased permeability of the capillaries)
これらすべての要因は、間質空間への液体の移動を促進し、その結果、間質液の体積、間質液圧、そしてリンパ流量が同時に増加します。
リンパポンプによるリンパ流量の増加(Lymphatic Pump Increases Lymph Flow)
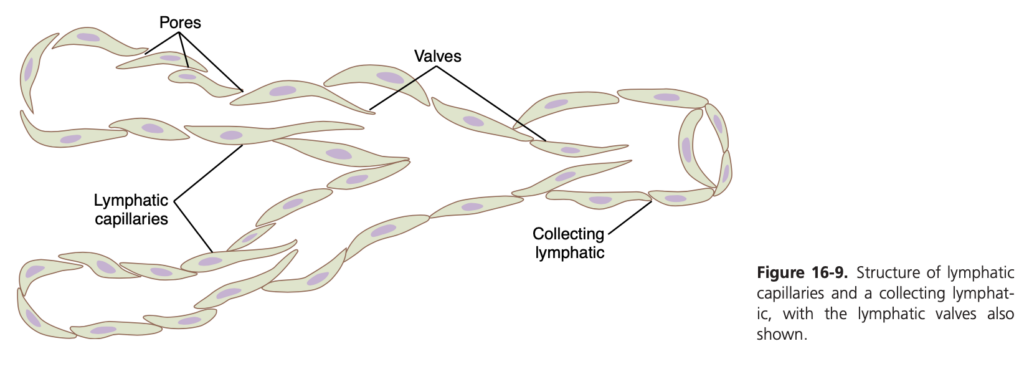
リンパ系には、すべてのリンパ管に**弁(valves)が存在します。図16-9に示すように、リンパ毛細血管が排出される収集リンパ管(collecting lymphatics)**にも典型的な弁があります。
動物や人間で観察されたリンパ管のビデオによると、収集リンパ管やより大きなリンパ管が液体で伸展すると、リンパ管の壁にある平滑筋(smooth muscle)が自動的に収縮することがわかっています。さらに、弁と弁の間の各リンパ管の部分は自動ポンプ(automatic pump)として機能します。すなわち、ほんのわずかな充満であっても、その部分は収縮し、液体が次の弁を通じて次のリンパ管セグメントにポンプ送されます。この液体が次のセグメントを充満させ、数秒後にはそれもまた収縮し、このプロセスはリンパ管全体にわたって続き、最終的に液体は血液循環に排出されます。非常に大きなリンパ管、例えば胸管(thoracic duct)では、このリンパポンプは50~100 mmHgの圧力を生成することができます。
外部からの断続的なリンパ管圧縮によるポンピング(Pumping Caused by External Intermittent Compression of the Lymphatics)
リンパ管の内壁の自動収縮によるポンピングに加えて、外部からの要因がリンパ管を断続的に圧迫することでもポンピングが行われます。重要度の順に、次のような要因がリンパポンプを引き起こします。
- 周囲の骨格筋の収縮(Contraction of surrounding skeletal muscles)
- 体の部位の動き(Movement of the parts of the body)
- リンパ管に隣接する動脈の拍動(Pulsations of arteries adjacent to the lymphatics)
- 外部からの物体による組織の圧迫(Compression of the tissues by objects outside the body)
リンパポンプは、運動中に非常に活発になり、リンパ流量が10~30倍に増加することがあります。逆に、休息中にはリンパ流量は非常に少なく(ほとんどゼロに近い)なります。
リンパ毛細血管ポンプ(Lymphatic Capillary Pump)
**終末リンパ毛細血管(terminal lymphatic capillary)も、より大きなリンパ管によるポンピングに加えてリンパのポンピングが可能です。前述のように、リンパ毛細血管の壁にあるアンカリングフィラメント(anchoring filaments)は、周囲の組織細胞にしっかりと固定されています。そのため、余剰な液体が組織に入り組織が膨らむたびに、アンカリングフィラメントがリンパ毛細血管の壁を引っ張り、液体が内皮細胞の間の接合部を通ってリンパ毛細血管内に流れ込みます。その後、組織が圧縮されると、リンパ毛細血管内の圧力が上昇し、内皮細胞の重なり合った端が弁(valves)**のように閉じます。したがって、圧力はリンパを収集リンパ管に押し進め、細胞接合部を通じた逆流を防ぎます。
リンパ毛細血管の内皮細胞にも、いくつかの収縮性のアクトミオシンフィラメント(contractile actomyosin filaments)が含まれています。動物の組織(例:コウモリの翼)では、これらのフィラメントがリンパ毛細血管のリズミカルな収縮を引き起こすことが観察されています。この収縮は、血管やより大きなリンパ管が収縮するリズムと同様です。したがって、リンパポンピングの少なくとも一部は、筋性リンパ管の収縮に加えてリンパ毛細血管の内皮細胞の収縮によるものである可能性があります。
リンパ流量を決定する要因のまとめ(Summary of Factors That Determine Lymph Flow)
前述のように、リンパ流量を決定する2つの主な要因は次の通りです。
- 間質液圧(Interstitial fluid pressure)
- リンパポンプの活動(Activity of the lymphatic pump)
したがって、リンパ流量の速度は間質液圧とリンパポンプの活動の積によっておおよそ決定されます。
リンパ系が間質液タンパク質濃度、体積、および圧力を制御する上での重要な役割(Lymphatic System Plays a Key Role in Controlling Interstitial Fluid Protein Concentration, Volume, and Pressure)
リンパ系は、余剰なタンパク質や体積を間質空間から循環に戻すオーバーフローの仕組みとして機能します。したがって、リンパ系は次のような要素の中心的な役割を担っています。
- 間質液中のタンパク質濃度(Protein concentration in the interstitial fluids)
- 間質液の体積(Volume of interstitial fluid)
- 間質液圧(Interstitial fluid pressure)
これらの要素がどのように相互作用するかを次に説明します。
- 血液毛細血管からは常に少量のタンパク質が間質に漏れ出しています。これらの漏れ出たタンパク質は、血液毛細血管の静脈端から再吸収されることはほとんどなく、これらは間質液に蓄積します。その結果、間質液の膠質浸透圧が増加します。
- 間質液の膠質浸透圧が増加すると、毛細血管膜での力のバランスが間質液への液体ろ過を促進する方向に変わります。したがって、実質的に液体が毛細血管の壁を越えて外側に浸透し、間質液の体積と間質液圧が増加します。
- 間質液圧が増加すると、リンパ流量が大幅に増加し、間質空間に蓄積した余剰の間質液体積と余剰タンパク質が排出されます。
このようにして、間質液中のタンパク質濃度があるレベルに達し、それに伴い間質液体積と間質液圧も上昇すると、これらの余剰物をリンパ系によって戻す速度が、毛細血管から間質液に漏れ出る速度とバランスを取ります。したがって、これらの要素の量は安定状態に達し、外部の要因が毛細血管からの漏出速度を変化させない限り、この状態が維持されます。
組織を結びつけるための間質液の負圧の重要性(Significance of Negative Interstitial Fluid Pressure for Holding Body Tissues Together)
伝統的には、身体のさまざまな組織が結合組織繊維によって保持されていると考えられてきました。しかし、特定の場所では結合組織繊維が非常に弱かったり、場合によってはほとんど存在しないことがあります。特に、例えば皮膚が手の甲や顔の背後を滑るような場所では、結合組織が存在していません。しかし、そのような場所でも、組織は負の間質液圧によって保持されています。これが実際には部分的な真空となっています。組織がこの負圧を失うと、液体が空間に蓄積し、**浮腫(edema)**と呼ばれる状態が発生します。この状態については、第25章で詳しく説明されます。


コメント