Contents
- 1 第15章 血管の伸展性と動脈および静脈系の機能
- 2 血管のコンプライアンス(容積保持能)(Vascular Compliance or Vascular Capacitance)
- 3 動脈および静脈循環の体積-圧力曲線(Volume-Pressure Curves of the Arterial and Venous Circulations)
- 4 動脈圧の脈動(Arterial Pressure Pulsations)
- 5 異常な圧力脈波形(Abnormal Pressure Pulse Contours)
- 6 圧力脈波の末梢動脈への伝達(Transmission of Pressure Pulses to the Peripheral Arteries)
- 7 収縮期圧および拡張期圧を測定する臨床的な方法(Clinical Methods for Measuring Systolic and Diastolic Pressures)
- 8 静脈とその機能(Veins and Their Functions)
- 9 静脈圧 ― 右心房圧(中心静脈圧)および末梢静脈圧(Venous Pressures – Right Atrial Pressure (Central Venous Pressure) and Peripheral Venous Pressures)
- 10 静脈抵抗および末梢静脈圧(Venous Resistance and Peripheral Venous Pressure)
- 11 静脈圧の臨床的な推定(Clinical Estimation of Venous Pressure)
- 12 静脈圧および右心房圧の直接測定(Direct Measurement of Venous Pressure and Right Atrial Pressure)
- 13 静脈および他の循環圧力を測定するための圧力基準点(Pressure Reference Level for Measuring Venous and Other Circulatory Pressures)
- 14 静脈の血液貯蔵機能(Blood Reservoir Function of the Veins)
- 15 特定の血液貯蔵所(Specific Blood Reservoirs)
- 16 脾臓は赤血球の貯蔵庫(The Spleen Is a Reservoir for Red Blood Cells)
- 17 脾臓の血液浄化機能 ― 古い細胞の除去(Blood-Cleansing Function of the Spleen – Removal of Old Cells)
- 18 脾臓の網内皮細胞(Reticuloendothelial Cells of the Spleen)
第15章 血管の伸展性と動脈および静脈系の機能
血管の伸展性(Vascular Distensibility)
血管系の貴重な特性の1つは、すべての血管が伸展性(distensible)を持っていることです。動脈の伸展性は、心臓からの拍動出力(pulsatile output)を吸収し、圧力の脈動を平均化することを可能にします。この能力により、非常に小さな血管を通る血液の流れが滑らかで連続的になります。
すべての血管の中で最も伸展性が高いのは静脈(veins)です。静脈圧がわずかに上昇するだけで、静脈は0.5~1リットルの余分な血液を貯蔵することができます。したがって、静脈は大量の余分な血液を貯蔵する貯蔵タンク(reservoir)として機能し、他の循環系が血液を必要とするときに利用することができます。
血管の伸展性の単位(Units of Vascular Distensibility)
血管の伸展性は通常、次の式に従って、圧力が1 mmHg上昇するごとに体積が増加する割合として表されます:
- 血管の伸展性 = 体積の増加 / (圧力の増加 × 元の体積)
つまり、1 mmHgの圧力上昇により、もともと10 mlの血液が入っていた血管の体積が1 ml増加した場合、伸展性は1 mmHgあたり0.1、または1 mmHgあたり10%となります。
静脈は動脈よりもはるかに伸展性が高い(The Veins Are Much More Distensible Than the Arteries)
動脈の壁は静脈の壁よりも厚く、はるかに強固です。そのため、静脈は平均して動脈の約8倍の伸展性を持っています。つまり、同じ圧力上昇があった場合、同じサイズの動脈に比べて静脈には約8倍の血液が増加します。
肺循環(pulmonary circulation)では、肺静脈(pulmonary vein)の伸展性は体循環(systemic circulation)と似ています。しかし、肺動脈は通常、体循環の動脈よりも約6分の1の圧力で機能しており、それに対応して肺動脈の伸展性は体循環の動脈の約6倍です。
血管のコンプライアンス(容積保持能)(Vascular Compliance or Vascular Capacitance)
血行動態の研究では、個々の血管の伸展性を知ることよりも、ある循環系の部分で1 mmHgの圧力上昇に対してどれだけの血液を保持できるかを知る方がはるかに重要です。この値を、その血管床のコンプライアンス(compliance)またはキャパシタンス(capacitance)と呼びます。つまり、次のように定義されます:
- 血管のコンプライアンス = 体積の増加 / 圧力の増加
コンプライアンスと伸展性は大きく異なります。非常に伸展性の高い血管が小さな体積を持っている場合、伸展性が低いが大きな体積を持つ血管よりもコンプライアンスがはるかに低い可能性があります。なぜなら、コンプライアンスは伸展性に体積を掛けた値だからです。
全身静脈(systemic vein)のコンプライアンスは、対応する動脈の約24倍です。これは、静脈の伸展性が動脈の約8倍であり、体積が約3倍だからです(8 × 3 = 24)。
動脈および静脈循環の体積-圧力曲線(Volume-Pressure Curves of the Arterial and Venous Circulations)
血管や循環系の一部における圧力と体積の関係を表す便利な方法として、体積-圧力曲線(volume-pressure curve)があります。図15-1の赤い実線と青い実線は、それぞれ正常な全身動脈系(systemic arterial system)と全身静脈系(venous system)の体積-圧力曲線を示しています。平均的な成人の動脈系(すべての大動脈、小動脈、および細動脈を含む)が約700 mlの血液で満たされているとき、平均動脈圧(mean arterial pressure)は100 mmHgですが、400 mlしか血液がない場合、圧力はゼロまで低下します。
全身静脈系(systemic venous system)全体では、通常、体積は2000~3500 mlの範囲であり、この体積の変化が静脈圧(venous pressure)をわずか3~5 mmHg変化させるためには、数百ミリリットルの変化が必要です。この必要性は、健康な人に約0.5リットルの血液を数分以内に輸血しても、循環の機能が大きく変わらない理由を主に説明しています。
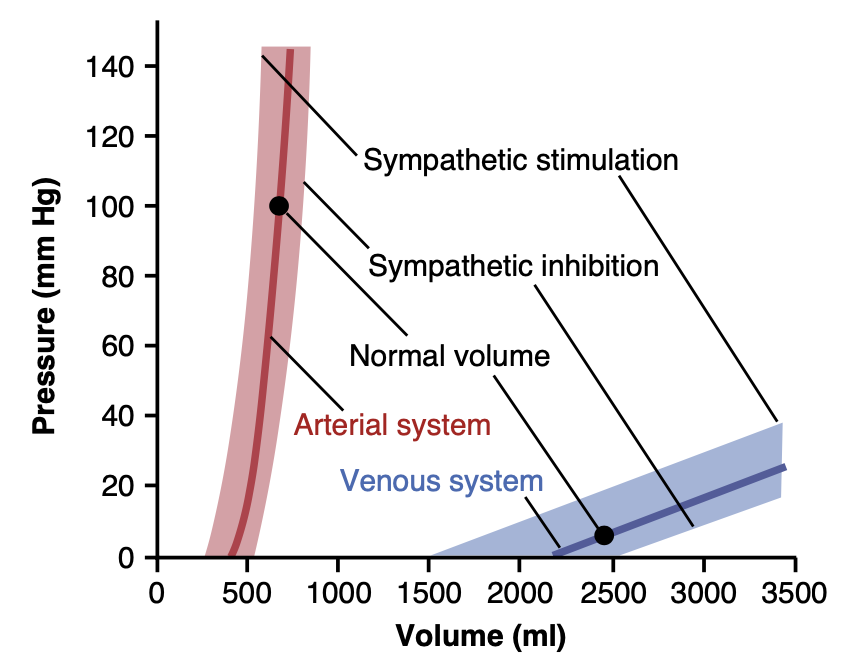
Figure 15-1. Volume-pressure curves of the systemic arterial and ve- nous systems, showing the effects of stimulation or inhibition of the sympathetic nerves to the circulatory system.
交感神経刺激または抑制が動脈および静脈系の体積-圧力関係に与える影響(Effect of Sympathetic Stimulation or Sympathetic Inhibition on the Volume-Pressure Relationships of the Arterial and Venous Systems)
図15-1には、交感神経(sympathetic nerves)が興奮または抑制されたときの体積-圧力曲線への影響も示されています。交感神経刺激による血管平滑筋の緊張(vascular smooth muscle tone)の増加は、動脈や静脈の各体積に対する圧力を上昇させ、交感神経の抑制は各体積に対する圧力を低下させることが明らかです。このように、交感神経による血管の制御(sympathetic control of the vessels)は、循環のある部分の寸法を減少させ、他の部分に血液を移動させるための貴重な手段です。たとえば、全身循環全体の血管緊張が増加すると、大量の血液が心臓に移動し、これは心臓のポンピングを急速に増加させる主な方法の1つです。
交感神経が血管の容量(capacitance)を制御することは、出血(hemorrhage)の際にも非常に重要です。特に静脈への交感神経刺激の強化は、静脈のサイズを縮小させ、血液量の25%が失われた場合でも、循環がほぼ正常に機能することができます。
血管の遅延コンプライアンス(Stress-Relaxation)(Delayed Compliance)
遅延コンプライアンスとは、血管に増加した体積(increased volume)が加わった場合、最初は圧力が大幅に上昇するが、その後、数分から数時間の間に血管壁の平滑筋(smooth muscle)が徐々に伸展し、圧力が正常に戻る現象を指します。この効果は図15-2に示されています。この図では、両端が閉じられた小さな静脈の一部に圧力が記録されています。血液の余分な体積が突然注入され、圧力が5 mmHgから12 mmHgに上昇しますが、血液が取り除かれないにもかかわらず、圧力はすぐに減少し、数分後には約9 mmHgに近づきます。このように、注入された血液の体積は、静脈の弾性的な伸展(elastic distension)を引き起こしますが、その後、静脈の平滑筋繊維が徐々に長く伸び、対応して張力(tension)が減少します。この効果はすべての平滑筋に特有であり、第8章で説明されているようにストレスリラクゼーション(stress-relaxation)と呼ばれます。
遅延コンプライアンスは、必要に応じて追加の血液を循環系に収容するための貴重なメカニズムです。たとえば、大量の輸血後に循環系が調整される場合などです。また、遅延コンプライアンスは、出血(hemorrhage)後に減少した血液量(diminished blood volume)に数分から数時間で自動的に適応する手段の1つです。
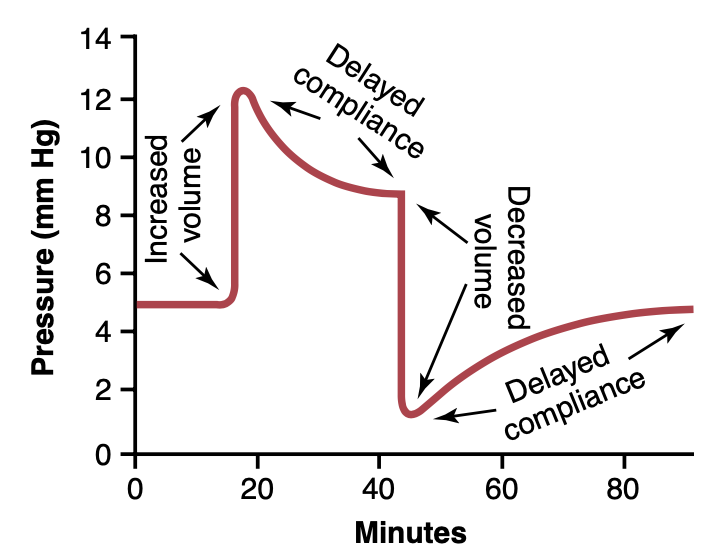
Figure 15-2. Effect on the intravascular pressure of injecting a vol- ume of blood into a venous segment and later removing the excess blood, demonstrating the principle of delayed compliance.
動脈圧の脈動(Arterial Pressure Pulsations)
心臓が1回拍動するごとに、新しい血液の波が動脈を満たします。もし動脈系に伸展性(distensibility)がなければ、この新しい血液は心臓の収縮期(cardiac systole)にのみ、瞬時に末梢血管を通過しなければならず、拡張期(diastole)には血流がなくなってしまいます。しかし、動脈系のコンプライアンス(compliance)は通常、圧力の脈動(pressure pulsations)をほとんどなくしてしまい、血液が毛細血管に到達する頃には脈動はほぼ消失します。したがって、組織への血流は主に連続的(continuous)で、脈動は非常に少なくなります。
図15-3は、大動脈根部(root of the aorta)における圧力の脈動を示しています。健康な若年成人では、各脈動の頂点の圧力は収縮期圧(systolic pressure)と呼ばれ、約120 mmHgです。各脈動の最も低い点の圧力は拡張期圧(diastolic pressure)と呼ばれ、約80 mmHgです。これら2つの圧力の差である約40 mmHgは脈圧(pulse pressure)と呼ばれます。
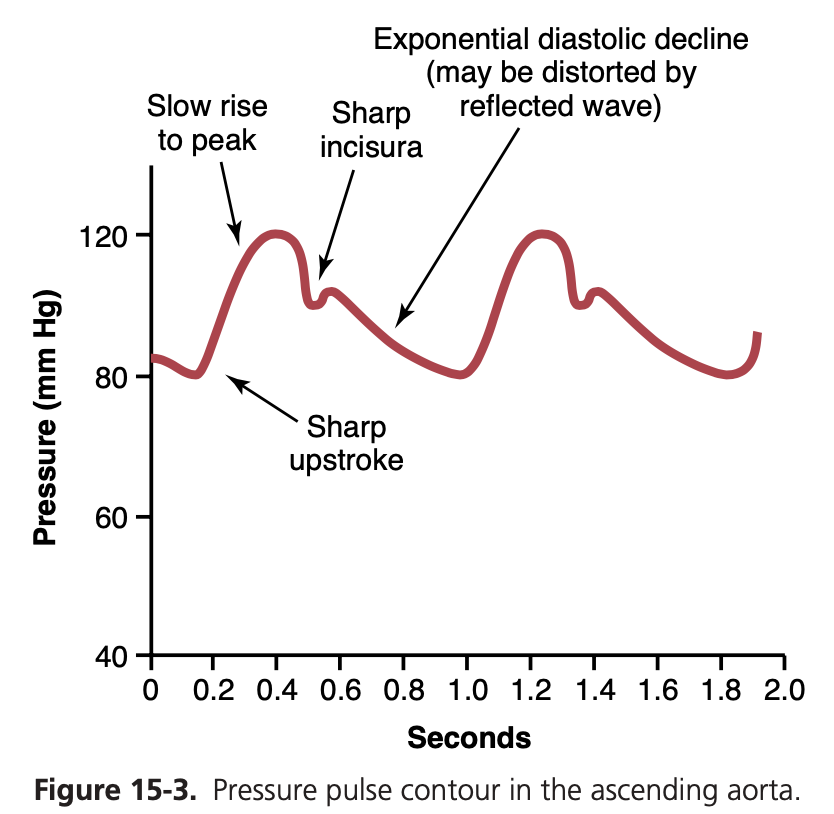
脈圧に影響を与える主要な要因は2つあります:(1)心臓の1回拍出量(stroke volume output of the heart);(2)動脈系のコンプライアンス(総伸展性)。これに加えて、拡張期中の心臓からの排出の特性(character of ejection)も若干の影響を与える要因です。
一般に、心拍出量が大きければ大きいほど、動脈系に1回の心拍ごとに収容される血液の量が増え、したがって、収縮期および拡張期の圧力上昇と低下も大きくなり、結果的に脈圧が増加します。逆に、動脈系のコンプライアンスが低ければ、一定の拍出量に対して圧力の上昇はより大きくなります。例えば、図15-4の中段上部の曲線に示されているように、高齢者では動脈硬化(arteriosclerosis)により動脈が硬くなり、非伸展性(noncompliant)になるため、脈圧は通常の2倍に達することがあります。
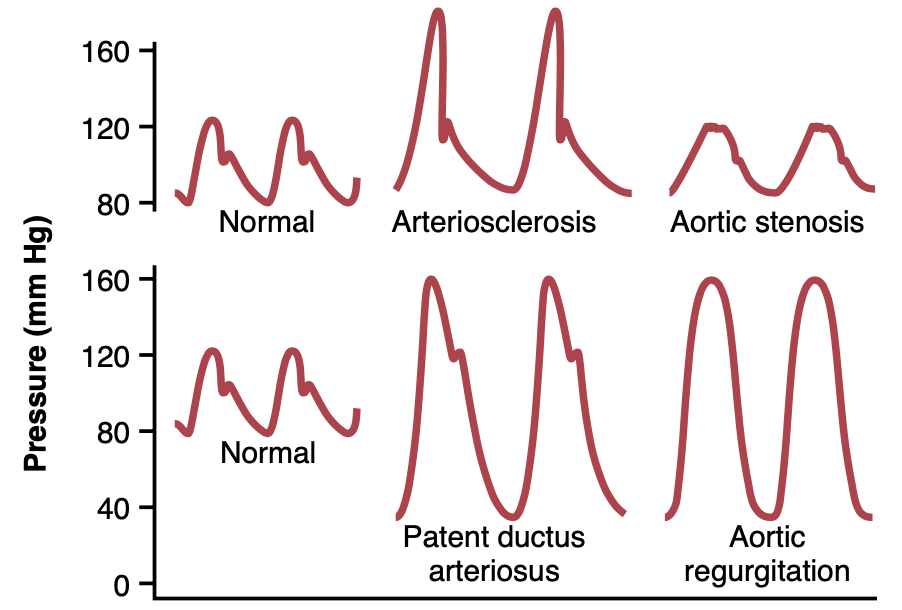
Figure 15-4. Aortic pressure pulse contours in arteriosclerosis, aortic stenosis, patent ductus arteriosus, and aortic regurgitation
事実上、脈圧は拍出量(stroke volume output)と動脈系のコンプライアンスの比によって決まります。循環の状態がこれら2つの要因のいずれかに影響を与えると、脈圧にも影響を与えることになります:
- 脈圧 ≈ 拍出量 / 動脈コンプライアンス
異常な圧力脈波形(Abnormal Pressure Pulse Contours)
一部の病的状態では、脈圧が変化するだけでなく、圧力脈波形(pressure pulse wave)の異常な輪郭が現れます。特に顕著なのは、大動脈弁狭窄症(aortic stenosis)、動脈管開存症(patent ductus arteriosus)、および大動脈逆流症(aortic regurgitation)であり、それぞれが図15-4に示されています。
大動脈弁狭窄症の患者では、大動脈弁の開口部の径が著しく減少しており、狭窄弁(stenotic valve)を通る血流が減少するため、大動脈圧脈波(aortic pressure pulse)は大幅に低下します。
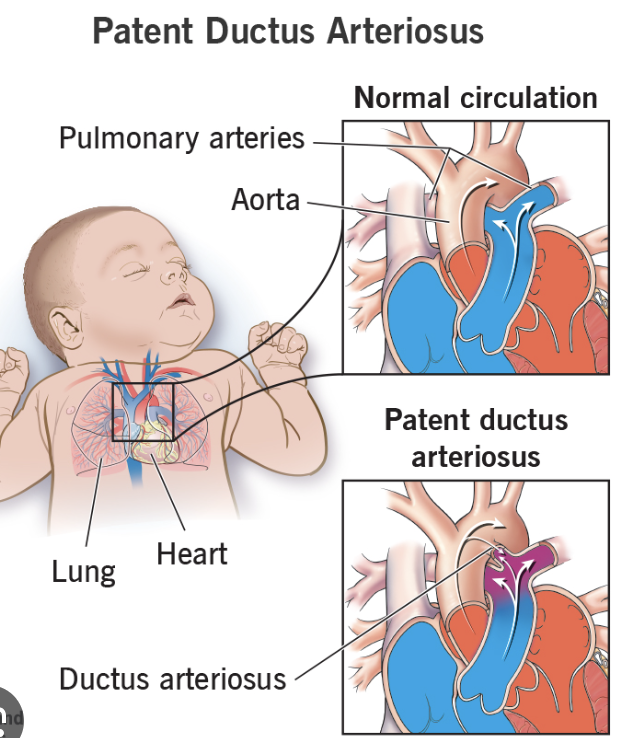
動脈管開存症の患者では、左心室から大動脈にポンプされた血液の50%以上が、すぐに開存した動脈管(ductus arteriosus)を通って肺動脈および肺血管に逆流します。これにより、拡張期圧(diastolic pressure)が次の心拍の前に非常に低下し、脈圧が増加します。
大動脈逆流症の患者では、大動脈弁(aortic valve)が欠如しているか、完全に閉じません。そのため、心拍ごとに大動脈にポンプされた血液がすぐに左心室に逆流します。その結果、大動脈圧は心拍間でゼロまで低下します。また、インシーザ(incisura)は見られません。これは大動脈弁が閉鎖しないためです。
圧力脈波の末梢動脈への伝達(Transmission of Pressure Pulses to the Peripheral Arteries)
心臓が収縮期に血液を大動脈に送り出すと、最初に拡張するのは大動脈の近位部分(proximal portion of the aorta)です。これは、血液の慣性(inertia)により、血液が末梢に向かって急に移動できないためです。しかし、近位大動脈の圧力上昇はすぐにこの慣性を克服し、拡張の波(wavefront of distention)が大動脈をさらに遠くに広がっていきます。この現象は、動脈における圧力脈波の伝達(transmission of the pressure pulse)と呼ばれます。
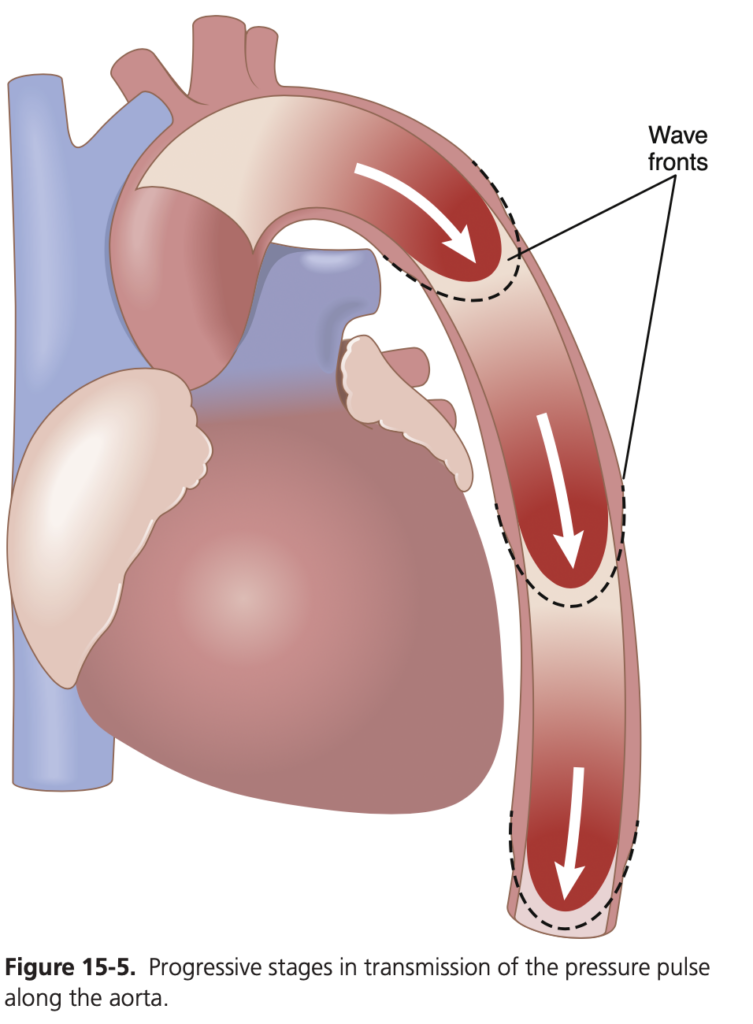
圧力脈波の伝達速度は、通常の大動脈で3~5 m/sec、大動脈の大枝では7~10 m/sec、小動脈では15~35 m/secです。一般的に、各血管セグメントのコンプライアンスが大きいほど、伝達速度は遅くなります。これが、大動脈での伝達が遅く、コンプライアンスの低い小さな末梢動脈での伝達がはるかに速い理由です。大動脈では、圧力脈波の伝達速度は血流速度の15倍以上です。なぜなら、圧力脈波は、血液量の移動を伴わない単なる圧力の波(moving wave of pressure)だからです。
小動脈、細動脈、および毛細血管における圧力脈波の減衰(Pressure Pulses Are Damped in the Smaller Arteries, Arterioles, and Capillaries)
図15-6に示されているように、圧力脈波が末梢血管に進むにつれて、その脈動の強度は次第に減少します。特に、小動脈、細動脈、毛細血管では、脈動の強度が著しく低下します。実際、大動脈の脈動が非常に大きいか、細動脈が大きく拡張している場合にのみ、毛細血管で脈動が観察されます。
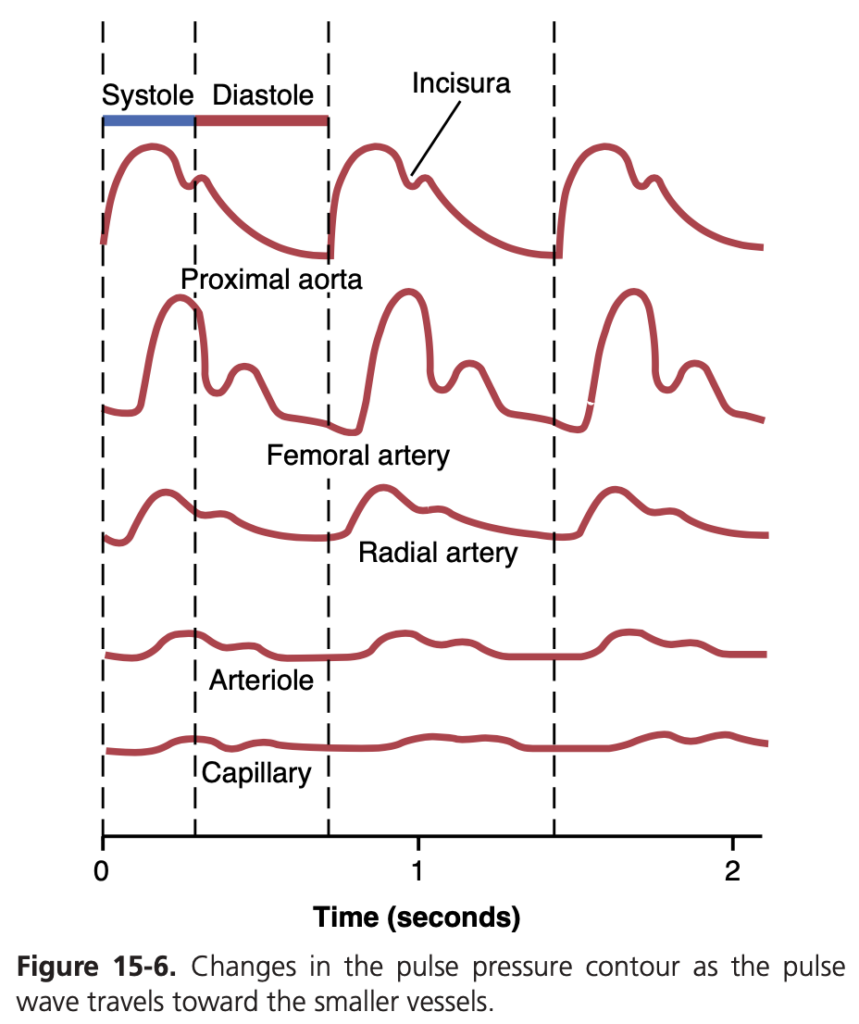
末梢におけるこの脈動の漸進的な減少は、圧力脈波の減衰(damping of the pressure pulses)と呼ばれます。この減衰の原因は2つあります:(1)血管内での血液移動に対する抵抗(resistance);および(2)血管のコンプライアンスです。抵抗は、脈波の前面で次の血管セグメントを拡張するために少量の血液が前方に流れなければならないため、脈動を減衰させます。抵抗が大きいほど、この拡張が困難になります。また、コンプライアンスは、血管が伸展するためには脈波の前面でより多くの血液が必要であるため、脈動を減衰させます。
したがって、減衰の度合いは、抵抗とコンプライアンスの積にほぼ比例します。
収縮期圧および拡張期圧を測定する臨床的な方法(Clinical Methods for Measuring Systolic and Diastolic Pressures)
人間の患者で定期的に動脈圧を測定するために、動脈に針を挿入する必要がある圧力記録装置(pressure recorders)を使用するのは実用的ではありません。ただし、特別な研究が必要な場合にはこれらの装置が使用されます。通常、臨床医は間接的な方法で収縮期圧(systolic pressure)および拡張期圧(diastolic pressure)を測定します。最も一般的な方法は聴診法(auscultatory method)です。
聴診法(Auscultatory Method)
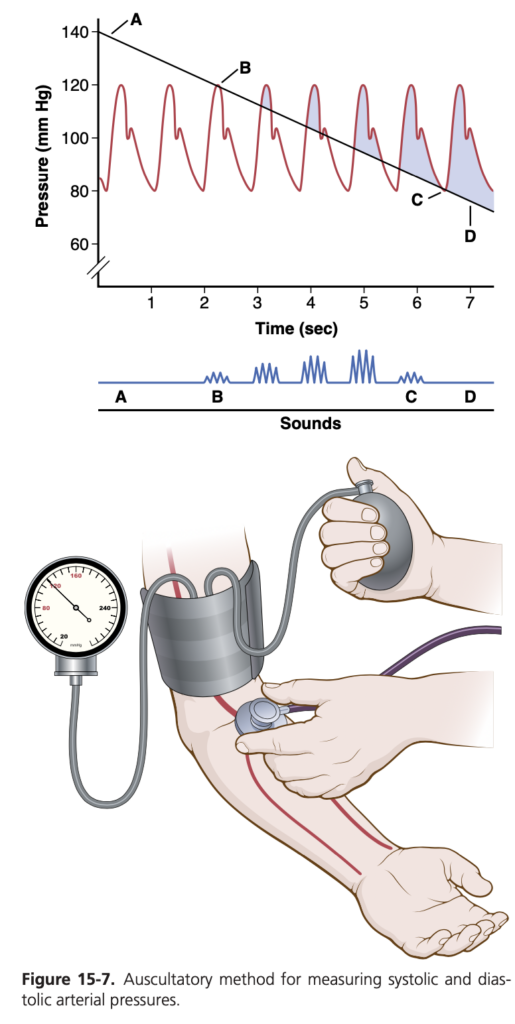
図15-7に示されているように、聴診法では上腕動脈(antecubital artery)に聴診器を当て、腕に血圧計のカフを巻いて測定します。カフが上腕を十分な圧力で圧迫しない限り、聴診器で上腕動脈から音は聞こえません。しかし、カフの圧力が動脈圧力サイクルの一部で動脈を閉鎖するのに十分な場合、脈動(pulsation)ごとに音が聞こえるようになります。この音はコロトコフ音(Korotkoff sounds)と呼ばれ、1905年にロシアの医師ニコライ・コロトコフ(Nikolai Korotkoff)によって記述されました。
コロトコフ音は、主に部分的に閉塞された血管を通る血液のジェット流や血管壁の振動によって引き起こされると考えられています。このジェット流がカフを越えた血管内で乱流を引き起こし、これが聴診器を通じて聞こえる振動を引き起こします。
聴診法で血圧を測定する場合、まずカフの圧力を動脈の収縮期圧より十分に高く上げます。このカフ圧が収縮期圧より高い限り、上腕動脈は閉じたままで、圧力サイクルのどの部分でも下流の動脈に血液が流れ込むことはありません。そのため、下流の動脈ではコロトコフ音は聞こえません。次に、カフの圧力を徐々に下げていきます。カフ圧が収縮期圧(図15-7のBポイント)を下回ると、収縮期のピークでカフの下の動脈を通じて血液が流れ始め、心拍と同期して上腕動脈からタッピング音が聞こえます。この音が聞こえ始めたら、カフに接続された圧力計が示す圧力が収縮期圧とほぼ同じです。
カフの圧力をさらに下げると、コロトコフ音の性質が変わり、タッピング音の性質が少なくなり、リズムのあるより強い音になります。最終的に、カフの圧力が拡張期圧(図15-7のCポイント)に近づくと、音が急に鈍い音に変わります。この音の変化が生じたときの圧力が、拡張期圧とほぼ同じであり、ただし直接動脈内カテーテルで測定した拡張期圧よりわずかに高めに見積もられる傾向があります。カフの圧力がさらに数mmHg低下すると、動脈は拡張期に閉じなくなり、音が消失します。これにより、カフが解放された状態では動脈が閉塞しなくなるため、音の要因である血液のジェット流が発生しなくなるのです。
多くの臨床医は、コロトコフ音が完全に消失した圧力を拡張期圧として使用するべきだと考えています。ただし、カフが完全に解放された後でも音が聞こえる場合など、音の消失が確実に判断できない状況では例外があります。例えば、動静脈瘻(arteriovenous fistula)を持つ透析患者や大動脈不全(aortic insufficiency)の患者では、カフが完全に解放された後でもコロトコフ音が聞こえることがあります。
聴診法による収縮期圧および拡張期圧の測定は完全に正確ではありませんが、通常、直接カテーテル測定で得られた値の10%以内に収まります。
自動オシロメトリ法(Automated Oscillometric Method)
収縮期圧および拡張期圧は、自動オシロメトリ装置(automated oscillometric devices)を使用して測定されることがよくあります。これらの装置は、聴診法と同様にカフを使用しますが、カフの圧力を検出する電子圧力センサーを備えています。このセンサーは、動脈(通常は上腕動脈)を通過する血液の流れに伴って発生するカフ圧の振動を検出します。オシロメトリ装置は特定の電子アルゴリズムを使用してカフを自動的に膨張および収縮させ、カフ圧の振動を解釈します。カフが膨張して圧力が収縮期圧を超えると、動脈内に血液が流れ込まず、カフ圧に振動は生じません。カフが徐々に解放されると、動脈を通じて血液が噴出し始め、カフ圧が動脈の拡張・収縮と同期して振動します。カフ圧が低下すると、振動の振幅が最大になり、これは平均動脈圧(mean arterial pressure)に相当します。その後、振動の振幅はカフ圧が拡張期圧を下回ると減少し、血液が動脈を滑らかに流れるようになります。
オシロメトリ装置は、聴診法に比べて技術的な熟練を必要とせず、患者が自宅で使用できるため、医療従事者の前で測定する際に血圧が上昇する「白衣高血圧(white-coat effect)」を避けることができます。ただし、これらの装置は校正が必要であり、カフのサイズが不適切な場合や、動脈壁の硬化が進んでいる重度の動脈硬化症(severe arteriosclerosis)の患者では信頼できない測定結果を出すことがあります。
聴診法およびオシロメトリ法で測定される通常の動脈圧(Normal Arterial Pressures as Measured by the Auscultatory and Oscillometric Methods)
図15-8は、さまざまな年齢におけるおおよその収縮期圧および拡張期圧を示しています。年齢とともに圧力が徐々に上昇するのは、血圧制御メカニズムに対する加齢の影響によるものです。第19章で説明するように、この長期的な動脈圧の調節(long-term regulation of arterial pressure)は、主に腎臓(kidneys)によって行われ、腎臓は特に50歳以降に明確な変化を示します。
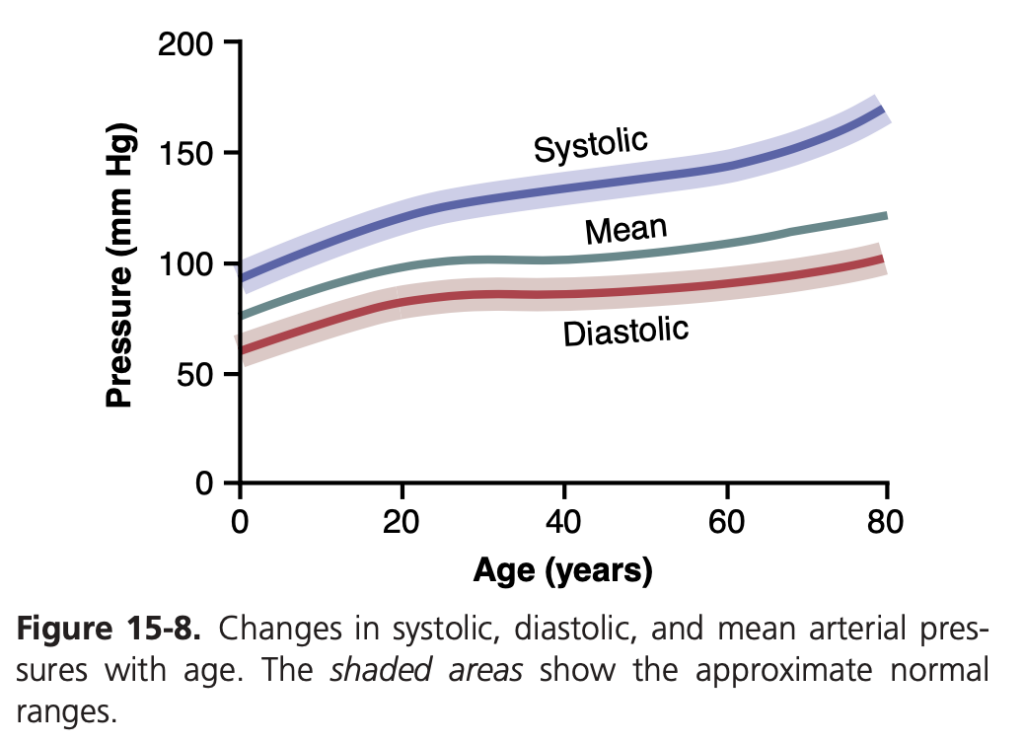
通常、60歳を過ぎると収縮期圧がわずかに上昇します。この上昇は、動脈の伸展性(distensibility)の低下、または動脈硬化に関連する硬化(hardening)によるものです。最終的な影響としては、収縮期圧が高くなり、脈圧の増加が顕著になります。
平均動脈圧(Mean Arterial Pressure)
平均動脈圧(mean arterial pressure)は、ミリ秒単位で一定期間にわたって測定された動脈圧の平均です。収縮期圧と拡張期圧の単純な平均値とは異なります。なぜなら、通常の心拍数では、心拍サイクル(cardiac cycle)の大部分が拡張期に費やされ、収縮期に費やされる時間は少ないからです。したがって、動脈圧は心拍サイクルの大部分で拡張期圧に近い状態を維持します。そのため、平均動脈圧は約60%が拡張期圧、約40%が収縮期圧によって決定されます。図15-8に示されているように、すべての年齢で平均圧は拡張期圧に近く、収縮期圧よりも低くなっています。ただし、心拍数が非常に高い場合、拡張期が心拍サイクルの小さな部分を占めるため、平均動脈圧は収縮期圧と拡張期圧の平均に近づきます。
静脈とその機能(Veins and Their Functions)
静脈(veins)は、血液を心臓へ運ぶ通路を提供しますが、これ以外にも循環系の運用に必要な特殊な機能を果たします。特に重要なのは、静脈が収縮(constricting)および拡張(enlarging)できる能力を持ち、小量または大量の血液を貯蔵し、循環系の他の部分が血液を必要とするときにその血液を利用可能にすることです。また、末梢静脈(peripheral veins)は静脈ポンプ(venous pump)と呼ばれる仕組みで血液を前方へ押し進めることができ、さらには心拍出量(cardiac output)を調節する役割も果たします。これは第20章で詳しく説明される非常に重要な機能です。
静脈圧 ― 右心房圧(中心静脈圧)および末梢静脈圧(Venous Pressures – Right Atrial Pressure (Central Venous Pressure) and Peripheral Venous Pressures)
全身の静脈からの血液はすべて右心房(right atrium)に流れ込みます。したがって、右心房内の圧力は中心静脈圧(central venous pressure:CBP)と呼ばれます。
右心房圧(right atrial pressure)は、次の2つの要因のバランスによって調節されます:
(1)心臓が右心房および右心室から肺(lungs)へ血液を送り出す能力;および
(2)末梢静脈から右心房に血液が流れ込む傾向。
右心が強く血液をポンプするほど、右心房圧は低下します。逆に、心臓が弱くなると右心房圧は上昇します。また、末梢静脈から右心房へ急速に血液が流れ込むような要因があると、右心房圧は上昇します。
右心房圧を上昇させる可能性のある要因としては、次のものがあります:
①血液量の増加(increased blood volume);
②全身の大血管の緊張が増加し、その結果として末梢静脈圧(peripheral venous pressures)が上昇;および
③細動脈の拡張(dilation)、これにより末梢抵抗(peripheral resistance)が低下し、血液が動脈から静脈に急速に流れ込むようになります。
右心房圧を調節するこれらの要因は、心拍出量の調節にも寄与します。なぜなら、心臓がポンプする血液量は、心臓がポンプする能力と末梢血管から心臓へ血液が流れ込む傾向の両方に依存するためです。このため、右心房圧の調節については第20章で心拍出量の調節と関連してさらに詳しく説明します。
通常、右心房圧は約0 mmHgで、これは体の周囲の大気圧(atmospheric pressure)と同じです。しかし、非常に異常な状態では、右心房圧が20〜30 mmHgに上昇することがあります。このような状態には、次のようなケースが含まれます:(1)重度の心不全(heart failure);(2)大量輸血後、血液量が大幅に増加し、末梢血管から心臓に流れ込む血液量が過剰になる場合などです。
右心房圧の下限は通常、大気圧を約-3〜-5 mmHg下回ります。これは、心臓を囲む胸腔内圧(intrathoracic pressure)と同じです。右心房圧がこれらの低い値に近づくのは、心臓が非常に強くポンプしている場合や、末梢血管から心臓への血流が大幅に減少している場合(例えば、重度の出血後など)です。
静脈抵抗および末梢静脈圧(Venous Resistance and Peripheral Venous Pressure)
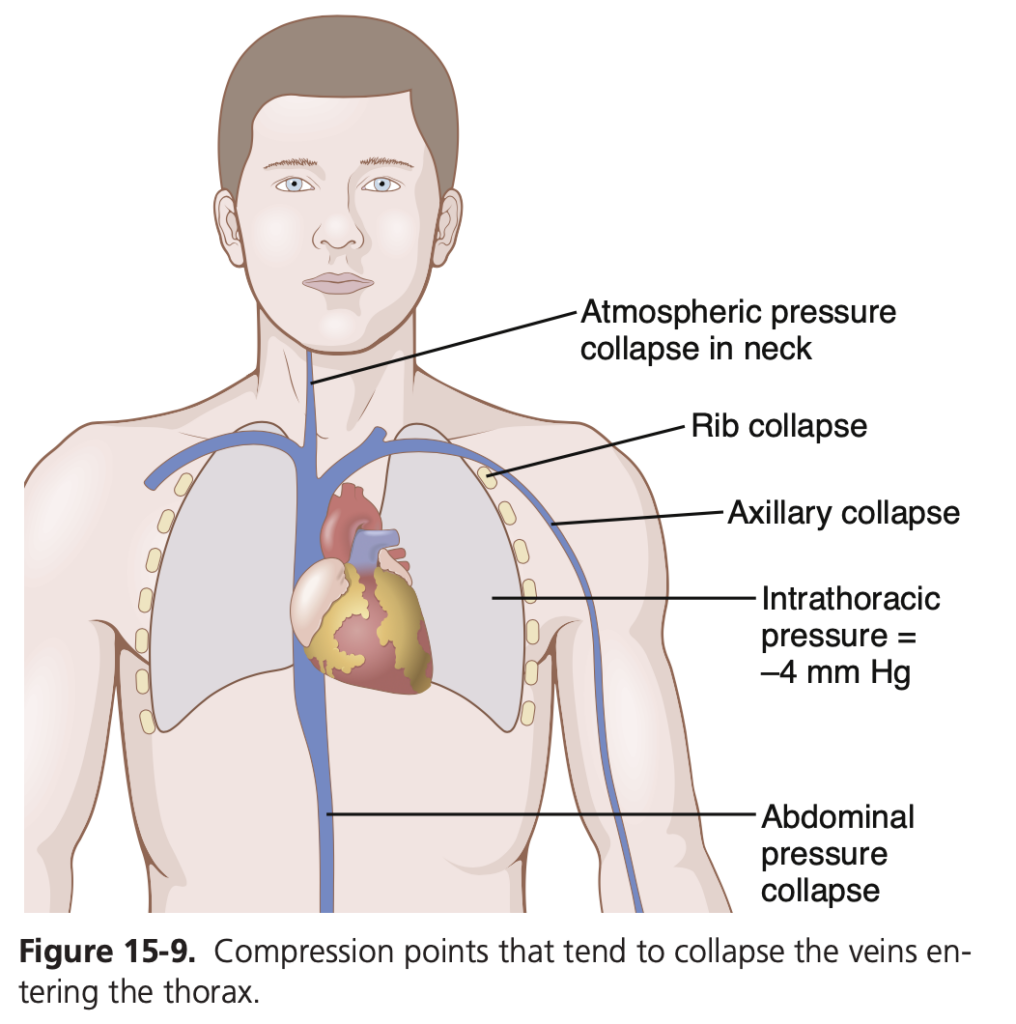
大静脈は拡張しているときには血流に対する抵抗がほとんどないため、抵抗(resistance)はほぼゼロです。しかし、図15-9に示されているように、胸腔に入るほとんどの大静脈は周囲の組織によって多くの点で圧迫されており、それにより血流が妨げられています。たとえば、腕からの静脈は第一肋骨(first rib)を越える際に急角度で曲がって圧迫されます。また、首の静脈の圧力はしばしば非常に低く、首の外側の大気圧によってこれらの静脈が虚脱(collapse)します。さらに、腹腔を通る静脈はしばしば異なる臓器や腹腔内圧(intra-abdominal pressure)によって圧迫されており、通常は少なくとも部分的に卵形または裂け目状に虚脱しています。これらの理由から、大静脈は通常、血流に対してある程度の抵抗を提供しており、横になっている人の末梢の小静脈の圧力は通常、右心房圧より+4〜+6 mmHg高くなっています。
高い右心房圧が末梢静脈圧に与える影響(Effect of High Right Atrial Pressure on Peripheral Venous Pressure)
右心房圧が通常値の0 mmHgを超えると、血液が大静脈に逆流し始めます。この逆流により静脈が拡張し、右心房圧が+4〜+6 mmHgを超えると、静脈の虚脱点(collapse points)も開きます。右心房圧がさらに上昇すると、末梢の四肢や他の場所の末梢静脈圧もそれに伴って上昇します。右心房圧が+4〜+6 mmHgまで上昇するためには心機能が著しく障害されている必要があるため、静止している限りでは心不全の初期段階でも末梢静脈圧が顕著に上昇することはありません。
- High right atrial pressure-> blood begins to back up in the large veins ›enlarges the veins (collapse points in the veins open up)
- As the right atrial pressure rises still further, the additional increase causes a corresponding rise in peripheral venous pressure in the limbs and elsewhere
- EDEMA
腹腔内圧が脚の静脈圧に与える影響(Effect of Intra-abdominal Pressure on Venous Pressures of the Leg)
横になっている人の腹腔内圧(intra-abdominal pressure)は通常、約+6 mmHgですが、妊娠(pregnancy)、大きな腫瘍(large tumors)、腹部肥満(abdominal obesity)、または腹水(ascites)などによって+15〜+30 mmHgまで上昇することがあります。腹腔内圧が上昇すると、脚の静脈の圧力は腹部の静脈が開いて血液が脚から心臓に流れるために、腹腔内圧を上回る必要があります。したがって、腹腔内圧が+20 mmHgの場合、大腿静脈(femoral veins)の最低圧は約+20 mmHgになります。
重力圧が静脈圧に与える影響(Effect of Gravitational Pressure on Venous Pressure)
水の入った容器が空気にさらされていると、水面の圧力は大気圧と等しくなりますが、水面下に13.6ミリメートルごとに圧力が1 mmHg上昇します。この圧力は水の重さによるものであり、重力圧(gravitational pressure)または静水圧(hydrostatic pressure)と呼ばれます。
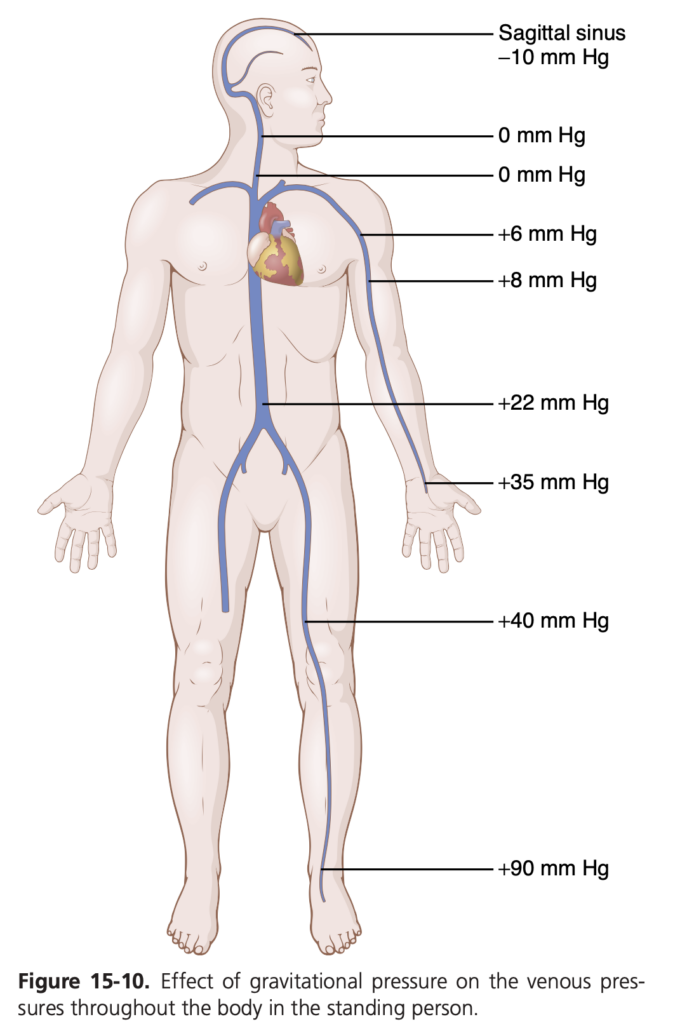
循環系でも同様のことが起こります。図15-10に示されているように、立っている人では、右心房の圧力は約0 mmHgのままです。これは、心臓がこの場所に血液を蓄積しないようにポンプしているためです。しかし、静止して立っている成人では、脚の静脈の圧力は約+90 mmHgであり、これは心臓と足の間の静脈にある血液の重力(gravitational weight)によるものです。他の体の部位の静脈圧も0 mmHgから90 mmHgの範囲で比例して変化します。
静脈弁および静脈ポンプ:静脈圧に対する影響(Venous Valves and the Venous Pump: Their Effects on Venous Pressure)
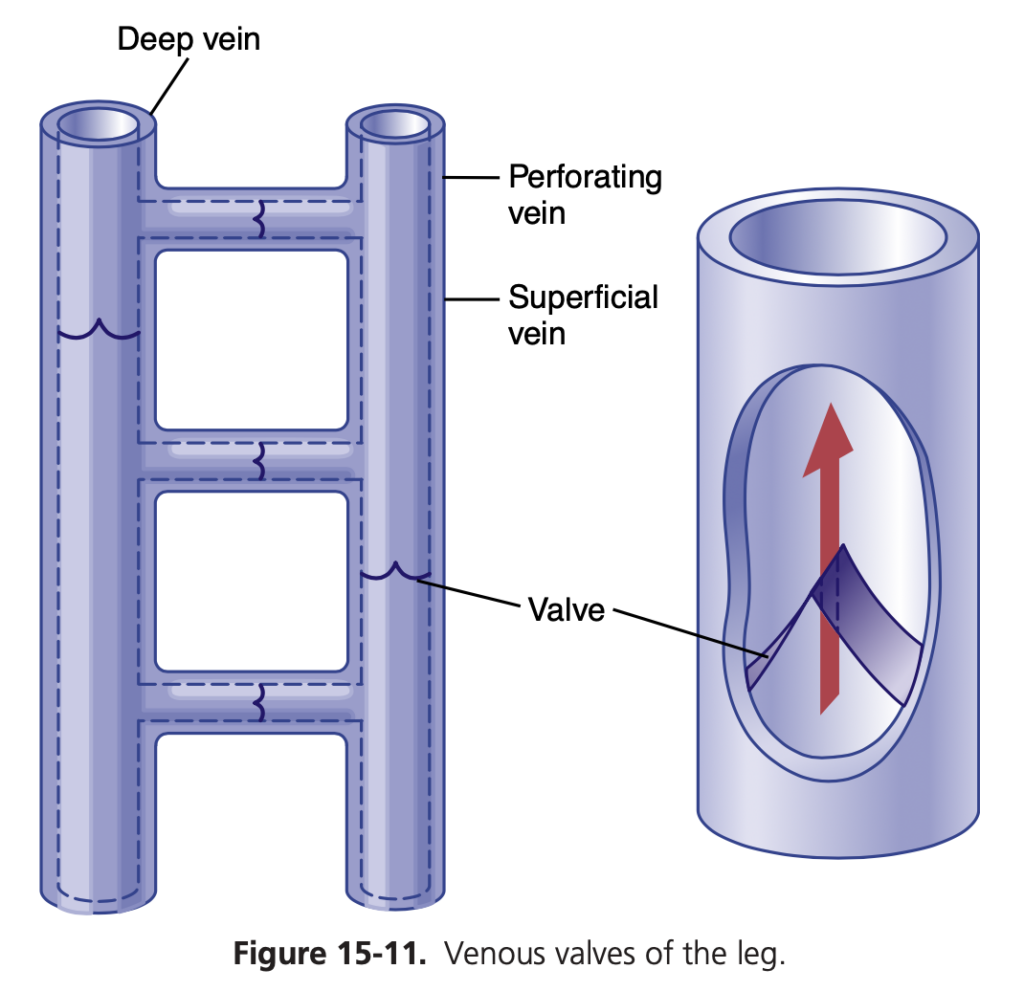
静脈に弁がなければ、立っている成人では、重力圧(gravitational pressure)により、足の静脈圧は常に約+90 mmHgになります。しかし、足を動かすたびに、筋肉が収縮し、筋肉内や筋肉に隣接する静脈が圧迫され、静脈から血液が押し出されます。しかし、図15-11に示されているように、静脈内の弁は血液が心臓へ向かう方向にしか流れないように配置されています。その結果、人が足を動かすたび、あるいは足の筋肉を緊張させるたびに、一定量の静脈血が心臓へ押し進められます。このポンプシステムは「静脈ポンプ(venous pump)」または「筋肉ポンプ(muscle pump)」として知られており、普通の状況下では、歩いている成人の足の静脈圧(venous pressure)は+20 mmHg未満に保たれています。
もし、人が完全に静止して立っていると、静脈ポンプは働かず、約30秒以内に下肢の静脈圧は重力圧の最大値である+90 mmHgまで増加します。このとき、毛細血管圧(capillary pressure)も大幅に上昇し、循環系から組織間隙に液体が漏れ出し、脚が腫れます。また、血液量が減少し、15~30分間の静止状態で10%から20%の血液量が失われることがあります。これが原因で失神することもあり、これは、兵士がじっと立ち続けるときなどに見られることがあります。この状況を避けるためには、定期的に足の筋肉を屈伸させたり、膝を少し曲げたりして、静脈ポンプが機能するようにすることが有効です。
静脈弁の不全が引き起こす静脈瘤(Varicose Veins)
静脈の弁(valves)は、妊娠(pregnancy)や長時間立っていることによる数週間から数ヶ月間の過剰な静脈圧(excess venous pressure)で静脈が過度に拡張すると、不全を起こしたり、破壊されたりすることがあります。静脈が拡張すると、静脈の断面積(cross-sectional area)が増加しますが、静脈弁の弁尖(leaflets)はサイズが大きくなりません。そのため、弁尖は完全には閉じなくなります。弁が完全に閉じないと、静脈ポンプが機能しなくなるため、脚の静脈圧が著しく上昇し、最終的に静脈のサイズがさらに増大し、弁の機能が完全に破壊されます。この状態が静脈瘤(varicose veins)と呼ばれ、特に下肢に見られる皮膚下の大きな球状の静脈(large bulbous protrusions of veins)が特徴です。
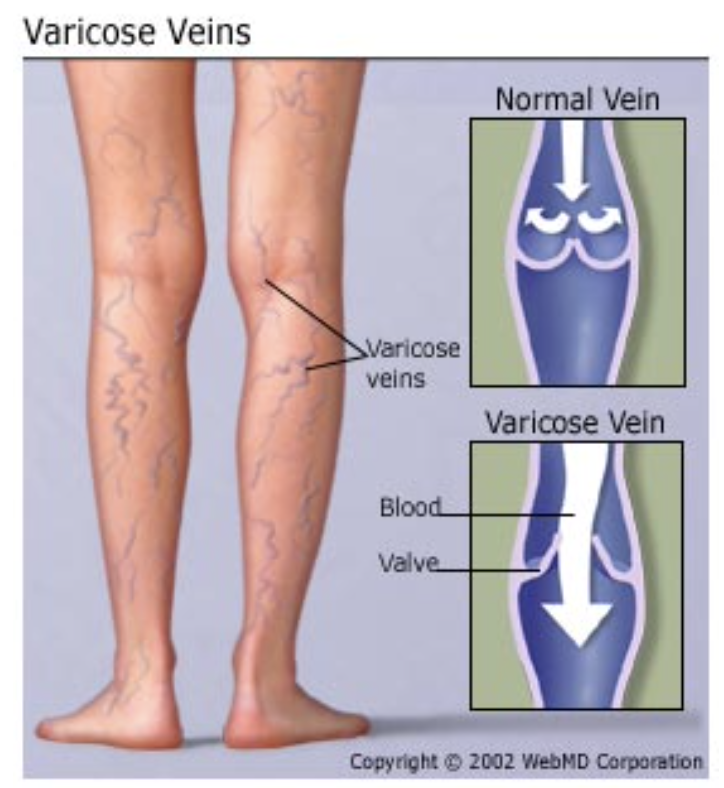
静脈瘤を持つ人が数分以上立っていると、静脈圧および毛細血管圧が非常に高くなり、毛細血管からの液体の漏出により脚に浮腫(edema)が常に生じます。浮腫は、毛細血管から筋肉および皮膚細胞に十分な栄養が行き渡るのを妨げ、筋肉が痛み、弱くなり、皮膚が壊死(gangrene)し、潰瘍化することもあります。このような状態の最良の治療法は、脚を常に心臓より高い位置に挙げることです。さらに、脚に圧迫ストッキング(compression stockings)を使用することで、浮腫およびその結果生じる症状を防ぐのに大いに役立ちます。
静脈圧の臨床的な推定(Clinical Estimation of Venous Pressure)
静脈圧は、特に頸静脈(neck veins)の末梢静脈の拡張の度合いを観察することで、しばしば推定されます。例えば、座っている状態の正常な静止している人では、頸静脈が膨らむことはありません。しかし、右心房圧(right atrial pressure)が+10 mmHgに達すると、下部の頸静脈が膨らみ始め、+15 mmHgに達すると、ほぼすべての頸静脈が拡張します。
静脈圧および右心房圧の直接測定(Direct Measurement of Venous Pressure and Right Atrial Pressure)
静脈圧は、静脈に針を直接挿入し、圧力記録装置に接続することで簡単に測定できます。右心房圧を正確に測定する唯一の手段は、末梢静脈を通じてカテーテルを挿入し、右心房まで到達させることです。これにより測定された圧力は、一部の入院患者で心臓のポンピング能力を継続的に評価するために頻繁に使用されます。
静脈および他の循環圧力を測定するための圧力基準点(Pressure Reference Level for Measuring Venous and Other Circulatory Pressures)
これまでに右心房圧を0 mmHg、動脈圧を100 mmHgとして説明してきましたが、この圧力が循環系内のどの位置を基準にしているのかは明確にしていません。健康な人の体位が変化しても、圧力の測定に対して1~2 mmHg以上の影響を与えない循環系内の1つのポイントがあります。それが図15-12に示されている三尖弁(tricuspid valve)の位置です。したがって、このテキストで説明するすべての循環圧力測定は、この位置を基準にしています。これを圧力測定の基準点(reference level for pressure measurement)と呼びます。
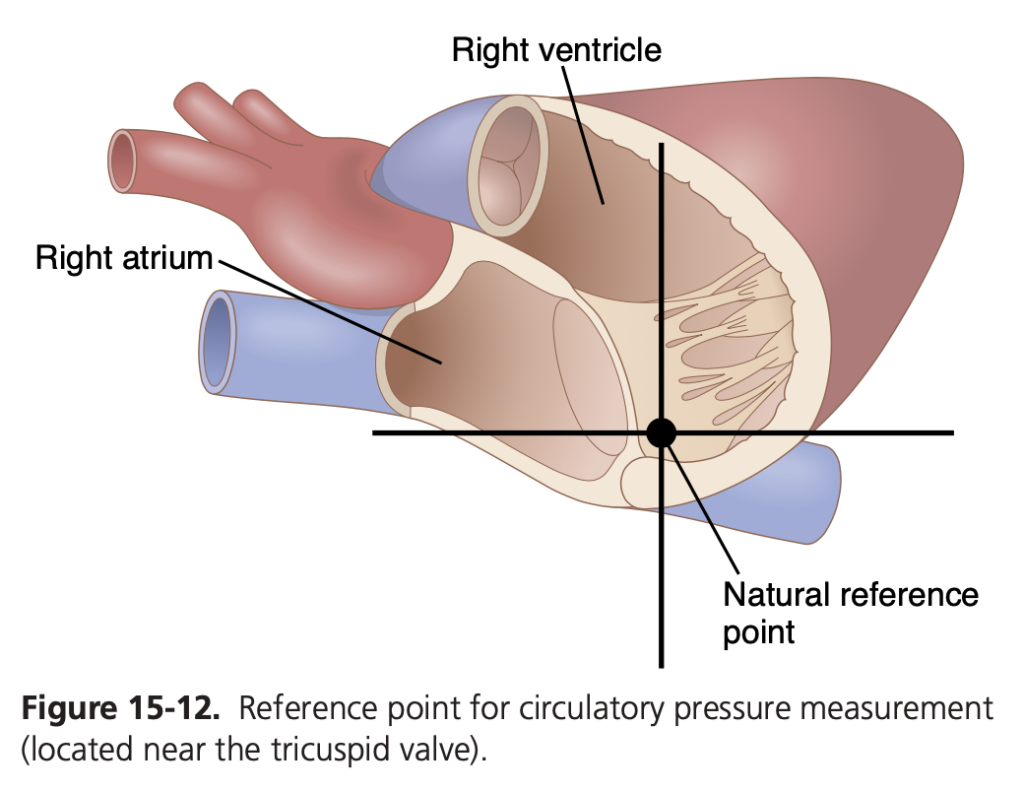
三尖弁で重力による圧力変動がほとんど影響を与えない理由は、心臓がこの場所の圧力を自動的に調整するためです。もし三尖弁の圧力がわずかに上昇した場合、右心室(right ventricle)が通常より多くの血液で満たされ、血液がより速くポンプされるため、三尖弁の圧力が正常な値に戻ります。逆に、圧力が低下すると、右心室が十分に血液で満たされず、ポンピングが減少し、静脈系に血液が蓄積して三尖弁の圧力が再び正常値まで上昇します。言い換えれば、心臓は三尖弁の圧力をフィードバック制御(feedback regulator)する役割を果たしているのです。
人が仰向けになっている場合、三尖弁は胸部の厚さのほぼ60%の位置にあり、これが仰向けの状態でのゼロ圧基準点(zero pressure reference level)になります。
静脈の血液貯蔵機能(Blood Reservoir Function of the Veins)
第14章で説明したように、全循環血液の60%以上は通常、静脈に存在します。さらに、静脈は非常にコンプライアンス(compliant)が高いため、静脈系は循環の血液貯蔵所(blood reservoir)として機能します。
血液が失われ、動脈圧(arterial pressure)が低下し始めると、頸動脈洞(carotid sinuses)やその他の圧受容体(pressure-sensitive areas)からの信号が神経を介して脳や脊髄に伝えられます。これらの信号は、主に交感神経(sympathetic nerves)を介して静脈に伝わり、静脈が収縮(constriction)します。この過程により、失われた血液によって生じた循環系の不足を補います。全血液量の最大20%が失われても、静脈の可変貯蔵機能(variable reservoir function)のおかげで、循環系はほぼ正常に機能し続けることがあります。
Acute blood loss -> BP falls ->1, nervous signals are elicited from the carotid sinuses -> elicit nerve signals from the brain and spinal cord -> through sympathetic stimulation – venous constriction→blood redistributes to the circulatory system
特定の血液貯蔵所(Specific Blood Reservoirs)
循環系の一部には非常に広範囲で、または非常にコンプライアンスの高い部分があり、それらは特定の血液貯蔵所(specific blood reservoirs)と呼ばれています。これには以下のものが含まれます:
- 脾臓(spleen):時には他の部位に最大100 mlの血液を送り出すことができるほど縮小することがあります。
- 肝臓(liver):肝臓の洞様毛細血管(sinuses)は、数百mlの血液を他の循環部位に供給できます。
- 大きな腹部静脈(large abdominal veins):約300 mlの血液を供給することができます。
- 皮膚下の静脈叢(venous plexus beneath the skin):これも数百mlの血液を供給できます。
心臓(heart)と肺(lungs)は、全身の静脈貯蔵系の一部ではありませんが、血液貯蔵所と見なすことができます。たとえば、心臓は交感神経刺激(sympathetic stimulation)によって縮小し、50〜100 mlの血液を供給することができます。肺は、肺圧(pulmonary pressures)が低下したときにさらに100〜200 mlの血液を供給することができます。
脾臓は赤血球の貯蔵庫(The Spleen Is a Reservoir for Red Blood Cells)
図15-13は、脾臓には血液を貯蔵するための2つの別々のエリアがあることを示しています。1つは静脈洞(venous sinuses)、もう1つは脾髄(pulp)です。静脈洞は、他の静脈系と同じように膨張し、全血(whole blood)を貯蔵することができます。
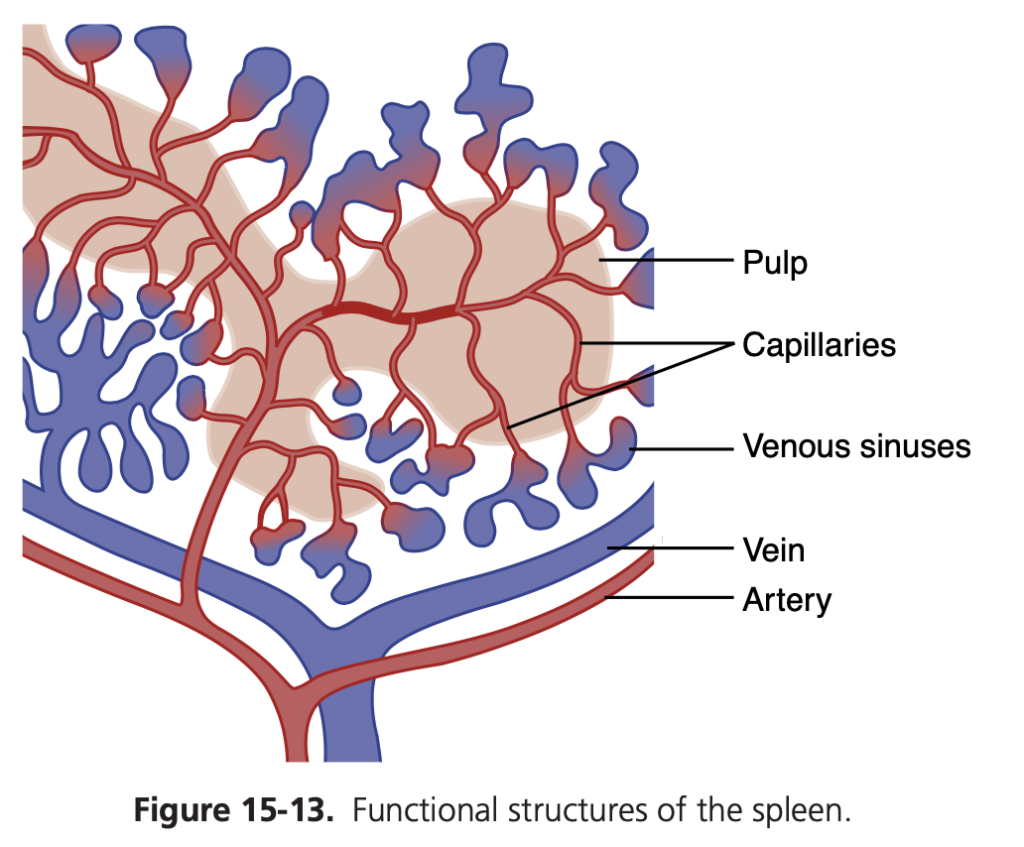
脾髄では、毛細血管が非常に透過性(permeable)であるため、赤血球(red blood cells)を含む全血が毛細血管壁を通って小柱状のメッシュ(trabecular mesh)に浸透します。赤血球は小柱(trabeculae)によって捕らえられ、血漿(plasma)は静脈洞に流れ込み、最終的には全身の循環に入ります。このため、脾髄の赤髄(red pulp)は、大量の濃縮された赤血球を貯蔵する特別な貯蔵庫となります。交感神経系が刺激されると、脾臓やその血管が収縮し、これらの濃縮赤血球(concentrated red blood cells)が全身循環に放出されます。最大で50 mlの濃縮赤血球が放出され、ヘマトクリット(hematocrit)が1〜2%上昇することがあります。
脾髄の他の部分には白血球の島(islands of white blood cells)があり、これらは白髄(white pulp)と呼ばれています。ここではリンパ球(lymphoid cells)が産生され、これはリンパ節で産生されるものに似ています。これらの細胞は、免疫系の一部として機能し、第35章でさらに説明されます。
脾臓の血液浄化機能 ― 古い細胞の除去(Blood-Cleansing Function of the Spleen – Removal of Old Cells)
脾髄を通過して静脈洞に入る前に、血液細胞は脾髄(splenic pulp)の中で完全に圧搾(squeezing)されます。したがって、脆弱な赤血球(fragile red blood cells)がこの圧力に耐えられないことが予想されます。このため、多くの赤血球は脾臓で破壊されます。赤血球が破裂すると、放出されたヘモグロビン(hemoglobin)および細胞ストローマ(cell stroma)は脾臓の網内皮細胞(reticuloendothelial cells)によって消化され、その消化産物は主に栄養素として体内で再利用され、新しい赤血球を作るために使用されることがよくあります。
脾臓の網内皮細胞(Reticuloendothelial Cells of the Spleen)
脾髄には多くの大きな食細胞性網内皮細胞(large phagocytic reticuloendothelial cells)が存在し、静脈洞の内側も同様の細胞で覆われています。これらの細胞は、血液の浄化システムとして機能し、肝臓の静脈洞(venous sinuses)にある類似の網内皮細胞システムと協力して作用します。血液が感染性因子(infectious agents)に侵された場合、脾臓の網内皮細胞は迅速に細胞の破片(debris)、細菌(bacteria)、および寄生虫(parasites)などを除去します。また、多くの慢性感染症では、脾臓がリンパ節と同様に拡大し、その後さらに活発に浄化機能を果たすようになります。


コメント