Contents
- 1 Ch11. Bioenergetics(The Role of ATP)
- 1.1 生物医学的重要性 (Biomedical Importance)
- 1.2 自由エネルギー (Free Energy) はシステム内の有用なエネルギーである
- 1.3 生物学的システムは熱力学の一般法則に従う (Biologic Systems Conform to the General Laws of Thermodynamics)
- 1.4 吸エルゴン反応は発エルゴン反応と結合することで進行する (Endergonic Processes Proceed by Coupling to Exergonic Processes)
- 1.5 高エネルギーリン酸 (High-Energy Phosphates) はエネルギーの捕捉と転送に中心的な役割を果たす
- 1.6 ATPの加水分解における中程度の自由エネルギー変化は、バイオエネルギー的に重要な意味を持つ (The Intermediate Value for the Free Energy of Hydrolysis of ATP Has Important Bioenergetic Significance)
- 1.7 ATPの中間的な位置は、エネルギー転送において重要な役割を果たす (The intermediate position of ATP allows it to play an important role in energy transfer)
- 1.8 ATPは細胞の「エネルギー通貨 (energy currency)」として機能する (ATP Acts as the “Energy Currency” of the Cell)
- 1.9 エネルギー保存またはエネルギー捕捉に関与する主な3つの供給源 (Three Major Sources of ~P Taking Part in Energy Conservation or Energy Capture)
- 1.10 ATPは熱力学的に不利な反応を有利な反応に結合させる (ATP Allows the Coupling of Thermodynamically Unfavorable Reactions to Favorable Ones)
- 1.11 アデニルキナーゼ (Adenylyl Kinase, Myokinase) はアデニンヌクレオチドを相互変換する (Adenylyl Kinase (Myokinase) Interconverts Adenine Nucleotides)
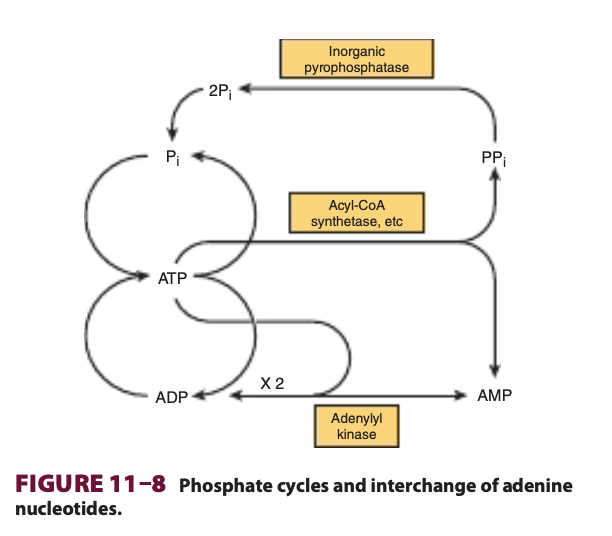
- 1.12 ATPがAMPを形成すると無機ピロリン酸 (PPi) が生成される (When ATP Forms AMP, Inorganic Pyrophosphate (PPi) Is Produced)
- 1.13 他のヌクレオシド三リン酸 (Nucleoside Triphosphates) もグループ転移能に関与する (Other Nucleoside Triphosphates Participate in Group Transfer Potential)
- 1.14 まとめ (SUMMARY)
- 2 Biologic Oxidation(生物学的酸化反応)
Ch11. Bioenergetics(The Role of ATP)
■
熱力学の第1法則と第2法則を述べ、生物学的システムにどのように適用されるか理解する。
自由エネルギー (free energy)、エントロピー (entropy)、エンタルピー (enthalpy)、発エルゴン反応 (exergonic)、吸エルゴン反応 (endergonic) という用語の意味を説明する。
吸エルゴン反応が発エルゴン反応と結合することで生物学的システムでどのように進行するかを理解する。
発エルゴン反応から吸エルゴン反応へ自由エネルギーを移動させるグループ転移能 (group transfer potential)、アデノシン三リン酸 (ATP)、および他のヌクレオチド三リン酸の役割を説明し、それが細胞の「エネルギー通貨 (energy currency)」としてどのように機能するかを理解する。
生物医学的重要性 (Biomedical Importance)
バイオエネルゲティクス、または生化学的熱力学 (biochemical thermodynamics) は、生化学反応に伴うエネルギー変化の研究である。生物学的システムは基本的に等温性 (isothermic) であり、化学エネルギーを利用して生物プロセスを駆動する。動物が食物から適切な燃料を取得してこのエネルギーを供給する方法は、正常な栄養 (nutrition) と代謝 (metabolism) の理解に不可欠である。飢餓による死は、利用可能なエネルギー貯蔵が枯渇したときに発生し、エネルギーの不均衡 (energy imbalance) に関連する特定の形態の栄養失調 (malnutrition) がある(例:マラスムス (marasmus))。甲状腺ホルモン (Thyroid hormones) は代謝率 (metabolic rate)(エネルギー放出速度)を制御し、これが機能しないと疾患が発生する。余分なエネルギーの過剰蓄積は肥満 (obesity) を引き起こし、これは西洋社会でますます一般的な疾患であり、心血管疾患 (cardiovascular disease) や2型糖尿病 (diabetes mellitus type 2) など多くの疾患の要因となり、寿命を短縮する。
自由エネルギー (Free Energy) はシステム内の有用なエネルギーである
ギブズ自由エネルギー変化 (Gibbs change in free energy, ΔG) は、システム内での全エネルギー変化のうち、仕事を行うために利用可能な部分、すなわち有用なエネルギーを示し、化学ポテンシャル (chemical potential) としても知られている。
生物学的システムは熱力学の一般法則に従う (Biologic Systems Conform to the General Laws of Thermodynamics)
熱力学の第1法則 (The first law of thermodynamics) は、システム全体を含む全エネルギーが一定であることを示している。つまり、システムのどの変化においてもエネルギーは失われず、また得られることもないことを意味する。ただし、エネルギーはシステムの一部から別の部分へ移動したり、別のエネルギー形態に変換されたりすることがある。生物システムにおいては、化学エネルギーは熱、電気エネルギー (electrical energy)、放射エネルギー (radiant energy)、または機械エネルギー (mechanical energy) に変換されることがある。
熱力学の第2法則 (The second law of thermodynamics) は、プロセスが自発的に進行するためにはシステムの全エントロピー (entropy) が増加しなければならないことを示している。エントロピーはシステムの無秩序やランダム性の程度を表し、平衡状態に近づくにつれて最大になる。温度と圧力が一定である条件下で、反応系の自由エネルギー変化 (ΔG) とエントロピー変化 (ΔS) の関係は、次の式で表される。この式は熱力学の2つの法則を組み合わせたものである。
∆G = ∆H − T∆S
ここで、ΔHはエンタルピー (enthalpy)(熱)の変化を表し、Tは絶対温度である。
生化学反応において、ΔHは反応の内部エネルギーの全変化 (internal energy change, ΔE) にほぼ等しいため、上記の関係式は次のように表すことができます。
∆G = ∆E − T∆S
もしΔGが負であれば、自由エネルギーを失う形で反応は自発的に進行し、発エルゴン反応 (exergonic reaction) であることを示します。さらに、ΔGの値が大きい場合、反応はほぼ完全に進行し、事実上不可逆となります。一方で、ΔGが正であれば、自由エネルギーを得る必要があり、その反応は吸エルゴン反応 (endergonic reaction) です。もしΔGの値が大きい場合、システムは安定し、反応が起こる傾向はほとんどありません。ΔGが0の場合、システムは平衡にあり、正味の変化は生じません。
反応物が1.0 mol/Lの濃度で存在するとき、ΔG⁰は標準自由エネルギー変化 (standard free energy change) を示します。生化学反応においては、標準状態としてpH 7.0が定義され、この標準状態での自由エネルギー変化はΔG⁰′で表されます。
標準自由エネルギー変化は、平衡定数 Keq から次の式で計算できます。
∆G⁰′ = −RTlnKeq
ここで、Rは気体定数 (gas constant)、Tは絶対温度です(第8章参照)。重要なのは、実際のΔGは反応物の濃度や溶媒、さまざまなイオン、タンパク質などの影響を受けて、ΔG⁰′よりも大きくなったり小さくなったりする可能性があるという点です。
生化学システムにおいて、酵素 (enzyme) は平衡の達成を早めるだけであり、平衡における最終的な反応物の濃度を変えることはありません。
吸エルゴン反応は発エルゴン反応と結合することで進行する (Endergonic Processes Proceed by Coupling to Exergonic Processes)
生体の重要なプロセス、例えば生合成反応 (biosynthetic reactions)、筋収縮 (muscular contraction)、神経インパルスの伝導 (nerve impulse conduction)、および能動輸送 (active transport) は、酸化反応 (oxidative reactions) に化学的に結合することでエネルギーを得ています。最も単純な形では、この種の結合は図11–1に示されているように表されます。代謝物Aから代謝物Bへの変換が自由エネルギーの放出を伴い、代謝物Cを代謝物Dに変換するために必要な自由エネルギーを供給する反応に結合しています。ここでは、発エルゴン (exergonic) と吸エルゴン (endergonic) という用語が、通常の化学的用語「発熱反応 (exothermic)」および「吸熱反応 (endothermic)」の代わりに使用され、プロセスが自由エネルギーを熱としてではなく、任意の形で失うまたは得ることを示しています。
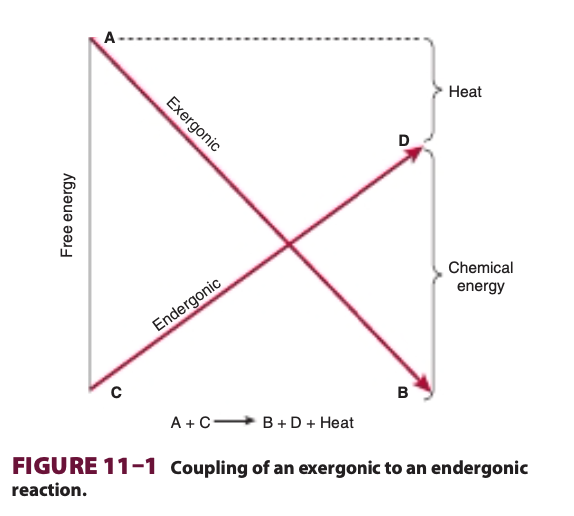
実際、吸エルゴン反応は単独で存在できず、必ず結合された発エルゴン–吸エルゴン系の一部でなければなりません。全体としては、純エネルギーが発エルゴン性 (exergonic) である必要があります。発エルゴン反応は異化反応 (catabolism) と呼ばれ、燃料分子の分解や酸化 (oxidation) を指します。一方で、物質を合成する反応は同化反応 (anabolism) と呼ばれます。異化反応と同化反応を合わせて代謝 (metabolism) と呼びます。
図11–1に示された反応が左から右に進行するためには、全体のプロセスが熱として自由エネルギーの喪失を伴わなければなりません。この結合の1つの可能なメカニズムは、共通の義務的中間体 (obligatory intermediate, I) が両方の反応に関与する場合、すなわち以下のように仮定されることがあります。
A + C → I → B + D
いくつかの生物学的システムでは、発エルゴン反応と吸エルゴン反応がこの方法で結合されています。この種のシステムには、酸化プロセスの速度を生物学的に制御するためのメカニズムが内蔵されています。なぜなら、共通の義務的中間体は合成経路の生成物 (D) の使用速度が質量作用によってAの酸化速度を決定するからです。実際、これらの関係は呼吸制御 (respiratory control) の概念の基盤を提供し、組織が制御を失って燃焼するのを防ぎます。結合の概念の拡張として、脱水素反応 (dehydrogenation reactions) は中間担体を介して水素化反応 (hydrogenations) と結合しています(図11–2参照)。

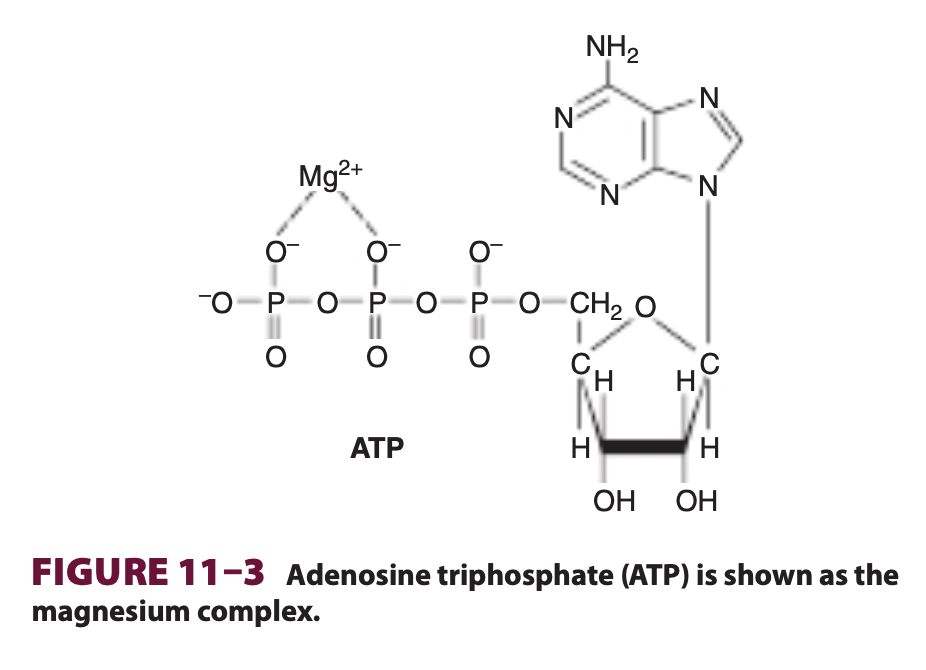
もう1つの発エルゴン反応と吸エルゴン反応を結合させる方法は、発エルゴン反応で高エネルギーのポテンシャルを持つ化合物を合成し、その新しい化合物を吸エルゴン反応に取り込み、発エルゴン経路から吸エルゴン経路に自由エネルギーを移動させることです。このメカニズムの生物学的な利点は、高エネルギーの中間化合物 (~P) が、A、B、C、Dとは構造的に関連している必要がないことです。したがって、ATPは発エルゴン反応から吸エルゴン反応へのエネルギー伝達のトランスデューサー (transducer of energy) として機能し、例えば、生合成、筋収縮、神経興奮、能動輸送などのプロセスに関与します。生きた細胞において、主要な高エネルギー中間体または担体化合物はATPです (図11–3参照)。
高エネルギーリン酸 (High-Energy Phosphates) はエネルギーの捕捉と転送に中心的な役割を果たす
生物が生き続けるためには、すべての生物が環境から自由エネルギーを供給する必要があります。自養生物 (autotrophic organisms) は、例えば光エネルギー(緑色植物)や鉄の酸化 (Fe²⁺ → Fe³⁺, 一部の細菌) など、単純な発エルゴンプロセスを利用します。一方、従属栄養生物 (heterotrophic organisms) は、環境中の複雑な有機分子の分解と代謝を結びつけることで自由エネルギーを得ます。これらの生物のすべてにおいて、ATPは発エルゴン反応から吸エルゴン反応への自由エネルギーの転送において中心的な役割を果たしています。ATPは、ヌクレオシドであるアデノシン(アデニンがリボースに結合したもの)と3つのリン酸基からなるヌクレオチドです (第32章参照)。細胞内での反応においては、Mg²⁺複合体として機能します (図11–3参照)。
リン酸の重要性 (The importance of phosphates) は、ATP (アデノシン三リン酸)、ADP (アデノシン二リン酸)、無機リン酸 (inorganic phosphate, Pi) が解糖系 (glycolysis) において果たす役割の発見とともに明らかになりました(第17章参照)。
ATPの加水分解における中程度の自由エネルギー変化は、バイオエネルギー的に重要な意味を持つ (The Intermediate Value for the Free Energy of Hydrolysis of ATP Has Important Bioenergetic Significance)
表11-1には、生化学的に重要なリン酸化合物の加水分解 (hydrolysis) における標準自由エネルギー変化が示されています。各リン酸基の適切な受容体への転移の傾向は、37°Cでの加水分解のΔG0′から推定できます。これをグループ転移能 (group transfer potential) と呼びます。ATPの末端リン酸基の加水分解(ATPがADP + Piに変換されるとき)の値は、表に示された化合物を2つのグループに分けます。低エネルギーリン酸 (low-energy phosphates) は低いグループ転移能を持ち、解糖系の中間体に見られるエステルリン酸 (ester phosphates) がその例です。これらの化合物は、ATPのΔG0′よりも小さいG0′を持ちます。一方、ATPよりもΔG0′がより負の値を示す高エネルギーリン酸 (high-energy phosphates) は、通常、無水物 (anhydrides)(例:1,3-ビスホスホグリセリン酸の1リン酸)、エノールリン酸 (enol phosphates)(例:ホスホエノールピルビン酸)、およびホスホグアニジン (phosphoguanidines)(例:クレアチンリン酸、アルギニンリン酸)などです。
| 化合物 (Compound) | ΔG⁰ (kJ/mol) | ΔG⁰ (kcal/mol) |
|---|---|---|
| ホスホエノールピルビン酸 (Phosphoenolpyruvate) | −61.9 | −14.8 |
| カルバモイルリン酸 (Carbamoyl phosphate) | −51.4 | −12.3 |
| 1,3-ビスホスホグリセリン酸 (1,3-Bisphosphoglycerate)(3-ホスホグリセリン酸への変換)(to 3-phosphoglycerate) | −49.3 | −11.8 |
| クレアチンリン酸 (Creatine phosphate) | −43.1 | −10.3 |
| ATP → AMP + PP₁ | −32.2 | −7.7 |
| ATP → ADP + P₁ | −30.5 | −7.3 |
| グルコース-1-リン酸 (Glucose-1-phosphate) | −20.9 | −5.0 |
| PP₁ (ピロリン酸, pyrophosphate) | −19.2 | −4.6 |
| フルクトース-6-リン酸 (Fructose-6-phosphate) | −15.9 | −3.8 |
| グルコース-6-リン酸 (Glucose-6-phosphate) | −13.8 | −3.3 |
| グリセロール-3-リン酸 (Glycerol-3-phosphate) | −9.2 | −2.2 |
表の解説
- 自由エネルギー変化(ΔG⁰)の意義:
- 自由エネルギーは、化学反応が自発的に進行するかどうかを判断する指標です。ΔG⁰が負の値を示す場合、反応は自発的に進行できることを意味します。
- ΔG⁰が大きく負であるほど、その反応は自発的に進行しやすいとされ、逆にΔG⁰が正の場合はエネルギーを必要とするため、自発的には進行しません。
- 重要な化合物の役割:
- ホスホエノールピルビン酸(PEP)やカルバモイルリン酸、1,3-ビスホスホグリセリン酸などは、エネルギー代謝の過程で重要な役割を果たす高エネルギー化合物です。これらの化合物は、ATPの合成や分解に関与し、エネルギーの転送や保存に寄与します。
- ATP自体は細胞の「エネルギー通貨」として知られ、ADPやAMPに変換される際にもエネルギーを放出します。この放出エネルギーは細胞のさまざまな活動に使われます。
- 生化学的反応における適用:
- 表に示された化合物は、細胞内でのさまざまな代謝経路(例えば、解糖系やクエン酸回路)において重要な中間体です。これらの反応のエネルギー変化を理解することで、細胞がどのようにエネルギーを取得し、使用しているのかを把握できます。
記号「~P」は、結合に付随するグループが適切な受容体に転移する際に、大量の自由エネルギーを移動させることを示しています。このため、ATPは高いグループ転移能を持っていますが、アデノシン一リン酸 (AMP) のリン酸基は低エネルギー型であり、通常のエステル結合となっています (図11-4参照)。エネルギー転移反応において、ATPはADPおよびPiに変換されるか、さらに多くのエネルギーを必要とする反応ではAMP + PPiに変換されます (表11-1参照)。
ATPの中間的な位置は、エネルギー転送において重要な役割を果たす (The intermediate position of ATP allows it to play an important role in energy transfer)
ATPの加水分解に伴う高い自由エネルギー変化は、末端リン酸を分子に結合させているP-O結合の切断自体によって引き起こされるわけではありません(図11-4参照)。実際、これを引き起こすためにはエネルギーが必要です。この結合の切断がもたらす結果こそが、正味のエネルギー放出の原因です。第一に、ATPの隣接するリン酸基にある負に帯電した酸素原子の間には強い静電反発 (electrostatic repulsion) があり、これが分子を不安定にし、一つのリン酸基を取り除くことがエネルギー的に有利になります。第二に、生成されたオルトリン酸 (orthophosphate) は共鳴ハイブリッド (resonance hybrids) を形成することで大いに安定化され、その結果、4つの酸素原子に3つの負電荷が分散されます。したがって、加水分解後の生成物であるADPとオルトリン酸はATPよりも安定しており、エネルギー的に低い状態になります (図11-5参照)。他の「高エネルギー化合物 (high-energy compounds)」には、補酵素A (coenzyme A) を含むチオールエステル (thiol esters)(例:アセチルCoA (acetyl-CoA))、アシルキャリアータンパク質 (acyl carrier protein)、タンパク質合成に関与するアミノ酸エステル (amino acid esters)、S-アデノシルメチオニン (S-adenosylmethionine)(活性メチオニン)、ウリジン二リン酸グルコース (UDPGlc)、および5-ホスホリボシル-1-ピロリン酸 (5-phosphoribosyl-1-pyrophosphate, PRPP) があります。
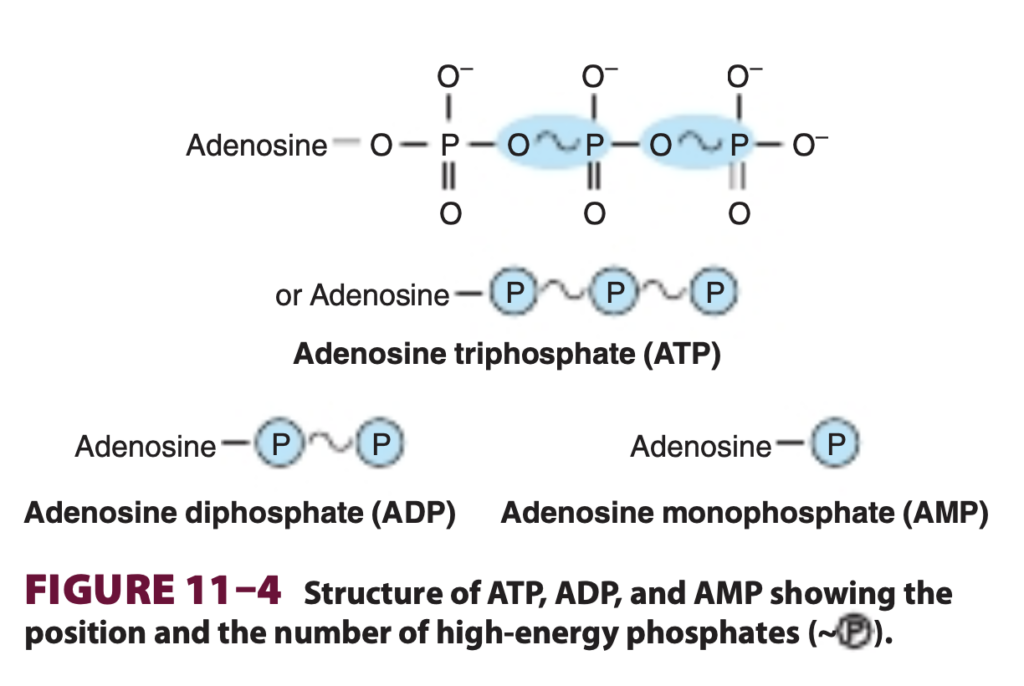
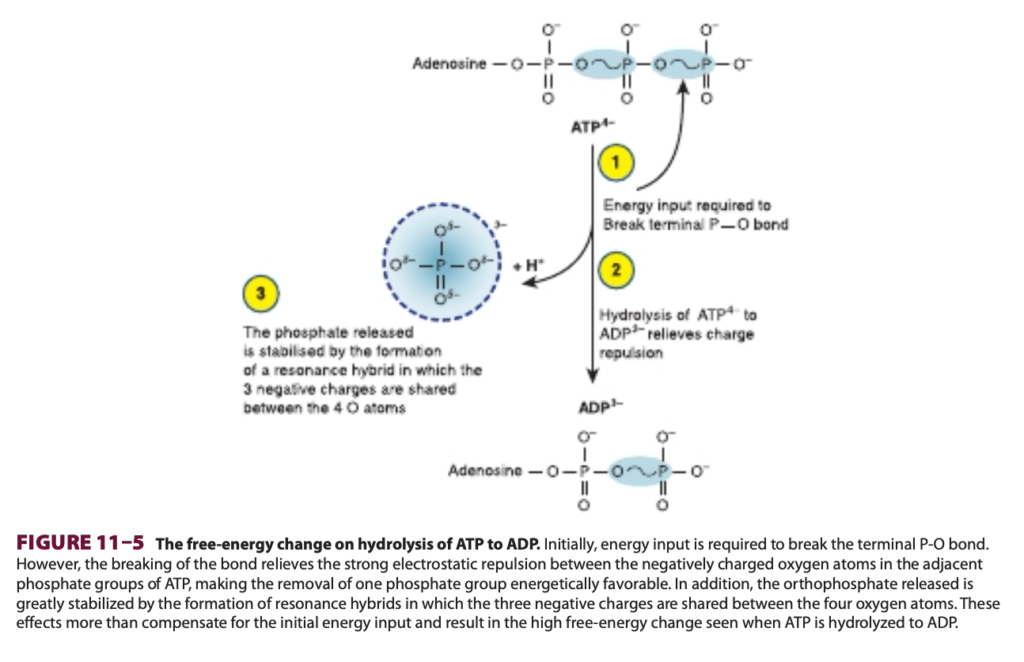
ATPは細胞の「エネルギー通貨 (energy currency)」として機能する (ATP Acts as the “Energy Currency” of the Cell)
ATPの高いグループ転移能は、それが高エネルギーリン酸の供与体として機能し、表11-1のそれよりも低いエネルギーを持つ化合物を形成できることを可能にします。同様に、必要な酵素があれば、ADPは表のATPよりも高いエネルギーを持つ化合物からリン酸基を受け取り、ATPを形成できます。実際、ATP/ADPサイクルは、Pを生成するプロセスとPを利用するプロセスを結び付け、ATPを絶え間なく消費し再生成します。これは非常に速い速度で行われ、ATP/ADPプール全体が非常に小さく、活発な組織を維持するために数秒しか持たないためです。
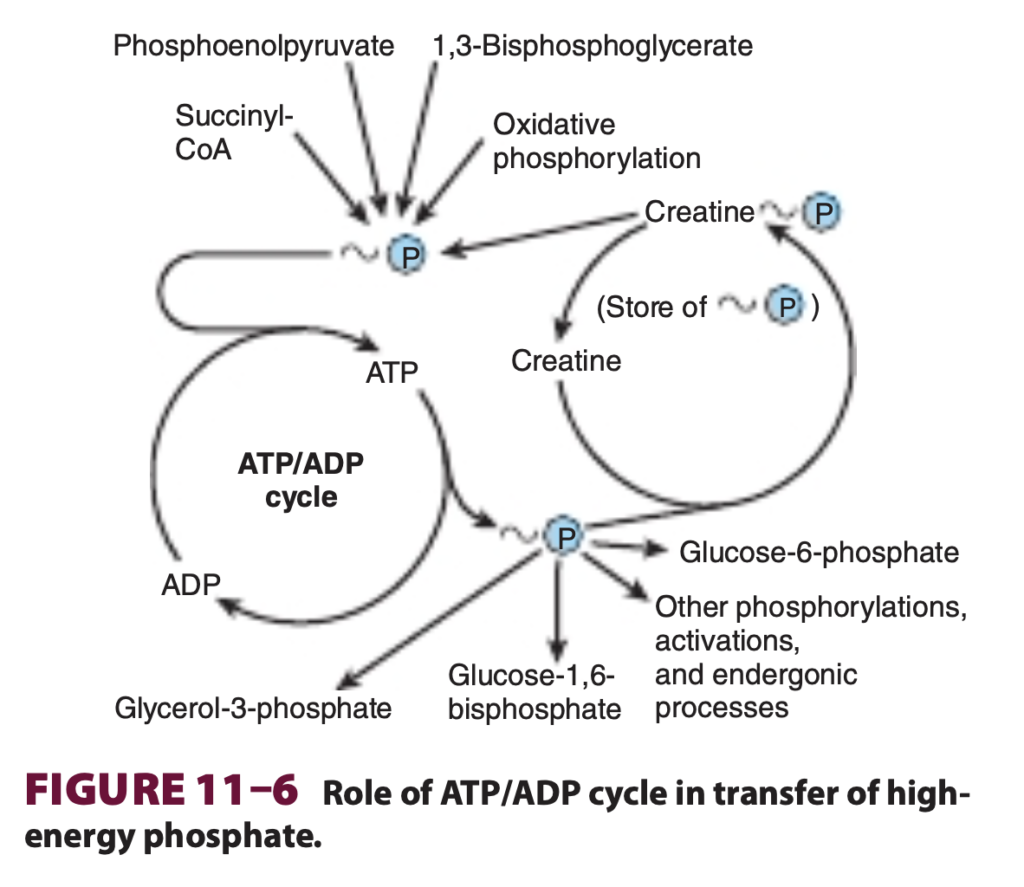
エネルギー保存またはエネルギー捕捉に関与する主な3つの供給源 (Three Major Sources of ~P Taking Part in Energy Conservation or Energy Capture)
- 酸化的リン酸化 (Oxidative phosphorylation) は、好気性生物において最も定量的に重要な~Pの供給源です。ATPは、呼吸鎖を通して電子が移動し、O₂がH₂Oに還元される過程でミトコンドリアマトリックス内で生成されます(第13章参照)。
- 解糖系 (Glycolysis)。1分子のグルコースから乳酸を生成する過程では、2つの~Pが生成され、ホスホグリセリン酸キナーゼ (phosphoglycerate kinase) とピルビン酸キナーゼ (pyruvate kinase) によってそれぞれ触媒されます(第17章参照)。
- クエン酸回路 (Citric acid cycle)。この回路では、スクシニルCoAキナーゼ (succinate thiokinase) の段階で1つの~Pが直接生成されます (図16-3参照)。
ホスファゲン (Phosphagens) はグループ転移能の貯蔵形態として機能し、クレアチンリン酸 (creatine phosphate) は脊椎動物の骨格筋、心臓、精子、脳に存在し、アルギニンリン酸 (arginine phosphate) は無脊椎動物の筋肉に存在します。ATPが筋収縮 (muscular contraction) のために迅速に使用されているとき、ホスファゲンはATP濃度を維持するのを助けますが、ATP/ADP比が高いときには、その濃度が上昇し、エネルギー貯蔵として機能します (図11-7参照)。
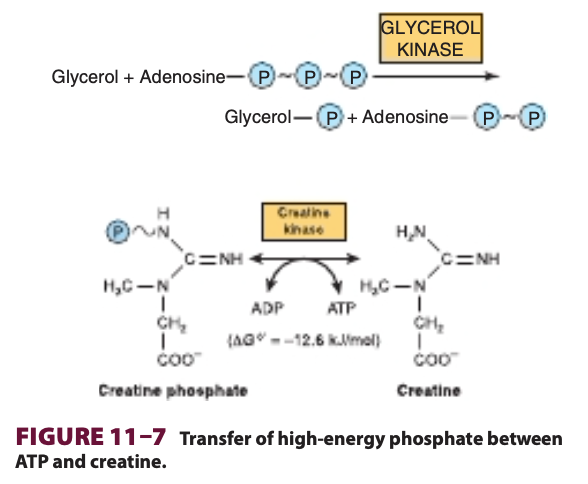
ATPがより低い自由エネルギーの加水分解を持つ化合物を形成するためのリン酸供与体として機能する際、リン酸基は常に低エネルギー型に変換されます。例えば、グリセロールがリン酸化されてグリセロール-3-リン酸 (glycerol-3-phosphate) を形成する反応です。
ATPは熱力学的に不利な反応を有利な反応に結合させる (ATP Allows the Coupling of Thermodynamically Unfavorable Reactions to Favorable Ones)
吸エルゴン反応は自由エネルギーの投入なしには進行できません。例えば、解糖系 (glycolysis) の最初の反応であるグルコースのリン酸化 (phosphorylation of glucose) は、次の反応です(図17-2参照)。
グルコース + Pi → グルコース-6-リン酸 + H₂O
(ΔG0′ = +13.8 kJ/mol) (1)
これは高度に吸エルゴンであり、生理学的条件下では進行できません。この反応が起こるためには、より発エルゴンな反応、例えばATPの末端リン酸基の加水分解と結合しなければなりません。
ATP → ADP + Pi (ΔG0′ = −30.5 kJ/mol) (2)
(1)と(2)がヘキソキナーゼ (hexokinase) によって触媒される反応で結合すると、グルコースのリン酸化は生理学的条件下で容易に進行し、非常に発エルゴン反応となり、不可逆的な反応となります。多くの「活性化 (activation)」反応はこのパターンに従います。
アデニルキナーゼ (Adenylyl Kinase, Myokinase) はアデニンヌクレオチドを相互変換する (Adenylyl Kinase (Myokinase) Interconverts Adenine Nucleotides)
この酵素はほとんどの細胞に存在し、次の反応を触媒します。
2ADP ↔ ATP + AMP
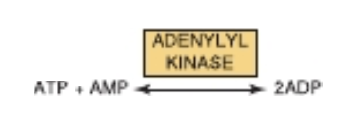
アデニルキナーゼは、細胞内のエネルギー恒常性 (energy homeostasis) の維持に重要です。なぜなら、次のことを可能にするからです。
- ADPに含まれるグループ転移能 (group transfer potential) を利用してATPを合成する。
- ATPを使用する活性化反応に伴って生成されたAMPがADPに再リン酸化される。
- ATPが枯渇した際、AMP濃度が増加し、代謝のアロステリックシグナル (allosteric signal) として働き、ATPの生成を促進する異化反応の速度を増加させる (第14章参照)。
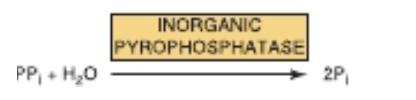
ATPがAMPを形成すると無機ピロリン酸 (PPi) が生成される (When ATP Forms AMP, Inorganic Pyrophosphate (PPi) Is Produced)
ATPは、AMPとPPiを放出しながら直接加水分解されることもあります(表11-1参照)。例えば、長鎖脂肪酸の活性化 (activation of long-chain fatty acids) でこの反応が発生します(図22-3参照)。この反応は熱として自由エネルギーが失われる形で進行し、このことにより活性化反応が進行方向に進みやすくなります。また、無機ピロリン酸分解酵素 (inorganic pyrophosphatase) によって触媒されるPPiの加水分解反応が加わることで、この反応がさらに促進されます。この反応自体も大きなΔG0′(−19.2 kJ/mol)を持っています。なお、この活性化反応を通じてリン酸の再利用とアデニンヌクレオチドの相互変換が可能になります (図11-8参照)。
他のヌクレオシド三リン酸 (Nucleoside Triphosphates) もグループ転移能に関与する (Other Nucleoside Triphosphates Participate in Group Transfer Potential)
ヌクレオシド二リン酸キナーゼ (NDP kinases) を介して、UTP、GTP、およびCTPはそれぞれの二リン酸 (diphosphates) から合成されます。例えば、UDPはATPと反応してUTPを形成します。
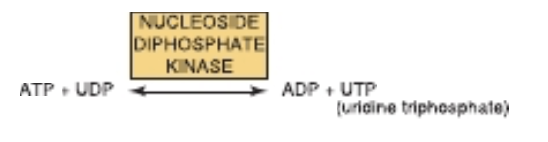
これらの三リン酸はすべて、細胞内のリン酸化反応に関与します。同様に、特定のヌクレオシド一リン酸キナーゼ (NMP kinases) が対応する一リン酸 (monophosphates) から二リン酸を合成します。このため、アデニルキナーゼは特殊なNMPキナーゼとも言えます。
まとめ (SUMMARY)
- 生物学的システム (Biologic systems) は、化学エネルギーを利用して生命活動を駆動します。
- 発エルゴン反応 (Exergonic reactions) は自由エネルギーの損失を伴い自発的に進行します(ΔGは負の値)。吸エルゴン反応 (Endergonic reactions) は自由エネルギーの獲得を必要とし、発エルゴン反応に結合しない限り進行しません(ΔGは正の値)。
- ATPは細胞の「エネルギー通貨 (energy currency)」として機能し、高エネルギー化合物から低エネルギー化合物へ自由エネルギーを移動させます。
Biologic Oxidation(生物学的酸化反応)
目的
この章を学んだ後、次のことができるようになります:
- 酸化還元電位(redox potential)の意味を説明し、それが生物学的システムにおける電子の流れの方向を予測するのにどのように役立つかを理解する。
- 酸化還元反応に関わる4種類の酵素(oxidoreductases)のクラスを特定する。
- オキシダーゼ(oxidases)の作用を説明し、代謝においてどこで重要な役割を果たしているかの例を挙げる。
- デヒドロゲナーゼ(dehydrogenases)の2つの主な機能を示し、ニコチンアミドアデニンジヌクレオチド(NAD)やリボフラビン(riboflavin)に関連するデヒドロゲナーゼが解糖系(glycolysis)、クエン酸回路(citric acid cycle)、および呼吸鎖(respiratory chain)などの代謝経路で果たす重要性を説明する。
- ハイドロペルオキシダーゼ(hydroperoxidases)に分類される2種類の酵素を特定し、それらが触媒する反応を示し、それらの重要性を説明する。
- オキシゲナーゼ(oxygenases)が触媒する2段階の反応を説明し、この酵素クラスの2つのサブグループを特定する。
- シトクロムP450(cytochrome P450)の役割について、薬物の解毒(detoxification)やステロイド合成(steroid synthesis)における重要性を理解する。
- スーパーオキシドディスムターゼ(superoxide dismutase)が触媒する反応を説明し、それが組織を酸素毒性からどのように保護するかを理解する。
酸化還元電位 (Redox Potential)
酸化還元電位とは、化合物が電子を受け取る(還元される)または電子を放出する(酸化される)能力を示す指標であり、電気的なポテンシャルで表されます。酸化還元電位が高いほど電子を受け取る傾向が強く、逆に低いと電子を放出する傾向があります。生物学的システムにおいて、電子は酸化還元電位の低い化合物から高い化合物へ流れるため、酸化還元電位を知ることで、電子の流れの方向を予測することができます。この情報は、呼吸鎖や酸化還元反応において重要な役割を果たします。
酸化還元反応に関わる酵素のクラス(Oxidoreductases)
酸化還元酵素には以下の4種類のクラスがあります:
- オキシダーゼ (Oxidases)
- デヒドロゲナーゼ (Dehydrogenases)
- ハイドロペルオキシダーゼ (Hydroperoxidases)
- オキシゲナーゼ (Oxygenases)
オキシダーゼ (Oxidases) の作用と役割
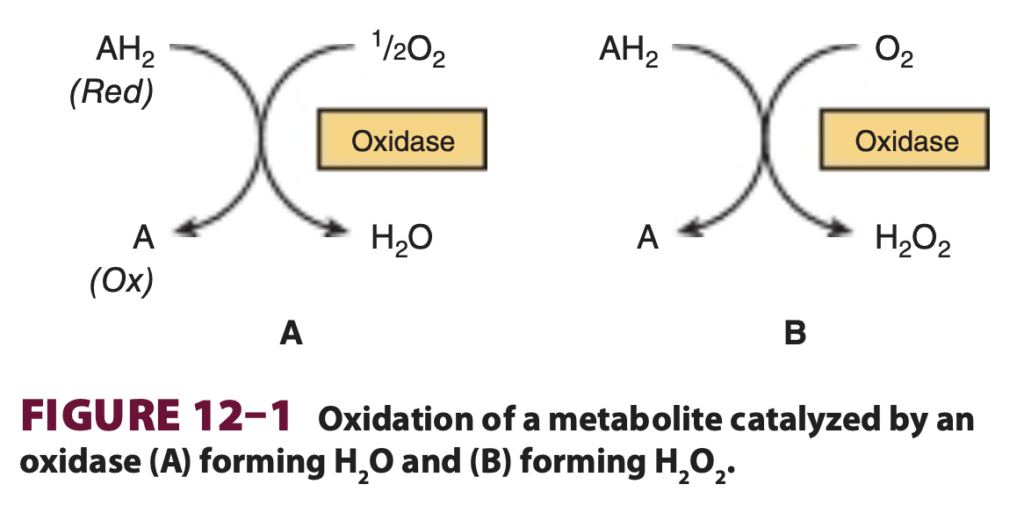
オキシダーゼは、酸素を電子受容体として使用し、有機基質を酸化する酵素です。これにより水または過酸化水素 (H₂O₂) が生成されます。例えば、シトクロムオキシダーゼ (Cytochrome oxidase) は電子伝達系の最終段階で、酸素を水に還元しエネルギーを生成します。オキシダーゼは、代謝の最終段階において酸素を使ってエネルギーを生産する過程、特に呼吸鎖 (Respiratory chain) において重要な役割を果たしています。
デヒドロゲナーゼ (Dehydrogenases) の主な機能
デヒドロゲナーゼには以下の2つの主な機能があります:
- 基質から電子を除去することで、酸化を引き起こす。
- 電子受容体(NAD⁺やFADなど)に電子を渡すことで、エネルギー生成を補助する。
デヒドロゲナーゼはニコチンアミドアデニンジヌクレオチド (NAD) やリボフラビン (Riboflavin, FAD) と結合して電子を受け渡します。例えば、解糖系 (Glycolysis) においてはグリセルアルデヒド-3-リン酸デヒドロゲナーゼ (Glyceraldehyde-3-phosphate dehydrogenase) がATP合成に寄与します。また、クエン酸回路 (Citric Acid Cycle) ではイソクエン酸デヒドロゲナーゼ (Isocitrate dehydrogenase) などが電子の受け渡しに重要な役割を果たします。呼吸鎖でもこれらの酵素はNADHやFADH₂の生成を通してエネルギー供給を支えます。
ハイドロペルオキシダーゼ (Hydroperoxidases) に分類される酵素
ハイドロペルオキシダーゼに分類される代表的な酵素には以下の2つがあります:
- カタラーゼ (Catalase):過酸化水素 (H₂O₂) を水と酸素に分解する反応を触媒します。この反応により、細胞に有害な過酸化水素を除去します。2H₂O₂ → 2H₂O + O₂
- ペルオキシダーゼ (Peroxidase):過酸化水素を使って有機物質を酸化します。特にグルタチオンペルオキシダーゼ (Glutathione peroxidase) は、細胞を酸化ストレスから守る重要な役割を果たしています。
これらの酵素は過酸化物から細胞を保護し、酸化ストレスからの防御に重要です。
オキシゲナーゼ (Oxygenases) の反応とサブグループ
オキシゲナーゼは基質に酸素原子を取り込む酵素で、以下の2段階の反応を触媒します:
- 酸素分子 (O₂) の一部が基質に取り込まれる。
- 残りの酸素原子は水など他の分子に変換される。
オキシゲナーゼには次の2つのサブグループがあります:
- モノオキシゲナーゼ (Monooxygenases)(別名:ミックスファンクションオキシダーゼ) – 酸素の一原子を基質に取り込み、もう一方の原子は水になる。
- ジオキシゲナーゼ (Dioxygenases) – 酸素分子の両方の原子を基質に取り込む。
シトクロムP450 (Cytochrome P450) の役割
シトクロムP450は、モノオキシゲナーゼの一種であり、薬物の代謝(解毒作用)やステロイドホルモンの合成に関わっています。これにより外来物質の解毒を行い、生体に有害な化合物の除去に寄与します。また、ステロイド合成においては、コレステロールから様々なステロイドホルモンを生成する過程で重要な役割を果たしています。
スーパーオキシドディスムターゼ (Superoxide Dismutase, SOD) の反応と重要性
スーパーオキシドディスムターゼは、スーパーオキシドラジカル(O₂⁻)を過酸化水素(H₂O₂)と酸素に変換する反応を触媒します。
2O₂⁻ + 2H⁺ → H₂O₂ + O₂
この酵素は、スーパーオキシドラジカルという活性酸素種から細胞を保護することで、酸素毒性から組織を守ります。スーパーオキシドラジカルはDNA、タンパク質、脂質などにダメージを与えるため、SODの作用は酸化ストレスの軽減に重要です。
内容
生物医学的な重要性
化学的には、酸化(oxidation)は電子の除去として定義され、還元(reduction)は電子の獲得として定義されます。したがって、分子(電子供与体)の酸化は常に第2の分子(電子受容体)の還元を伴います。この酸化還元の原則は、生化学システムにも適用され、生物学的酸化の本質を理解するための重要な概念です。多くの生物学的酸化は、例えば脱水素化(dehydrogenation)のように分子酸素が関与しなくても行うことができることに注意してください。高等動物の生命は、呼吸(respiration)のために酸素供給に依存しています。呼吸とは、水を生成するために水素(hydrogen)と酸素(oxygen)を反応させてATP(エネルギー)を得るプロセスです(第11章参照)。さらに、分子酸素はオキシゲナーゼ(oxygenases)と呼ばれる酵素によってさまざまな基質に取り込まれます。多くの薬物、汚染物質、化学発癌物質(異物(xenobiotics))は、シトクロムP450システム(cytochrome P450 system)と呼ばれるこの酵素によって代謝されます。酸素の投与は、呼吸不全や循環不全の患者の治療において命を救うことができます。
自由エネルギー変化は酸化還元電位の観点で表現できる
酸化還元反応において、自由エネルギー変化(free energy change)は、反応物が電子を供与または受容する傾向に比例します。したがって、自由エネルギー変化をΔG°(第11章参照)の観点で表すことに加えて、酸化還元電位(redox potential, E’)として数値的に表現することも可能です。化学的には、システムの酸化還元電位(E)は通常水素電極(hydrogen electrode, 0.0 V, pH 0.0)の電位と比較されます。しかし、生物学的システムにおいては酸化還元電位(E)は通常pH7.0で表現され、このとき水素電極の電位は-0.42Vです。哺乳動物の生化学において特に重要な酸化還元システムの酸化還元電位は表12-1に示されています。この表の酸化還元システムの相対的位置から、酸化還元対から別の酸化還元対への電子の流れの方向を予測することができます。
| システム (System) | 電位 (Volts) |
|---|---|
| H⁺/H₂ | -0.42 |
| NAD⁺/NADH | -0.32 |
| リポ酸; 酸化/還元 (Lipoate; ox/red) | -0.29 |
| アセト酢酸/3-ヒドロキシ酪酸 (Acetoacetate/3-hydroxybutyrate) | -0.27 |
| ピルビン酸/乳酸 (Pyruvate/lactate) | -0.19 |
| オキサロ酢酸/リンゴ酸 (Oxaloacetate/malate) | -0.17 |
| フマル酸/コハク酸 (Fumarate/succinate) | +0.03 |
| シトクロムb; Fe³⁺/Fe²⁺ (Cytochrome b; Fe³⁺/Fe²⁺) | +0.08 |
| ユビキノン; 酸化/還元 (Ubiquinone; ox/red) | +0.10 |
| シトクロムc₁; Fe³⁺/Fe²⁺ (Cytochrome c₁; Fe³⁺/Fe²⁺) | +0.22 |
| シトクロムa; Fe³⁺/Fe²⁺ (Cytochrome a; Fe³⁺/Fe²⁺) | +0.29 |
| 酸素/水 (Oxygen/water) | +0.82 |
酸化還元に関与する酵素は酸化還元酵素(oxidoreductases)と呼ばれ、4つのグループに分類されます:
・オキシダーゼ(oxidases)、
・デヒドロゲナーゼ(dehydrogenases)、
・ハイドロペルオキシダーゼ(hydroperoxidases)、および
・オキシゲナーゼ(oxygenases)です。
オキシダーゼは酸素を水素受容体として利用する
オキシダーゼは基質から水素を除去し、酸素を水素受容体として使用します。反応生成物として水(water)や過酸化水素(hydrogen peroxide)が生成されます(図12-1)。
シトクロムオキシダーゼはヘムタンパク質(hemoprotein)であり、多くの組織に広く分布しています。これは、ミトコンドリア(mitochondria)に存在する呼吸伝達系の最終成分であり、デヒドロゲナーゼ(dehydrogenases)による基質分子の酸化から生じる電子を酸素に最終的に移動させる役割を果たします。この酵素の作用は一酸化炭素(carbon monoxide)、シアン化物(cyanide)、硫化水素(hydrogen sulfide)によって阻害され、細胞呼吸を妨げる中毒を引き起こします。シトクロムオキシダーゼ酵素複合体は、ヘムa(heme a)が他のヘムと結合しており、1つのタンパク質内で2つのヘムユニットを持つため、シトクロムaa(cytochrome aa)とも呼ばれます。このヘムは1つの鉄原子(Fe atom)を持ち、酸化還元の過程でFe3+とFe2+の間で変動します。さらに、2つの銅原子(copper atoms)が存在し、それぞれのヘムユニットに関連しています。
他のオキシダーゼはフラボタンパク質(flavoproteins)です。
他のオキシダーゼはフラボタンパク質である
フラボタンパク質酵素(flavoprotein enzymes)は、フラビンモノヌクレオチド(FMN)またはフラビンアデニンジヌクレオチド(FAD)を補欠分子族(prosthetic groups)として含んでいます。
FMNおよびFADは、体内でビタミンB2(リボフラビン)(riboflavin)から生成されます(第44章参照)。FMNおよびFADは通常、それぞれのアポ酵素(apoenzyme)タンパク質に強固に(しかし共有結合ではなく)結合しています。金属フラボタンパク質(metalloflavoproteins)は、1つ以上の金属(metals)を必要な補因子(cofactors)として含んでいます。フラボタンパク質オキシダーゼの例としては、腎臓で見られるL-アミノ酸オキシダーゼ(L-amino acid oxidase)があり、これは自然に存在するL-アミノ酸の酸化的脱アミノ化(oxidative deamination)に対して一般的な特異性を持ちます。さらに、キサンチンオキシダーゼ(xanthine oxidase)はモリブデンを含む酵素で、プリン塩基(purine bases)を尿酸(uric acid)に変換する重要な役割を果たします(第33章参照)。この酵素は特に尿酸排出動物(uricotelic animals)において重要です(第28章参照)。また、哺乳動物の肝臓に存在するFAD結合酵素のアルデヒドデヒドロゲナーゼ(aldehyde dehydrogenase)は、モリブデンと非ヘム鉄を含み、アルデヒドやN-ヘテロ環状基質に作用します。これらの酵素の酸化還元メカニズムは複雑であり、図12-2に示されるように2段階の反応が示唆されています。
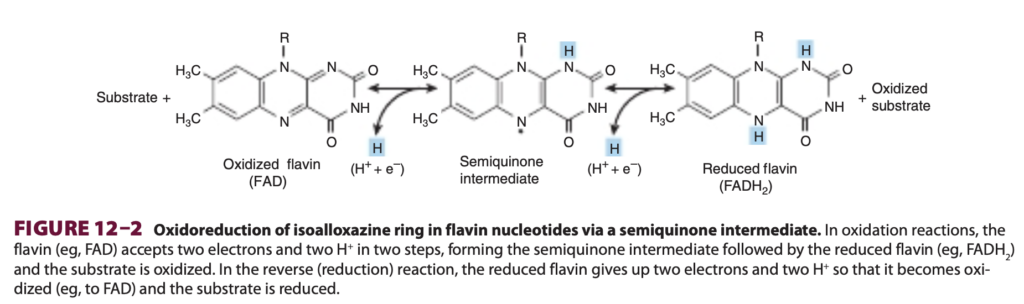
図12–2 フラビンヌクレオチドのイソアロキサジン環の酸化還元反応(Oxidoreduction of isoalloxazine ring in flavin nucleotides)
フラビン(例:FAD)は、酸化反応において2つの電子と2つのH⁺を2段階で受け取り、セミキノン中間体(semiquinone intermediate)を形成し、その後還元型フラビン(例:FADH₂)を生成します。この過程で基質は酸化されます。逆の還元反応(reduction reaction)では、還元型フラビンが2つの電子と2つのH⁺を放出し、酸化型フラビン(例:FAD)に戻り、基質が還元されます。
デヒドロゲナーゼは主に2つの機能を持つ
デヒドロゲナーゼクラスには多くの酵素があります。その主な機能は次の2つです。
- 酸化還元反応(oxidation-reduction reaction)で、1つの基質から別の基質に水素(hydrogen)を転移する(図12-3)。これらのデヒドロゲナーゼは、ニコチンアミドアデニンジヌクレオチド(NAD+)のような一般的な補酵素(coenzymes)や水素運搬体(hydrogen carriers)を利用することがよくあります。このタイプの反応では、1つの基質が他の基質に対して酸化/還元されるため、反応は自由に逆行し、細胞内で還元当量(reducing equivalents)が転送され、酸化プロセスが無酸素条件(anaerobic conditions)下でも発生することができます。これは、たとえば解糖系の嫌気的段階(anaerobic phase)で見られます(図17-2参照)。
- 呼吸鎖電子伝達系(respiratory chain electron transport system)で基質から酸素に電子を転送する(図13-3参照)。
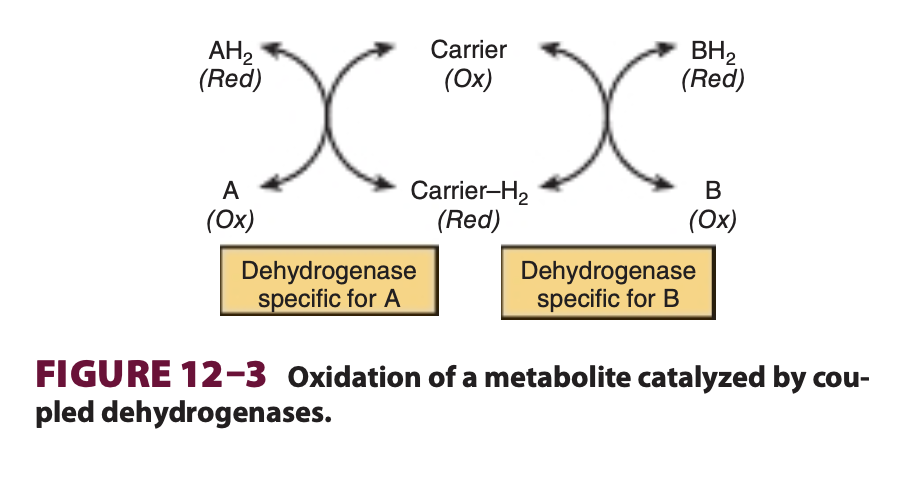
多くのデヒドロゲナーゼはニコチンアミド補酵素に依存する
これらのデヒドロゲナーゼは、NAD+またはニコチンアミドアデニンジヌクレオチドリン酸(NADP+)、もしくはその両方を利用し、これらは体内でビタミンB3(ナイアシン)(niacin)から生成されます(第44章参照)。
NAD+の構造は図12-4に示されています。NADP+はアデノシンの2’ヒドロキシル基がリン酸基(phosphate group)にエステル結合している点を除いて、NAD+と同一です。両ヌクレオチドの酸化型では、ニコチンアミド部分の窒素原子に正電荷が存在します(図12-4参照)。
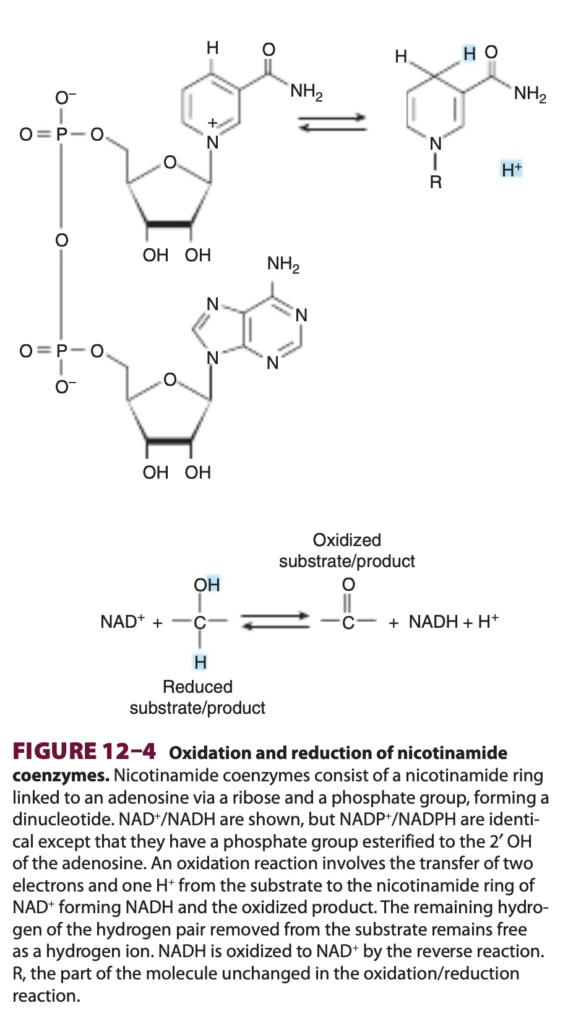
図12–4 ニコチンアミド補酵素の酸化と還元(Oxidation and reduction of nicotinamide coenzymes)
ニコチンアミド補酵素(nicotinamide coenzymes)は、ニコチンアミド環(nicotinamide ring)がリボース(ribose)およびリン酸基(phosphate group)を介してアデノシン(adenosine)に結合した構造を持ち、ジヌクレオチド(dinucleotide)を形成しています。NAD⁺/NADHが示されていますが、NADP⁺/NADPHもほぼ同じ構造であり、違いはアデノシンの2’OHがリン酸基にエステル結合している点のみです。酸化反応では、基質から2つの電子と**1つのH⁺**がニコチンアミド環に転送され、NADHおよび酸化生成物が生成されます。基質から取り除かれた水素対の残りの水素は、水素イオン(hydrogen ion)として自由な形で残ります。NADHは、逆反応によりNAD⁺に酸化されます。Rは、酸化還元反応中に変化しない分子の部分です。
これらの補酵素は、特定の基質によって還元され、適切な電子受容体によって再酸化されます。それらは、それぞれのアポ酵素から自由にかつ可逆的に解離することができます。
一般に、NAD結合デヒドロゲナーゼは次のタイプの酸化還元反応を触媒します:
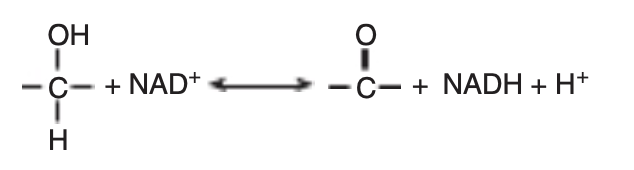
基質が酸化されると、2つの水素原子と2つの電子を失います。1つの水素と2つの電子はNAD+に受け取られ、NADHを形成し、もう1つの水素は放出されます(図12-4参照)。
このような反応は、特に解糖系(glycolysis, 第17章参照)やクエン酸回路(citric acid cycle, 第16章参照)などの代謝経路で頻繁に発生します。NADHはこれらの経路で燃料分子の酸化によって生成され、NAD+はNADHが電子を酸素に伝達し、ミトコンドリアの呼吸鎖を通じて酸化されることで再生され、この過程はATPの形成(formation of ATP, 第13章参照)に繋がります。
NADP結合デヒドロゲナーゼは、還元反応が必要な生合成経路(biosynthetic pathways)に特徴的に存在します。たとえば、脂肪酸合成(fatty acid synthesis, 第23章参照)やステロイド合成(steroid synthesis, 第26章参照)であり、またペントースリン酸経路(pentose phosphate pathway, 第20章参照)にも見られます。
他のデヒドロゲナーゼはリボフラビンに依存する
フラビングループ(flavin groups, FMNおよびFAD)は、オキシダーゼだけでなく、デヒドロゲナーゼにも関連しています。
FADは次のタイプの反応において電子受容体として機能します:
FADは2つの電子と2つの水素を受け取り、FADHを形成します(図12-2参照)。フラビングループは、ニコチンアミド補酵素よりも一般的にアポ酵素に強く結合しています。リボフラビン結合デヒドロゲナーゼの多くは、呼吸鎖(またはそれに関連する電子伝達系)で電子伝達に関与しています(第13章参照)。NADHデヒドロゲナーゼは、NADHとより高い酸化還元電位の成分との間で電子のキャリアーとして機能します(図13-3参照)。その他のデヒドロゲナーゼ、たとえばコハク酸デヒドロゲナーゼ(succinate dehydrogenase)、アシルCoAデヒドロゲナーゼ(acyl-CoA dehydrogenase)、およびミトコンドリアグリセロール-3-リン酸デヒドロゲナーゼ(mitochondrial glycerol-3-phosphate dehydrogenase)は、基質から呼吸鎖へ直接還元当量を転送します(図13-5参照)。フラビン依存デヒドロゲナーゼのもう1つの役割は、ジヒドロリポイルデヒドロゲナーゼ(dihydrolipoyl dehydrogenase)による還元型リポ酸(lipoate)の脱水素化(dehydrogenation)です。リポ酸は、ピルビン酸(pyruvate)およびα-ケトグルタル酸(α-ketoglutarate)の酸化的脱炭酸(oxidative decarboxylation)の中間体です(図13-5および図17-5参照)。電子転送フラボタンパク質(electron-transferring flavoprotein, ETF)は、アシルCoAデヒドロゲナーゼと呼吸鎖の間の電子キャリアーとして機能します(図13-5参照)。
シトクロムもデヒドロゲナーゼとみなされる場合がある
シトクロム(cytochromes)は鉄含有ヘムタンパク質(iron-containing hemoproteins)であり、酸化還元の過程で鉄原子(iron atom)はFe³⁺からFe²⁺へと変動します。シトクロムオキシダーゼ(前述)を除いて、それらはデヒドロゲナーゼとして分類されます。呼吸鎖では、これらはフラボタンパク質(flavoproteins)からシトクロムオキシダーゼに電子を運搬する役割を果たします(図13-5参照)。呼吸鎖には、識別可能な複数のシトクロムが存在します。それらは、シトクロムb(cytochrome b)、シトクロムc(cytochrome c)、シトクロムc₁(cytochrome c₁)、およびシトクロムオキシダーゼ(cytochrome oxidase, aa₃)です。シトクロムは他の場所、例えば小胞体(endoplasmic reticulum、シトクロムP450およびb₅)や、植物細胞、細菌、酵母などにも見られます。
ハイドロペルオキシダーゼは過酸化水素または有機ペルオキシドを基質として利用する
動物および植物に存在する2種類の酵素が、ハイドロペルオキシダーゼ(hydroperoxidases)に分類されます:ペルオキシダーゼ(peroxidases)およびカタラーゼ(catalase)です。
ハイドロペルオキシダーゼは、体を活性酸素種(reactive oxygen species, ROS)から守る重要な役割を果たします。ROSは、過酸化物などの酸素を含む高反応性分子で、正常な代謝中に形成されますが、蓄積すると有害です。これらは、癌(cancer)や動脈硬化(atherosclerosis)などの疾患の原因と考えられており、一般的な老化プロセスにも寄与すると考えられています(第21章、第44章、第54章参照)。
ペルオキシダーゼはさまざまな電子受容体を用いて過酸化物を還元する
ペルオキシダーゼは、牛乳(milk)、白血球(leukocytes)、血小板(platelets)、およびエイコサノイド代謝(eicosanoid metabolism, 第23章参照)に関与するその他の組織に存在します。それらの補欠分子族はプロトヘム(protoheme)です。ペルオキシダーゼが触媒する反応では、過酸化水素(hydrogen peroxide)はアスコルビン酸(ascorbate, ビタミンC)、キノン(quinones)、シトクロムc(cytochrome c)などのさまざまな物質を電子受容体として還元されます。
ペルオキシダーゼが触媒する反応は複雑ですが、全体の反応は次のようになります:
ペルオキシダーゼ反応
H₂O₂ + AH₂ → 2H₂O + A
赤血球および他の組織では、グルタチオンペルオキシダーゼ(glutathione peroxidase)という酵素が、セレン(selenium)を補欠分子族として含み、H₂O₂および脂質過酸化物(lipid hydroperoxides)の破壊を触媒します。この反応により、グルタチオン(glutathione)は酸化型(oxidized form)に変換され、膜脂質やヘモグロビン(hemoglobin)を過酸化物による酸化から保護します(第21章参照)。
カタラーゼは過酸化水素を電子供与体および電子受容体として利用する
カタラーゼ(catalase)は4つのヘムグループを含むヘムタンパク質です。それはペルオキシダーゼとして作用し、前述の反応を触媒することができますが、さらにH₂O₂の分解も触媒することができます。酸素と水を生成する反応は次の通りです:
カタラーゼ反応
2H₂O₂ → 2H₂O + O₂
この反応では、1分子のH₂O₂が基質電子供与体として、もう1分子のH₂O₂が酸化剤または電子受容体として利用されます。これは最も速い酵素反応の1つであり、1秒あたり何百万もの有害なH₂O₂分子を破壊します。生体内のほとんどの条件下では、カタラーゼのペルオキシダーゼ活性が優勢であるようです。カタラーゼは血液、骨髄、粘膜、腎臓、肝臓に存在します。ペルオキシソーム(peroxisomes)は、肝臓など多くの組織に存在する膜結合オルガネラであり、オキシダーゼとカタラーゼが豊富に含まれています。したがって、H₂O₂を生成し分解する酵素が同じ細胞内区画に存在します。しかし、ミトコンドリアや小胞体の電子伝達系(microsomal electron transport systems)、およびキサンチンオキシダーゼ(xanthine oxidase)は、H₂O₂の追加の供給源として考慮すべきです。
オキシゲナーゼは基質分子に酸素を直接転移および取り込む反応を触媒する
オキシゲナーゼは、さまざまなタイプの代謝産物(metabolites)の合成や分解に関与しています。これらは2段階の反応を触媒します:
- 酵素は活性部位で酸素を結合させる。
- 結合した酸素は還元されるか基質に転移される。
オキシゲナーゼは、2つのサブグループに分けられます:ジオキシゲナーゼ(dioxygenases)とモノオキシゲナーゼ(monooxygenases)です。
ジオキシゲナーゼは分子状酸素の両原子を基質に取り込む
ジオキシゲナーゼが触媒する基本的な反応は次の通りです:
A + O₂ → AO₂
例としては、肝臓酵素(liver enzymes)であるホモゲンチジン酸ジオキシゲナーゼ(homogentisate dioxygenase)および3-ヒドロキシアントラニル酸ジオキシゲナーゼ(3-hydroxyanthranilate dioxygenase)があり、これらは鉄(iron)を含んでいます。また、トリプトファンジオキシゲナーゼ(tryptophan dioxygenase, トリプトファンピロラーゼ(tryptophan pyrrolase), 第29章参照)はヘム(heme)を利用します。
モノオキシゲナーゼ(混合機能オキシダーゼ、ヒドロキシラーゼ)は分子状酸素の1つの原子のみを基質に取り込む
もう1つの酸素原子は水に還元され、追加の電子供与体または補助基質(cosubstrate, Z)が必要です:
A + H + O₂ + ZH₂ → A – OH + H₂O + Z
シトクロムP450はステロイド代謝および多くの薬物の解毒に重要なモノオキシゲナーゼである
シトクロムP450(cytochromes P450)は、重要なヘム含有モノオキシゲナーゼのスーパーファミリーであり、人間のゲノムには50以上のこうした酵素が存在します。これらは主に肝臓(liver)や腸(intestine)の小胞体(endoplasmic reticulum)に位置していますが、いくつかの組織ではミトコンドリア(mitochondria)にも存在します。シトクロムは、NADHおよびNADPHの両方が還元当量を供与できる電子伝達系(electron transport chain)に関与しています。電子はFADまたはFMNを介した2種類の反応でシトクロムP450に渡されます。クラスIシステム(class I systems)は、FAD含有還元酵素、鉄硫黄タンパク質(Fe₂S₂ protein)、およびP450ヘムタンパク質から成り、クラスIIシステム(class II systems)はFADH₂からFMNに電子を伝達するシトクロムP450還元酵素(cytochrome P450 reductase)を含みます(図12-5)。クラスIおよびIIシステムはよく特徴付けられていますが、近年ではこれらのカテゴリーに属さない他のシトクロムP450も特定されています。最終段階では、酸素がシトクロムP450から電子を受け取り還元され、1つの酸素原子がH₂Oに取り込まれ、もう1つの酸素原子が基質に取り込まれて通常ヒドロキシル化(hydroxylation)を引き起こします。この一連の酵素反応は、ヒドロキシラーゼサイクル(hydroxylase cycle)として知られており、図12-6に示されています。肝臓の小胞体では、シトクロムP450は他のヘム含有タンパク質であるシトクロムb₅(cytochrome b₅)と共に存在し、薬物代謝および解毒において主要な役割を果たしています。シトクロムb₅はまた、脂肪酸デサチュラーゼ(fatty acid desaturase)としても重要な役割を果たします。シトクロムP450およびb₅は、体内での薬物の修飾および分解の約75%を担っています。多くの医薬品、例えばフェノバルビタール(phenobarbital)などは、シトクロムP450の合成を誘導する能力を持っています。
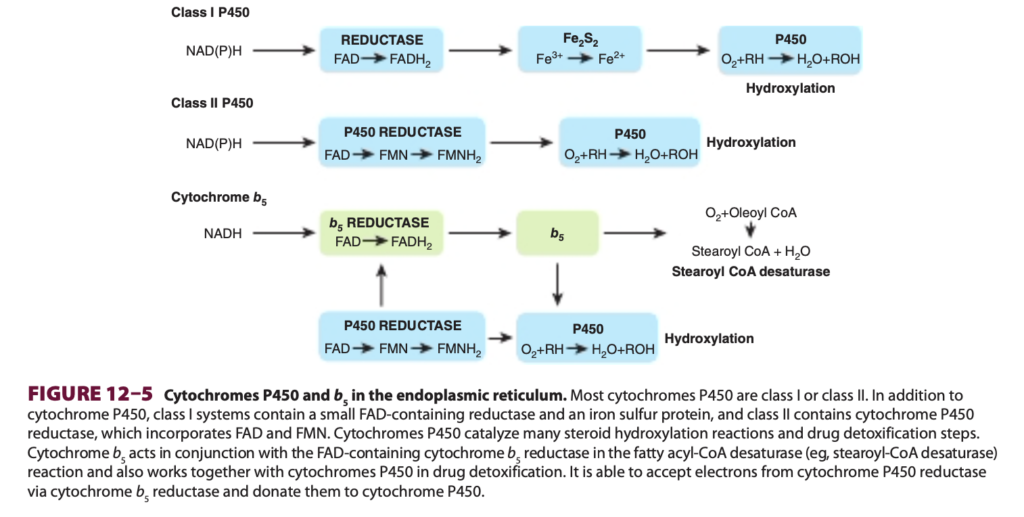
図12–5 小胞体におけるシトクロムP450およびb₅(Cytochromes P450 and b₅ in the endoplasmic reticulum)
ほとんどのシトクロムP450(cytochromes P450)は、クラスIまたはクラスIIに分類されます。クラスIシステムには、FADを含む小型還元酵素および鉄硫黄タンパク質(iron-sulfur protein)が含まれ、クラスIIにはFADおよびFMNを含むシトクロムP450還元酵素(cytochrome P450 reductase)が含まれます。シトクロムP450は多くのステロイドのヒドロキシル化反応(steroid hydroxylation reactions)や薬物解毒過程(drug detoxification steps)を触媒します。シトクロムb₅(cytochrome b₅)は、FADを含むシトクロムb₅還元酵素とともに脂肪アシルCoAデサチュラーゼ(fatty acyl-CoA desaturase、例:ステアロイルCoAデサチュラーゼ)反応に関与し、さらに薬物解毒においてシトクロムP450とも協力します。シトクロムb₅は、シトクロムP450還元酵素を介して電子を受け取り、シトクロムP450に供与することができます。
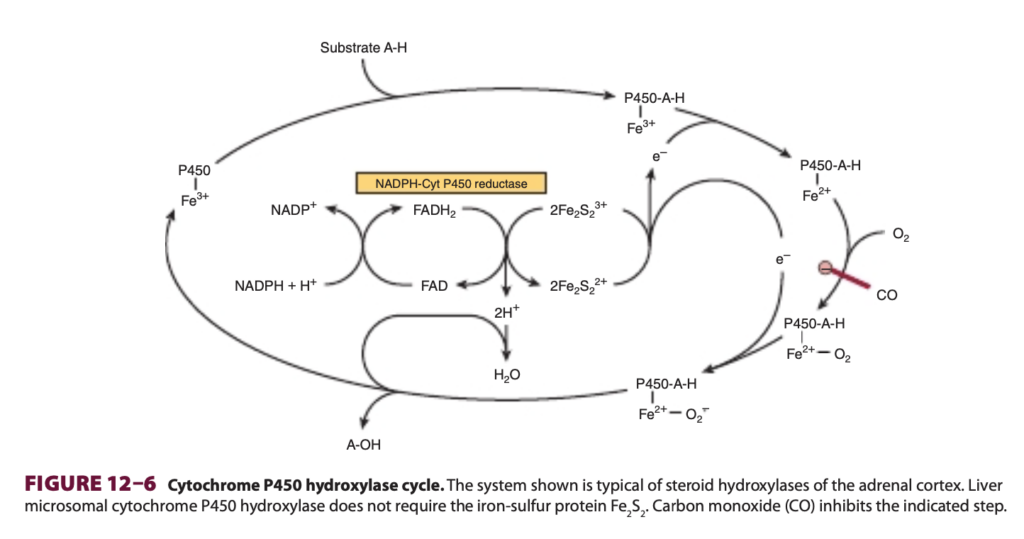
図12–6 シトクロムP450ヒドロキシラーゼサイクル(Cytochrome P450 hydroxylase cycle)
このシステムは、副腎皮質(adrenal cortex)のステロイドヒドロキシラーゼに典型的なものです。肝臓のミクロソームシトクロムP450ヒドロキシラーゼ(liver microsomal cytochrome P450 hydroxylase)は、鉄硫黄タンパク質(Fe₂S₂)を必要としません。一酸化炭素(CO)は、示された段階でこの反応を阻害します。
ミトコンドリアシトクロムP450システムはステロイド生成組織に存在し、コレステロールからのステロイドホルモンの生合成に関与している
ミトコンドリアのシトクロムP450システムは、副腎皮質(adrenal cortex)、精巣(testis)、卵巣(ovary)、および胎盤(placenta)などのステロイド合成組織に存在し、コレステロールからステロイドホルモンの合成に関与しています。具体的には、C₁₁およびC₂₀の位置での側鎖切断、ならびに11βおよび18の位置での水酸化を行います。さらに、腎臓(renal)では、ビタミンD代謝(vitamin D metabolism)における1αおよび24-ヒドロキシラーゼ(1α- and 24-hydroxylations)、ならびにコレステロール7αヒドロキシラーゼ(cholesterol 7α-hydroxylase)やステロール27-ヒドロキシラーゼ(sterol 27-hydroxylase)などが、コレステロールからの胆汁酸(bile acids)の合成に関与しています(第26章および第41章参照)。
スーパーオキシドディスムターゼは好気性生物を酸素毒性から守る
1つの電子がO₂に転移すると、潜在的に有害なスーパーオキシドアニオンラジカル(superoxide anion-free radical, O₂⁻)が生成され、これがフリーラジカル連鎖反応(free-radical chain reactions)を引き起こし、その破壊的効果を増幅します(第21章参照)。スーパーオキシドが組織中でどれだけ容易に生成されるか、そしてスーパーオキシドディスムターゼ(superoxide dismutase, SOD)がすべての好気性生物(嫌気性生物を除く)に存在することから、酸素の潜在的な毒性は、酸素がスーパーオキシドに変換されることに起因すると考えられます。
スーパーオキシドは、例えばキサンチンオキシダーゼ(xanthine oxidase)に存在する還元型フラビンが分子酸素によって単一の電子で酸化されると生成されます:
反応式
Enz-Flavin-H₂ + O₂ → Enz-Flavin-H + O₂⁻ + H⁺
スーパーオキシドは、酸化型シトクロムc(oxidized cytochrome c)を還元するか、またはSODによって除去され、スーパーオキシドを分子酸素および過酸化水素に変換します:
反応式
2O₂⁻ + 2H⁺ → O₂ + H₂O₂
この反応では、スーパーオキシドが酸化剤および還元剤の両方として作用します。したがって、SODは好気性生物をスーパーオキシドの有害な影響から保護します。この酵素は、ミトコンドリアおよび細胞質ゾル(cytosol)を含むすべての主要な好気性組織に存在します。動物を100%酸素の大気にさらすと、特に肺(lungs)においてSODの適応的な増加が引き起こされますが、長時間の曝露は肺の損傷および死に至ります。抗酸化物質(antioxidants)である例えばα-トコフェロール(α-tocopherol, ビタミンE)などはフリーラジカルの捕捉剤として作用し、酸素の毒性を減少させます(第44章参照)。
要約
- 生物学的システムにおいても化学的システムにおいても、酸化(電子の喪失)は常に電子受容体の還元を伴います。
- 酸化還元酵素は代謝においてさまざまな機能を果たし、オキシダーゼとデヒドロゲナーゼは呼吸において主要な役割を果たします。ハイドロペルオキシダーゼはフリーラジカルによる損傷から体を保護し、オキシゲナーゼは薬物やステロイドのヒドロキシル化に関与します。
- 組織はスーパーオキシドラジカルによって引き起こされる酸素毒性から、特定の酵素であるスーパーオキシドディスムターゼ(SOD)によって保護されています。


コメント