Contents
- 1 ブロックテスト酵素部分
- 1.1 Question 151:(ここからヘモグロビン)
- 1.2 Question 152:
- 1.3 Question 153:
- 1.4 Question 154:
- 1.5 Question 155:
- 1.6 Question 156:
- 1.7 Question 157:
- 1.8 Question 158:
- 1.9 Question 160:
- 1.10 Question 161:
- 1.11 Question 162:
- 1.12 Question 164:
- 1.13 Question 165:
- 1.14 Question 166 of 200(ここから酵素)
- 1.15 Question 167 of 200
- 1.16 Question 168 of 200
- 1.17 Question 169 of 200
- 1.18 Question 170 of 200
- 1.19 Question 171 of 200
- 1.20 Question 172 of 200
- 1.21 Question 173 of 200
- 1.22 Question 174 of 200
- 1.23 Question 175 of 200(ここからKinetics and Regulation)
- 1.24 Question 176 of 200
- 1.25 Question 177 of 200
- 1.26 Question 178 of 200
- 1.27 Question 179 of 200
- 1.28 Question 180 of 200
- 1.29 Question 181 of 200
- 1.30 Question 182 of 200
- 1.31 Question 184 of 200
- 1.32 Question 185 of 200
- 1.33 Question 186 of 200
- 1.34 Question 187 of 200
- 1.35 Question 188 of 200
- 1.36 Question 189 of 200
- 1.37 Question 190 of 200
- 1.38 Question 193 of 200
- 2 PPTからの問題(自作)
- 3 酵素補足(熱法則、エンタルピー、プロテオリティック活性化)
- 3.1 Question 1:
- 3.2 Question 2:
- 3.3 Question 3:
- 3.4 Question 4:
- 3.5 Question 5:
- 3.6 Question 6:
- 3.7 Question 7:(へモ)
- 3.8 Question 8:(へモ)
- 3.9 Question 9:
- 3.10 Question 10:
- 3.11 Question 11:
- 3.12 Question 12:
- 3.13 Question 13:(へモ)
- 3.14 Question 14:
- 3.15 Question 15:(へモ)
- 3.16 Question 16:
- 3.17 Question 17:(へモ)
- 3.18 Question 18:(へモ)
- 3.19 Question 19:
- 3.20 Question 20:
- 4 自作:補足(Gエナジー、遅い早い制御)
- 4.1 Question 1:
- 4.2 Question 2:
- 4.3 Question 3:
- 4.4 Question 4:
- 4.5 Question 5:
- 4.6 Question 6:
- 4.7 Question 7:
- 4.8 Question 8:
- 4.9 Question 9:
- 4.10 Question 10:
- 4.11 Question 11:
- 4.12 Question 12:
- 4.13 Question 13:
- 4.14 Question 14:
- 4.15 Question 15:
- 4.16 Question 16:
- 4.17 Question 17:
- 4.18 Question 18:
- 4.19 Question 19:
- 4.20 Question 20:
- 4.21 Question 1:
- 4.22 Question 2:
- 4.23 Question 3:
- 4.24 Question 4:
- 4.25 Question 5:
- 4.26 Question 6:
- 4.27 Question 7:
- 4.28 Question 8:
- 4.29 Question 9:
- 4.30 Question 10:
- 4.31 Question 11:
- 4.32 Question 12:
- 4.33 Question 13:
- 4.34 Question 14:
- 4.35 Question 15:
- 4.36 Question 16:
- 4.37 Question 17:
- 4.38 Question 18:
- 4.39 Question 19:
- 4.40 Question 20:
ブロックテスト酵素部分
Question 151:(ここからヘモグロビン)
The 3D structure of proteins common to myoglobin and hemoglobin subunits. Select the correct response:
a) HEME
b) PYRROLE RING
c) IRON
d) GLOBIN
Answer: d) GLOBIN
解説:
グロビン (Globin) は、ヘモグロビンとミオグロビンの両方のタンパク質サブユニットに共通する3次構造を持つポリペプチド鎖です。これに対して、選択肢aの「ヘム (Heme)」や選択肢bの「ピロール環 (Pyrrole Ring)」、選択肢cの「鉄 (Iron)」は、主にヘム基やその周辺の化学構造に関連するものですが、グロビンというポリペプチド構造そのものではありません。
Question 152:
A Porphyrin ring that has a Fe+2 ion in the center of the molecule is called Select the correct response:
a) HEME
b) GLOBIN
c) BOTH A & B
Answer: a) HEME
解説:
ポルフィリン環の中心に二価鉄 (Fe2+) が配置されている構造は「ヘム (Heme)」と呼ばれます。選択肢bの「グロビン (Globin)」は、ヘモグロビンやミオグロビンのタンパク質部分であり、ヘム自体ではないため間違いです。したがって、正解はaです。
Question 153:
Oxygen binds to the iron atom in the heme group at what oxidation state? Select the correct response:
a) FERROUS STATE
b) FERRIC SULFATE
c) FERROUS SULFATE
d) FERRIC STATE
Answer: a) FERROUS STATE
解説:
酸素は、ヘムの鉄原子が二価鉄 (Fe2+; Ferrous State) のときに結合します。選択肢bやcの「Ferric sulfate (三酸化鉄)」や「Ferrous sulfate」は化合物の名称であり、ヘムに直接関係がありません。また、三価鉄 (Ferric state) の場合には酸素が結合できないため、選択肢dも誤りです。
Question 154:
What protein is primarily located in the muscle cells that stores oxygen used in time of high demand for energy? Select the correct response:
a) HEMOGLOBIN
b) MYOGLOBIN
c) PEPSIN
d) CHYMOTRYPSIN
Answer: b) MYOGLOBIN
解説:
ミオグロビン (Myoglobin) は、筋細胞内に存在し、酸素を貯蔵してエネルギーの需要が高まった際に利用されるタンパク質です。ヘモグロビン (Hemoglobin) は主に血液中で酸素を運搬する役割を担い、ペプシン (Pepsin) やキモトリプシン (Chymotrypsin) は消化酵素であるため、選択肢cとdは間違いです。
Question 155:
CASE: An 18-year-old male was going for a run, after an hour of 3 intense laps, he suddenly felt crampy pain on both thighs. A storage protein can supply oxygen to his muscles. What type of curve will this protein’s activity be depicted as?
a) SIGMOID CURVE
b) HYPERBOLIC CURVE
Answer: b) HYPERBOLIC CURVE
解説:
ミオグロビンの酸素結合曲線は、酸素分圧に対してハイパーボリックな (Hyperbolic) 形状を示します。これに対して、ヘモグロビンの酸素結合曲線はS字状 (Sigmoid Curve) を描きます。これはヘモグロビンが協同効果を示すためです。
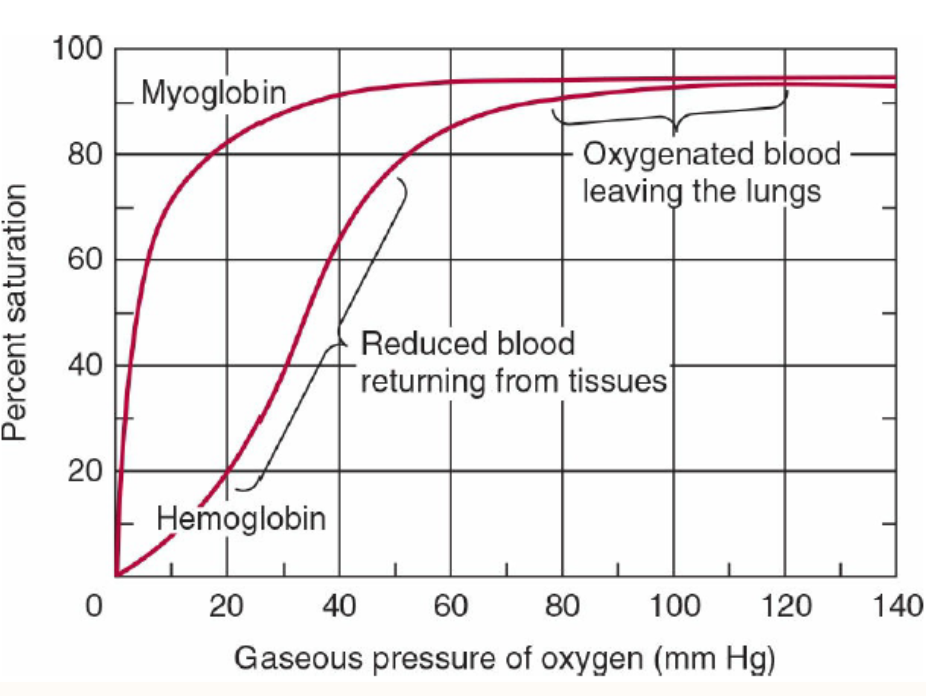
Question 156:
Increase of H+ ions would mean what shift of the hemoglobin-02 dissociation curve?
a) SHIFT TO THE RIGHT
b) SHIFT TO THE LEFT
c) NONE OF THE ABOVE
Answer: a) SHIFT TO THE RIGHT
解説:
H+イオン濃度の増加(酸性化)はヘモグロビンの酸素解離曲線を右にシフトさせます。これはボーア効果 (Bohr effect) と呼ばれ、酸性環境下ではヘモグロビンの酸素への親和性が低下し、酸素が組織へ容易に放出されることを示しています。選択肢bの左シフトは、逆に酸素親和性が高まる現象であり、H+増加とは反対です。
Question 157:
An increase in 2,3-BPG would indicate what change in the Hemoglobin dissociation curve?
a) RIGHT SHIFT
b) LEFT SHIFT
c) BOTH A & B
Answer: a) RIGHT SHIFT
解説:
2,3-BPGの増加はヘモグロビンの酸素解離曲線を右にシフトさせ、酸素親和性を低下させます。これは、酸素がより容易に組織へ放出されることを意味します。選択肢bの「左シフト」は酸素親和性が高まる現象ですが、これは2,3-BPGの増加とは逆の効果です。
Question 158:
Which statement is true regarding Hemoglobin?
- The binding of the first molecule of O2 to deoxyHb shifts the heme iron toward the plane of the heme ring
- Profound changes in secondary, tertiary, and quaternary structures accompany the O2-induced transition of hemoglobin from the high-affinity T state to the low-affinity R state.
- An R state Hemoglobin would mean that:
Select the correct response:
a) High affinity for oxygen in the tissues
b) High affinity for oxygen in the lungs
c) Low affinity for oxygen in the lungs
d) None of the above
Answer: b) High affinity for oxygen in the lungs
解説:
R状態のヘモグロビン (Relaxed state) は、酸素に対する高い親和性を持ち、これは主に肺での酸素結合を意味します。選択肢aの「組織での酸素への高い親和性」はT状態 (Tense state) の説明であり、選択肢cの「肺での低い親和性」も不正解です。R状態になると、酸素は効率的に結合します。
Question 160:
What are the factors that would give Hemoglobin a R-state?
a) HIGH O2
b) LOW pH
c) HIGH CO2
Answer: a) HIGH O2
解説:
R状態 (Relaxed state) のヘモグロビンは、酸素が豊富な環境(高い酸素濃度)で見られます。逆に、低いpHや高いCO2濃度はT状態 (Tense state) を安定化させ、酸素親和性を低下させます。選択肢bやcはどちらもT状態を促進するため、不正解です。
Question 161:
Stabilizes deoxygenated Hb by forming additional salt bridges:
a) CARBON DIOXIDE
b) OXYGEN
c) 2,3 BISPHOSPHOGLYCERATE (BPG)
d) FERROUS IRON
Answer: c) 2,3 BISPHOSPHOGLYCERATE (BPG)
解説:
2,3-BPGは、酸素が結合していないヘモグロビン (deoxyHb) を安定化させるために追加の塩橋を形成し、酸素解離を促進します。酸素 (Oxygen) は酸素結合状態を促進し、二酸化炭素 (Carbon dioxide) はボーア効果を通じて間接的に酸素解離を助けますが、塩橋の形成には直接関与しません。選択肢dの「Ferrous iron」はヘムの構成要素であり、これも関係ありません。
Question 162:
This effect describes how the affinity of Hb for H+ and CO2 is affected by changes in Hb-O2 saturation:
a) Haldane Effect
b) Bohr Effect
Answer: a) Haldane Effect
解説:
ハルダン効果 (Haldane Effect) は、酸素飽和度の変化に応じてヘモグロビンのH+やCO2への親和性が変化する現象を指します。酸素がヘモグロビンに結合すると、CO2やH+が解離しやすくなります。ボーア効果 (Bohr Effect) は、逆にH+やCO2の濃度がヘモグロビンの酸素親和性に影響を与える現象で、混同しないように注意が必要です。
ボーア効果(Bohr effect)
酸素と二酸化炭素の交換が起こる組織で見られ、二酸化炭素の上昇やpHの低下によりヘモグロビンが酸素を放出しやすくなる現象です。これは、酸素が必要な組織で効率よく酸素を供給するためのメカニズムです。
ハルダイン効果(Haldane effect)
肺で見られ、酸素が増えると、ヘモグロビンが二酸化炭素やH+を放出しやすくなる現象です。酸素が豊富な肺で、二酸化炭素の排出が促進されるメカニズムです。
Question 164:
CASE: A 12-year-old female was brought to the Emergency room with complaints of severe thigh pain. No trauma was noted. Physical exam showed that she has pallor and Complete Blood Count indicated that she has anemia. What disease condition is associated with a genetic defect when valine replaces that surface residue of Glutamine in the 6th position?
a) MYOGLOBINURIA
b) HEMOGLOBIN M
c) THALASSEMIA
d) SICKLE CELL DISEASE
Answer: d) SICKLE CELL DISEASE
解説:
鎌状赤血球病 (Sickle Cell Disease) は、6番目のアミノ酸がグルタミン酸からバリンに置き換わる遺伝子変異によって引き起こされます。この変異はヘモグロビンSを形成し、赤血球の形状が変形してしまいます。選択肢aの「Myoglobinuria」は筋細胞崩壊時にミオグロビンが尿中に漏れ出る状態で、選択肢bの「Hemoglobin M」はヘモグロビン異常症の一種、選択肢cの「Thalassemia」は異なる遺伝的疾患です。
Question 165:
What protein is found in urine during cases of severe trauma to the skeletal muscles followed by renal damage?
a) Albumin
b) Myoglobin
c) Hemoglobin
Answer: b) Myoglobin
解説:
重度の筋肉損傷の後にミオグロビンが尿中に現れる状態は「ミオグロビン尿症 (Myoglobinuria)」として知られています。これは腎臓にダメージを与える可能性があります。選択肢aのアルブミンは血漿タンパク質で、腎疾患時に尿中に現れることがありますが、筋肉損傷とは無関係です。選択肢cのヘモグロビンは赤血球破壊時に尿中に現れることもありますが、筋肉損傷後の典型的な症状ではありません。
Question 166 of 200(ここから酵素)
TRUE about enzymes except:
- a) Acts as catalysts for all metabolic processes
- b) They may undergo transient modification during catalysis
- c) They are stereospecific
- d) Enzymes act as nonspecific catalysts
- e) All of the Above
Correct Answer: d) Enzymes act as nonspecific catalysts
解説:
d) Enzymes act as nonspecific catalystsは誤りです。酵素は**特異性 (specificity)を持っており、特定の基質に対してだけ作用します。酵素は基質と特異的に結合し、その基質のみに対して反応を促進するという特性があります。したがって、酵素は「非特異的な触媒」ではなく、「特異的な触媒」**です。
他の選択肢の解説:
a) Acts as catalysts for all metabolic processes
これは正しいです。酵素はすべての代謝プロセスに関与し、反応を促進する触媒の役割を果たします。体内のほとんどの化学反応は酵素によって調整され、速度が速められます。
b) They may undergo transient modification during catalysis
これも正しいです。酵素は触媒作用の過程で一時的に変化を受けることがありますが、反応後に元の状態に戻ります。例えば、酵素-基質複合体を形成して基質に変化を与えた後、再び元の状態に戻ることで反応を繰り返します。
c) They are stereospecific
これも正しいです。酵素は立体特異性(stereospecificity)を持ち、特定の立体配置の基質のみを認識して作用します。例えば、L-アミノ酸とD-アミノ酸のような立体異性体のうち、特定の一方にしか反応しない酵素が多く存在します。
e) All of the Above
この選択肢は他の選択肢がすべて正しい場合に正解となりますが、d)が誤りであるため、e) All of the Aboveも正解ではありません。
Question 167 of 200
Enzymes that catalyze geometric or structural changes within a molecule are called:
- a) LYASES
- b) ISOMERASES
- c) OXIDASES
- d) TRANSFERASES
Correct Answer: b) ISOMERASES
Explanation:
「イソメラーゼ(isomerases)」は、分子内で幾何学的または構造的変化を触媒する酵素です。例えば、異性体間の変換を行います。選択肢aの「ライアーゼ(lyases)」は分子の切断や結合を触媒し、選択肢cの「酸化還元酵素(oxidases)」は酸化反応を触媒します。選択肢dの「転移酵素(transferases)」は基質間で基を移動させる役割を果たします。
Question 168 of 200
Hexokinase is an enzyme that facilitates phosphorylation of glucose to become glucose 6 phosphate by ATP. Its action of transferring a phosphoryl group belongs to what class of enzymes?
- a) LIGASES
- b) ISOMERASES
- c) HYDROLASES
- d) TRANSFERASES
Correct Answer: d) TRANSFERASES
Explanation:
「ヘキソキナーゼ(hexokinase)」はATPからのリン酸基をグルコースに転移させる酵素であり、これは「転移酵素(transferases)」に分類されます。選択肢aの「リガーゼ(ligases)」は、2つの分子を結合する役割を果たします。選択肢bの「イソメラーゼ(isomerases)」は異性体間の変換を行い、選択肢cの「加水分解酵素(hydrolases)」は水を用いて化学結合を切断します。
Question 169 of 200
Molecules that participate directly in substrate binding or in catalysis:
- a) PROSTHETIC GROUPS
- b) COENZYMES
- c) COFACTORS
- d) ALL OF THE ABOVE
Correct Answer: d) ALL OF THE ABOVE
Explanation:
「補因子(cofactors)」には「補助因子(prosthetic groups)」、「コエンザイム(coenzymes)」などが含まれます。これらは基質の結合や触媒作用に直接関与します。選択肢dの「全ての上記(all of the above)」が正しいです。
a) PROSTHETIC GROUPS(補欠分子族)
補欠分子族は酵素に強く結合しており、基質の結合や触媒反応に直接関与します。例えば、ヘモグロビンにおけるヘムグループは、酸素の結合に重要な役割を果たします。また、補欠分子族は触媒機能において不可欠な役割を果たします。
b) COENZYMES(補酵素)
補酵素は酵素の触媒作用を助けるために、酵素と緩く結合する有機分子です。補酵素も基質の結合や化学反応に関与するため、正解です。ビタミン由来の補酵素(例:NAD⁺やFAD)は、酸化還元反応で重要な役割を果たします。
c) COFACTORS(補因子)
補因子は、酵素の活性に必要な無機分子や金属イオン(例:Mg²⁺、Zn²⁺)です。これらも触媒作用を助け、基質と結合するため、正解です。
Question 170 of 200
WHICH STATEMENT IS TRUE AMONG COFACTORS?
- a) BIND WEAKLY AND TRANSIENTLY TO ENZYMES OR SUBSTRATES FORMING DISSOCIABLE COMPLEXES
- b) HAVE DIFFERENT FUNCTIONS TO PROSTHETIC GROUPS
- c) MOST COMMON COFACTORS ARE VITAMIN COMPLEXES
- d) ALL OF THE ABOVE
Correct Answer: a) BIND WEAKLY AND TRANSIENTLY TO ENZYMES OR SUBSTRATES FORMING DISSOCIABLE COMPLEXES
Explanation:
「補因子(cofactors)」は通常、酵素や基質に対して弱く一時的に結合し、可逆的な複合体を形成します。選択肢bの「プロステティックグループ(prosthetic groups)」とは異なる機能を持ちます。選択肢cの「最も一般的な補因子がビタミン複合体」というのは一部正しいですが、補因子全体の説明としては不完全です。したがって、選択肢aが正しいです。
b) HAVE DIFFERENT FUNCTIONS TO PROSTHETIC GROUPS
補因子と補欠分子族は、両方とも酵素の触媒作用に寄与しますが、その役割や機能は本質的に異なるわけではありません。補因子は、緩く結合するのに対して、補欠分子族は酵素と強く結合しますが、触媒作用を助けるという意味では似た機能を持っています。
c) MOST COMMON COFACTORS ARE VITAMIN COMPLEXES
補因子には無機物質(例:金属イオン)が多く、補酵素はビタミン由来の有機分子が多いですが、補因子全体としては必ずしもビタミン複合体が最も一般的ではありません。したがって、この選択肢は誤りです。
Question 171 of 200
Involves the breaking of a covalent bond. Mimics the transition state intermediate:
- a) ACID BASE CATALYSIS
- b) CATALYSIS BY STRAIN
- c) CATALYSIS BY PROXIMITY
- d) COVALENT CATALYSIS
Correct Answer: d) COVALENT CATALYSIS
Explanation:
「共有結合触媒(covalent catalysis)」は、共有結合を切断し、遷移状態中間体を模倣する触媒作用です。選択肢aの「酸・塩基触媒(acid-base catalysis)」は酸や塩基によって触媒作用を行います。選択肢bの「ひずみ触媒(catalysis by strain)」は基質にひずみを加えて触媒します。選択肢cの「近接触媒(catalysis by proximity)」は基質を近くに配置して触媒作用を行います。
Question 172 of 200
This process involves the formation of a covalent bond between the enzymes and one or more substrates:
- a) CATALYSIS BY PROXIMITY
- b) CATALYSIS BY STRAIN
- c) COVALENT CATALYSIS
- d) ACID BASE CATALYSIS
Correct Answer: c) COVALENT CATALYSIS
Explanation:
「共有結合触媒(covalent catalysis)」は、酵素と基質の間に共有結合を形成する過程です。選択肢aの「近接触媒(catalysis by proximity)」は分子を近くに配置し、選択肢bの「ひずみ触媒(catalysis by strain)」は基質にひずみを加え、選択肢dの「酸・塩基触媒(acid-base catalysis)」は酸または塩基を用いて触媒します。
Question 173 of 200
Physically distinct versions of a given enzyme, each catalyzes the same reaction:
- a) PROSTHETIC GROUPS
- b) COFACTORS
- c) ISOZYMES
- d) COENZYMES
Correct Answer: c) ISOZYMES
Explanation:
「異なる物理的バージョンの同じ酵素で、同じ反応を触媒するもの」は「アイソザイム(isozymes)」です。選択肢aの「補助因子(prosthetic groups)」は酵素の機能を補助する物質であり、選択肢bの「補因子(cofactors)」は酵素に結合して活性を促進します。選択肢dの「コエンザイム(coenzymes)」は酵素の補助因子として機能します。
Question 174 of 200
Elevated enzymes or isozymes in the blood usually is an indicator of what process undergone by a cell?
- a) CELL REPLICATION
- b) HYDROLYSIS
- c) PROTEIN SYNTHESIS
- d) CELL LYSIS
Correct Answer: d) CELL LYSIS
Explanation:
血中の酵素やアイソザイムの上昇は、通常「細胞破壊(cell lysis)」を示しています。細胞が破壊されると、内部の酵素が血液中に放出されるためです。選択肢aの「細胞複製(cell replication)」やbの「加水分解(hydrolysis)」、cの「タンパク質合成(protein synthesis)」とは直接の関係はありません。
Question 175 of 200(ここからKinetics and Regulation)
TRUE about Gibbs free-energy:
- a) DESCRIBES IN QUANTITATIVE FORM BOTH THE DIRECTION IN WHICH A CHEMICAL REACTION WILL TEND TO PROCEED
- b) DESCRIBES THE CONCENTRATION OF REACTANTS AND PRODUCTS THAT WILL BE PRESENT AT EQUILIBRIUM
- c) REACTANTS AND PRODUCTS THAT WILL BE PRESENT AT EQUILIBRIUM
- d) BOTH are correct
Correct Answer: a,b
Explanation:
「ギブズ自由エネルギー(Gibbs free energy)」は、化学反応が進行する方向を定量的に示します。選択肢bは平衡状態での反応物と生成物の濃度に関するものであり正しい。選択肢cは正しくありません。したがって、選択肢aが正しいです。
Question 176 of 200
TRUE about the Kinetic theory:
- a) For two molecules to react: must be within bond-forming distance of one another
- b) For two molecules to react: must possess sufficient kinetic energy to overcome the energy barrier for reaching the transition state
- c) ALL OF THE ABOVE
- d) COLLISION THEORY
Correct Answer: c) ALL OF THE ABOVE
Explanation:
「動力学理論(Kinetic theory)」は、反応が起こるためには
「分子が結合形成距離内にあること(a)」と
「十分な運動エネルギーを持ってエネルギー障壁を超えること(b)」が必要です。
選択肢dの「衝突理論(collision theory)」もこの理論の一部であるため、cが正しいです。
a) For two molecules to react: must be within bond-forming distance of one another
分子が反応するためには、互いに十分に近づいて、結合が形成できる距離に到達する必要があります。この距離に達しなければ、化学反応は起こりません。この記述は正しいです。
b) For two molecules to react: must possess sufficient kinetic energy to overcome the energy barrier for reaching the transition state
分子が反応するためには、遷移状態に到達するためのエネルギー障壁(活性化エネルギー)を超える十分な運動エネルギーを持つ必要があります。これがなければ、分子は反応せず、衝突しても反発します。この記述も正しいです。
d) COLLISION THEORY
衝突理論(Collision Theory)では、分子が反応するためには適切な向きで衝突し、かつ十分なエネルギーで衝突する必要があると説明しています。これも正しい理論です。
**遷移状態(Transition state, 遷移状態中間体とも呼ばれる)**とは、化学反応において、反応物が生成物に変化する過程でエネルギー的に最も高い状態のことを指します。これは反応が進む途中に一時的に存在する状態で、化学反応の中で非常に重要な役割を果たします。
遷移状態の特徴:
- エネルギー的に最高点
遷移状態は反応のエネルギープロファイルで、エネルギーが最も高い点です。これは、反応物と生成物の間で結合が壊れたり新しく作られたりする途中の状態で、活性化エネルギーと呼ばれるエネルギー障壁を越える必要があります。 - 不安定な状態
遷移状態は非常に短命で不安定です。この状態では、反応物と生成物の間にあるため、完全な反応物でも生成物でもありません。非常に速く次の段階に移行します。 - 遷移状態のエネルギーと反応速度の関係
遷移状態に到達するために必要なエネルギー(活性化エネルギー)が高ければ高いほど、反応速度は遅くなります。逆に、活性化エネルギーが低ければ反応は速く進みます。酵素などの触媒は、遷移状態に必要なエネルギーを下げることで反応速度を上げます。
例:
例えば、A-B という分子が C と反応して A-C と B になる反応を考えた場合、遷移状態では A-B の結合が壊れ、同時に A-C の結合が形成される途中の状態になります。このときのエネルギーが最も高く、これが遷移状態です。
日本語での表現:
- 遷移状態は「中間状態」とも呼ばれることがあり、反応が進行するための「道のりの頂点」として捉えられます。
- この状態を通過しないと、反応が進んで生成物を得ることはできません。
Question 177 of 200
FACTORS that affect reaction rate would be:
- Raising the ambient temperature increases the kinetic energy of molecules
- Rate of reactions is inversely proportional to their concentrations
Correct Answer: Raising the ambient temperature increases the kinetic energy of molecules
Explanation:
反応速度に影響を与える要因には「温度の上昇が分子の運動エネルギーを増加させること」が含まれます。反応速度は基質の濃度に直接比例するため、選択肢の「濃度に反比例する」という部分は正しくありません。
- Raising the ambient temperature increases the kinetic energy of molecules
これは正しいです。温度を上げると分子の運動エネルギーが増加し、分子同士がより激しく衝突するため、化学反応の速度が上がります。より多くの分子が活性化エネルギーを超えることができるため、反応速度は通常、温度の上昇とともに速くなります。
Ambient temperature(周囲温度) - Rate of reactions is inversely proportional to their concentrations
これは正しくありません。反応速度は一般的に反応物の濃度に正比例します。濃度が高くなるほど、分子同士が衝突する確率が高くなり、それに伴い反応速度も上がります。反応速度が反応物の濃度と逆比例することは通常ありません。
正しい説明:
- 温度の影響: 温度が上がると、分子の運動が活発になり、より多くの分子が活性化エネルギーを超えるため、反応速度が増加します。
- 濃度の影響: 反応物の濃度が高いほど、分子同士が衝突する確率が高くなり、反応速度も速くなります(正比例)。
したがって、反応速度は温度の上昇と反応物濃度の増加に伴って速くなります。
Question 178 of 200
TRUE about the equilibrium constant EXCEPT:
- a) Equilibrium is a dynamic state: there is continual interconversion of the substrates and products.
- b) It is a ratio of the reaction rate constants
- c) At equilibrium, the reaction rates of the forward and back reactions are equal
- d) It is a ratio of the reaction rate
Correct Answer: d) It is a ratio of the reaction rate
Explanation:
a) Equilibrium is a dynamic state: there is continual interconversion of the substrates and products
これは正しいです。平衡状態では、反応物と生成物の変換が継続的に行われており、動的な状態にあります。ただし、反応速度は前進反応と逆反応が等しいため、見かけ上は変化がないように見えます。
b) It is a ratio of the reaction rate constants
これも正しいです。平衡定数 Keqは、前進反応の速度定数 kforwardkと逆反応の速度定数 kreversekの比率として表されます。具体的には、Keq=kforward/kreverseKです。
c) At equilibrium, the reaction rates of the forward and back reactions are equal
これは正しいです。平衡状態では、前進反応と逆反応の速度は等しくなり、システムは見かけ上、反応が進行していないように見えますが、実際には動的平衡状態です。
d) It is a ratio of the reaction rate
これは誤りです。平衡定数は反応速度定数の比率であり、反応速度そのものの比率ではありません。反応速度定数は特定の条件下での反応の傾向を示す定数であり、反応速度そのものとは異なります。
Question 179 of 200
Illustrates the relationship between the initial reaction velocity and substrate concentration:
- a) LINEWEAVER BURK PLOT
- b) MICHEALIS MENTEN EQUATION
- c) HILL PLOT
- d) DIXON PLOT
Correct Answer: b) MICHEALIS MENTEN EQUATION
Explanation:
「ミカエリス・メンテン方程式(Michaelis-Menten equation)」は、初期反応速度と基質濃度の関係を示します。選択肢aの「ラインウェーバー・バークプロット(Lineweaver-Burk plot)」はミカエリス・メンテン方程式の逆数をプロットする方法です。他の選択肢は異なるプロットや方程式を示します。
ミカエリス・メンテン方程式(Michaelis-Menten equation) は、酵素反応の速度と基質濃度の関係を示す数式です。酵素の働きや反応速度を理解するために重要なモデルであり、特に酵素が1つの基質に対して作用する反応に適用されます。
ミカエリス・メンテン方程式:
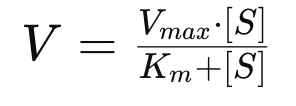
- V = 反応速度(特定の基質濃度での酵素反応の速度)
- Vmax = 反応速度の最大値(酵素が基質で飽和されたときの最大速度)
- [S] = 基質濃度
- Km(ミカエリス定数) = 酵素の基質に対する親和性を表す値(基質濃度がKmであるとき、反応速度が最大速度の半分になる)
ミカエリス・メンテン方程式のポイント:
- 低い基質濃度のとき
基質濃度 [S] が低い場合、反応速度は基質濃度にほぼ比例して増加します。つまり、基質を増やせば反応速度も増加します。 - 高い基質濃度のとき
基質濃度 [S] が非常に高くなると、酵素が飽和し、すべての酵素が基質と結合するため、反応速度は最大速度(Vmax)に達し、これ以上は基質を増やしても反応速度は変化しません。この状態では、酵素が基質を処理できる限界に達していることを意味します。 - Kmの意味
ミカエリス定数(Km)は、酵素が基質に対してどれだけ強く結合するかを示します。Kmが低いほど酵素の基質に対する親和性が高く、Kmが高いほど親和性が低いことを意味します。
ミカエリス・メンテン方程式の応用:
- 酵素の特性を調べる
KmとVmaxを測定することで、酵素の特性を理解できます。例えば、酵素がどのくらい効率的に基質を処理できるか、どの基質が最もよく結合するかを知ることができます。 - 酵素阻害剤の影響を評価する
酵素反応を阻害する薬剤や化学物質がどのように作用するかを理解するためにも、この方程式が使用されます。阻害剤がKmやVmaxにどのような影響を与えるかを見ることで、その阻害剤のメカニズムを解析できます。
Question 180 of 200
Also called the Double-reciprocal plot:
- a) MICHEALIS MENTEN PLOT
- b) HILL PLOT
- c) LINEWEAVER BURK PLOT
- d) DIXON PLOT
Correct Answer: c) LINEWEAVER BURK PLOT
Explanation:
「ダブル・レシプロカル・プロット(Double-reciprocal plot)」は「ラインウェーバー・バークプロット(Lineweaver-Burk plot)」としても知られています。これは、ミカエリス・メンテン方程式の逆数をプロットすることで酵素の動力学を解析する方法です。他の選択肢は異なるプロットや方程式を示します。
Question 181 of 200
Maximum velocity of the reaction:
- a) Km
- b) Vmax
- c) Keg
- d) Vi
Correct Answer: b) Vmax
Explanation:
「Vmax」は反応の最大速度を示します。「Km(ミカエリス定数)」は基質濃度が反応速度の半分になるときの値です。「Keg」や「Vi」は標準的な酵素動力学用語ではありません。
Question 182 of 200
Shows that the rate of the reaction is independent of the substrate concentration:
- a) Zero Order Kinetics
- b) Third Order Kinetics
- c) First Order Kinetics
- d) Second Order Kinetics
Correct Answer: a) Zero Order Kinetics
Explanation:
「ゼロ次反応速度(Zero Order Kinetics)」では、反応速度は基質濃度に依存しません。基質濃度が十分に高いと、反応速度は一定に保たれます。他の選択肢は基質濃度に依存する反応速度を示します。
a) Zero Order Kinetics(ゼロ次反応速度)
ゼロ次反応では、反応速度は基質濃度に依存しません。基質の濃度が高くなり、酵素などの反応に関わるものが飽和状態に達した場合、反応速度は一定に保たれます。例えば、酵素触媒反応では、酵素が完全に飽和している状態では、基質濃度を増やしても反応速度は変わりません。
他の選択肢の解説:
- b) Third Order Kinetics(3次反応)
3次反応では、反応速度は基質濃度の3乗に比例します。つまり、基質濃度に強く依存します。 - c) First Order Kinetics(1次反応)
1次反応では、反応速度は基質濃度に直接比例します。基質濃度が増加すると、反応速度も比例して増加します。 - d) Second Order Kinetics(2次反応)
2次反応では、反応速度は基質濃度の2乗に比例します。これも基質濃度に依存する反応です。
したがって、反応速度が基質濃度に依存しないのは a) Zero Order Kinetics です。
Question 184 of 200
Type of inhibition where inhibitors bind to another location on the enzyme or on the allosteric site:
- a) NONCOMPETITIVE INHIBITION
- b) COMPETITIVE INHIBITION
- c) UNCOMPETITIVE INHIBITION
- d) ALLOSTERIC REGULATION
Correct Answer: a) NONCOMPETITIVE INHIBITION
Explanation:
「非競争的阻害(Noncompetitive Inhibition)」は、酵素の別の部位やアロステリック部位に結合し、基質の結合に影響を与えずに酵素の活性を減少させます。「競争的阻害(Competitive Inhibition)」は活性部位に結合し、「非競争的阻害(Uncompetitive Inhibition)」はES複合体に結合します。「アロステリック調節(Allosteric Regulation)」も酵素のアロステリック部位に結合しますが、より広い意味での調節を指します。
a) NONCOMPETITIVE INHIBITION(非競合阻害)
非競合阻害では、阻害剤が酵素の活性部位とは異なる場所、通常はアロステリック部位(allosteric site)に結合します。これにより、基質が酵素の活性部位に結合していても、酵素の機能が阻害されます。非競合阻害では、基質の濃度を増やしても阻害剤の影響を打ち消すことはできません。
b) COMPETITIVE INHIBITION(競合阻害)
競合阻害では、阻害剤が酵素の活性部位に基質と競合して結合します。この場合、基質の濃度を増やすことで競合阻害を打ち消すことができ、反応速度を回復させることが可能です。
c) UNCOMPETITIVE INHIBITION(不競合阻害)
不競合阻害では、阻害剤が酵素-基質複合体にのみ結合し、基質が結合した後に阻害が起こります。このタイプの阻害は基質の濃度に依存し、基質が結合した状態でのみ発生します。
d) ALLOSTERIC REGULATION(アロステリック調節)
アロステリック調節は、酵素のアロステリック部位に調節分子が結合し、酵素の活性が増強または抑制される現象です。これは必ずしも阻害ではなく、酵素活性を増強することもあります。
Question 185 of 200
Type of inhibition when the inhibitor binds at the ES complex:
- a) UNCOMPETITIVE INHIBITION
- b) COMPETITIVE INHIBITION
- c) ALLOSTERIC REGULATION
- d) NONCOMPETITIVE INHIBITION
Correct Answer: a) UNCOMPETITIVE INHIBITION
Explanation:
「非競争的阻害(Uncompetitive Inhibition)」は、酵素-基質複合体(ES複合体)に結合し、反応速度を減少させます。選択肢bの「競争的阻害(Competitive Inhibition)」は基質の結合部位に結合します。「アロステリック調節(Allosteric Regulation)」はアロステリック部位に結合します。「非競争的阻害(Noncompetitive Inhibition)」は活性部位に結合し、基質濃度に関係なく効果を発揮します。
Question 186 of 200
In Competitive Inhibition, Vmax is:
- a) increased
- b) unchanged
- c) decreased
Correct Answer: b) unchanged
Explanation:
「競争的阻害(Competitive Inhibition)」では、Vmaxは変わりませんが、Km(ミカエリス定数)は増加します。競争的阻害は基質の結合を阻害するものの、最大速度には影響しません。
Competitive Inhibition(競合阻害) では、阻害剤が酵素の活性部位に基質と競合して結合します。この場合、基質の濃度を増やすことで阻害剤との競合を克服できるため、Vmax(最大反応速度) は影響を受けず、変化しません。
- Vmaxは不変: 基質濃度が非常に高くなると、基質が競合阻害剤に打ち勝ち、酵素の全ての活性部位が基質で飽和するため、最終的な反応速度(Vmax)は変わらないままとなります。
- Kmは増加: 一方、基質が阻害剤と競合するため、基質の必要量が増え、Km(ミカエリス定数)は上昇します。これは、基質が反応を起こすためにより高い濃度で存在する必要があることを意味します。
Question 187 of 200
A process that acts as a marker for protein degradation:
- a) SLOW CONTROL
- b) UBIQUITINATION
- c) ALLOSTERIC REGULATION
- d) RAPID CONTROL
Correct Answer: b) UBIQUITINATION
Explanation:
「ユビキチン化(Ubiquitination)」は、タンパク質を分解するためのマーカーとして機能します。選択肢aの「遅延制御(Slow Control)」やdの「迅速制御(Rapid Control)」は、タンパク質の分解とは直接的な関連はありません。選択肢cの「アロステリック調節(Allosteric Regulation)」は酵素の活性に影響を与えますが、分解のマーカーではありません。
Question 188 of 200
Mechanism of enzyme regulation where binding of an effector molecule at a site other than the active site:
- a) ALLOSTERIC REGULATION
- b) COVALENT CATALYSIS
- c) RAPID CONTROL
- d) SLOW CONTROL
Correct Answer: a) ALLOSTERIC REGULATION
Explanation:
「アロステリック調節(Allosteric Regulation)」は、活性部位以外の部位にエフェクタ分子が結合することで酵素の活性が調節されるメカニズムです。選択肢bの「共有結合触媒(Covalent Catalysis)」は触媒作用のメカニズムを指し、選択肢cの「迅速制御(Rapid Control)」やdの「遅延制御(Slow Control)」は調節の速度に関するもので、アロステリック調節とは異なります。
Question 189 of 200
Follow a Sigmoidal curve:
- a) UNCOMPETITIVE INHIBITION
- b) COMPETITIVE INHIBITION
- c) ALLOSTERIC REGULATION
- d) NONCOMPETITIVE INHIBITION
Correct Answer: c) ALLOSTERIC REGULATION
Explanation:
c) ALLOSTERIC REGULATION(アロステリック調節)
アロステリック調節では、酵素の活性部位以外の部位(アロステリック部位)に分子が結合し、酵素の活性を調節します。これにより、酵素の反応速度はシグモイド曲線(S字型の曲線)に従うことが多いです。このような挙動は、アロステリック酵素が協調的(cooperative)な特性を持つ場合によく見られ、酵素のサブユニット間の協力効果によって基質が結合しやすくなったり、結合が難しくなったりします。
他の選択肢の解説:
d) NONCOMPETITIVE INHIBITION(非競合阻害)
非競合阻害では、阻害剤がアロステリック部位に結合しますが、反応速度はシグモイド曲線には従いません。
a) UNCOMPETITIVE INHIBITION(不競合阻害)
不競合阻害では、阻害剤が酵素-基質複合体に結合しますが、反応速度は通常、シグモイド曲線には従いません。
b) COMPETITIVE INHIBITION(競合阻害)
競合阻害では、基質と阻害剤が酵素の活性部位を競合するため、反応速度は通常ミカエリス・メンテンの曲線に従いますが、シグモイド曲線にはなりません。
Question 190 of 200
In Noncompetitive Inhibition, Vmax is:
- a) Unchanged
- b) Decreased
- c) Increased
Correct Answer: b) Decreased
Explanation:
「非競争的阻害(Noncompetitive Inhibition)」では、Vmaxが減少します。これは、酵素の活性部位以外に結合することで、最大反応速度を減少させるからです。Kmは変わりません。
Question 193 of 200
In Uncompetitive inhibition, Km is:
- a) Unchanged
- b) Decreased
- c) Increased
Correct Answer: b) Decreased
Explanation:
「非競争的阻害(Uncompetitive Inhibition)」では、Kmも減少します。これは、酵素-基質複合体の安定化により、基質の結合親和性が増すためです。
PPTからの問題(自作)
1.
Which of the following enzymes catalyzes oxidation-reduction reactions?
A) Ligase
B) Transferase
C) Oxidoreductase
D) Hydrolase
Answer: C) Oxidoreductase
Explanation:
酸化還元酵素(Oxidoreductases)は、酸化還元反応を触媒します。この反応では、一方の分子が電子を失う(酸化される)一方、別の分子がその電子を受け取ります(還元される)。例えば、脱水素酵素(dehydrogenases)はこのプロセスで重要な役割を果たし、NAD⁺やFADといった補酵素を使って電子を運搬します。
他の選択肢が間違っている理由:
- Ligase: ATPを使って分子を結合させる反応を触媒する酵素。酸化還元には関与しません。
- Transferase: 基質間で化学基を移動させる酵素。酸化還元には直接関与しません。
- Hydrolase: 水分子を使って結合を切断する酵素。酸化還元反応は行いません。
2.
What type of enzyme transfers a functional group from one molecule to another?
A) Lyase
B) Isomerase
C) Hydrolase
D) Transferase
Answer: D) Transferase
Explanation:
転移酵素(Transferases)は、メチル基、リン酸基などの官能基(Functional Group)を一つの分子から別の分子に移動させます。例えば、キナーゼ(Kinases)はリン酸基をATPから別の分子へ転移させる酵素です。このような基の移動は、細胞内のさまざまな信号伝達や代謝経路において重要です。
他の選択肢が間違っている理由:
- Lyase: 分子内で化学結合を切断または形成するが、通常は酸化還元反応や加水分解ではない。
- Isomerase: 分子内で原子や基の配置を変える酵素で、基を別の分子に移動させることはない。
- Hydrolase: 加水分解酵素は水分子を使って結合を切断するが、基を移動させるわけではない。
3.
Which enzyme breaks down peptide bonds using water?
A) Hydrolase
B) Isomerase
C) Ligase
D) Oxidoreductase
Answer: A) Hydrolase
Explanation:
加水分解酵素(Hydrolases)は水分子を使用して化学結合を切断します。プロテアーゼ(Proteases)はペプチド結合を分解する代表的な加水分解酵素です。ペプチド結合はアミノ酸同士をつなぐもので、消化やタンパク質分解において重要な役割を果たします。
他の選択肢が間違っている理由:
- Isomerase: 異性化酵素は化学結合を切断することはなく、分子内の配置を変えるだけです。
- Ligase: リガーゼはATPを使って分子同士を結合させます。切断には関与しません。
- Oxidoreductase: 酸化還元反応を触媒しますが、ペプチド結合や加水分解には関与しません。
4.
What is the function of isomerases?
A) Add water to break bonds
B) Transfer protons
C) Rearrange atoms within a molecule
D) Form new bonds between molecules
Answer: C) Rearrange atoms within a molecule
Explanation:
異性化酵素(Isomerases)は、分子内の原子の配置を変更して異性体(Isomers)を作り出します。例えば、グルコースをフルクトースに変換するような反応です。異性体の生成は、基質の化学構造をわずかに変更することで、異なる生理的機能を持つ分子を作り出します。
他の選択肢が間違っている理由:
- Add water to break bonds: これは加水分解酵素の機能であり、異性化には該当しません。
- Transfer protons: プロトンの移動は酸塩基触媒や酸化還元反応で見られるものです。異性化反応には直接関与しません。
- Form new bonds between molecules: これはリガーゼの機能であり、異性化とは異なります。
5.
Which enzyme class is responsible for creating new bonds between molecules using ATP?
A) Lyase
B) Ligase
C) Hydrolase
D) Oxidoreductase
Answer: B) Ligase
Explanation:
リガーゼ(Ligases)は、ATPを使用して新しい化学結合を形成する酵素です。ATPのエネルギーを利用して、二つの分子を結合させる反応を行います。例えば、DNAリガーゼはDNAの断片を結合させる酵素として知られています。
他の選択肢が間違っている理由:
- Lyase: リアーゼはATPを使わずに分子内の結合を切断します。
- Hydrolase: 加水分解酵素は水を使って結合を切断しますが、ATPは使用しません。
- Oxidoreductase: 酸化還元酵素はATP加水分解に関与しません。
6.
What type of enzyme is lactate dehydrogenase (LDH)?
A) Ligase
B) Hydrolase
C) Oxidoreductase
D) Isomerase
Answer: C) Oxidoreductase
Explanation:
乳酸脱水素酵素(Lactate Dehydrogenase, LDH)は酸化還元酵素の一種で、乳酸をピルビン酸に変換する際にNAD⁺を使用して電子を運搬します。このプロセスは酸化還元反応の典型的な例です。LDHは、心筋梗塞や肝機能障害などの診断マーカーとしても重要です。
他の選択肢が間違っている理由:
- Ligase: LDHは結合形成には関与しません。
- Hydrolase: LDHは加水分解を行いません。
- Isomerase: LDHは異性化反応を行いません。
7.
Which of the following enzymes catalyzes the removal of CO2 from amino acids?
A) Carboxylase
B) Decarboxylase
C) Oxidase
D) Kinase
Answer: B) Decarboxylase
Explanation:
脱炭酸酵素(Decarboxylase)は、アミノ酸などの分子からCO2を除去する反応を触媒します。これにより、カルボキシル基が除去され、アミノ酸がよりシンプルな分子に変換されます。例えば、グルタミン酸脱炭酸酵素はグルタミン酸からCO2を除去してGABAを生成します。
他の選択肢が間違っている理由:
- Carboxylase: 逆にCO2を分子に追加する酵素です。
- Oxidase: 酸化酵素であり、酸素を使って酸化反応を進めます。CO2の除去には関与しません。
- Kinase: リン酸基を移動させる酵素です。
8.
In the diagnosis of myocardial infarction, which enzyme is specifically used to detect heart damage?
A) LDH-1
B) CK-MB
C) Amylase
D) LDH-5
Answer: B) CK-MB
Explanation:
CK-MB(クレアチンキナーゼMB型)は心筋に特異的な酵素であり、急性心筋梗塞(AMI)の診断において重要です。心筋細胞が損傷すると、CK-MBが血液中に放出され、そのレベルが急激に上昇します。
他の選択肢が間違っている理由:
- LDH-1: 心臓の損傷も示しますが、CK-MBの方がより特異的です。
- Amylase: これは消化酵素であり、心筋損傷には関与しません。
- LDH-5: 肝臓に特異的であり、心筋梗塞の指標としては使われません。
9.
Which of the following is an apoenzyme?
A) An enzyme with a bound cofactor
B) An enzyme without its cofactor
C) An enzyme bound to its substrate
D) A catalytically inactive enzyme
Answer: B) An enzyme without its cofactor
Explanation:
アポ酵素(Apoenzyme)は、補因子を欠いているため、まだ完全には活性化されていない酵素です。補因子が結合すると、ホロ酵素(Holoenzyme)となり、触媒活性を持つようになります。
他の選択肢が間違っている理由:
- An enzyme with a bound cofactor: これはホロ酵素の説明です。
- An enzyme bound to its substrate: 基質結合は触媒過程の一部ですが、アポ酵素ではありません。
- A catalytically inactive enzyme: 補因子を欠くため、触媒的に不活性ですが、この選択肢は一般的すぎます。
**Apoenzyme(アポ酵素)**の「apo」の語源は、ギリシャ語の「ἀπό (apo)」で、これは「離れて」や「分離して」という意味を持ちます。
**Holoenzyme(ホロ酵素)**の「holo」の語源は、ギリシャ語の「ὅλος (holos)」で、これは「全体」や「完全な」という意味を持ちます。
10.
Which model explains enzyme flexibility upon substrate binding?
A) Lock and Key Model
B) Induced Fit Model
C) Transition State Theory
D) Allosteric Model
Answer: B) Induced Fit Model
Explanation:
誘導適合モデル(Induced Fit Model)では、酵素は基質と結合することでその形状が変化し、基質により密接に結合するようになります。これにより、反応が進行しやすくなります。ロック&キー理論(Lock and Key Theory)では、酵素の活性部位は事前に固定された形状を持ちますが、誘導適合モデルでは柔軟性が強調されます。
他の選択肢が間違っている理由:
- Lock and Key Model: このモデルでは酵素の形は固定されており、基質とぴったり一致する必要があります。
- Transition State Theory: 遷移状態の安定化に焦点を当てた理論ですが、酵素の柔軟性については言及していません。
- Allosteric Model: アロステリック部位での調節に関するモデルであり、基質結合のメカニズムを説明するものではありません。
11.
What stabilizes the enzyme-substrate complex in enzyme catalysis?
A) Protons
B) Transition State Stabilization
C) Water molecules
D) ATP hydrolysis
Answer: B) Transition State Stabilization
Explanation:
酵素触媒反応において、酵素は基質が反応途中で形成する「遷移状態」(Transition State)を安定化させます。遷移状態は、基質が生成物に変換される前の最も不安定な状態で、エネルギー的に高い場所にあります。酵素はこの状態を安定化することで、反応の活性化エネルギーを下げ、反応をより早く進行させます。
他の選択肢が間違っている理由:
- Protons: 酵素がプロトンの移動を触媒することはありますが、遷移状態の安定化とは異なるプロセスです。
- Water molecules: 水は加水分解反応で使われますが、遷移状態の安定化には関与しません。
- ATP hydrolysis: ATPの加水分解は結合を形成する際に使用されますが、遷移状態の安定化には関与しません。
12.
Which LDH isoform is found predominantly in the liver?
A) LDH-1
B) LDH-2
C) LDH-4
D) LDH-5
Answer: D) LDH-5
Explanation:
LDH(乳酸脱水素酵素)は5つのアイソフォームを持ち、異なる臓器で発現しています。LDH-5は肝臓(Liver)に特異的で、肝機能障害や肝細胞損傷のマーカーとして使用されます。他のLDHアイソフォームは異なる臓器に特異的です。
他の選択肢が間違っている理由:
- LDH-1: 主に心臓(Heart)や赤血球に存在します。
- LDH-2: 主に網内系(Reticuloendothelial System)に存在します。
- LDH-4: 主に腎臓と胎盤に存在します。
13.
Which enzyme transfers phosphate groups in phosphorylation reactions?
A) Phosphatase
B) Phosphorylase
C) Kinase
D) Hydrolase
Answer: C) Kinase
Explanation:
キナーゼ(Kinases)はリン酸基を他の分子に転移させる酵素(転移酵素 (Transferases))で、特にATPからリン酸基を他の基質に付加することが多いです。リン酸化は、細胞シグナル伝達や代謝調節において非常に重要です。
他の選択肢が間違っている理由:
- Phosphatase: リン酸基を除去する酵素で、リン酸化反応を逆行させます。
- Phosphorylase: 無機リン酸を使って結合を切断する酵素で、糖代謝に関与します。
- Hydrolase: 水を使用して化学結合を切断する加水分解酵素です。
14.
Which enzyme mechanism involves the transfer of protons to speed up the reaction?
A) Covalent Catalysis
B) Acid-Base Catalysis
C) Proximity Catalysis
D) Lock and Key Model
Answer: B) Acid-Base Catalysis
Explanation:
酸塩基触媒(Acid-Base Catalysis)では、酵素がプロトン(H⁺)の移動を促進することで反応を加速します。例えば、酵素が酸として作用し、プロトンを供与することで基質を活性化する場合があります。また、酵素が塩基として作用してプロトンを受け取ることで反応を促進することもあります。
他の選択肢が間違っている理由:
- Covalent Catalysis: 共有結合を形成する触媒であり、プロトンの移動には直接関与しません。
- Proximity Catalysis: 基質を酵素の活性部位に近づけて反応を促進する触媒です。
- Lock and Key Model: 酵素と基質がぴったりと合うモデルで、触媒メカニズムではなく結合のモデルです。
15.
Which enzyme is involved in the oxidation of alcohols to aldehydes?
A) Dehydrogenase
B) Carboxylase
C) Phosphorylase
D) Ligase
Answer: A) Dehydrogenase
Explanation:
脱水素酵素(Dehydrogenase)は、酸化還元反応を触媒し、アルコールを酸化してアルデヒドを生成します。たとえば、アルコール脱水素酵素(Alcohol Dehydrogenase)はエタノールをアセトアルデヒドに変換する重要な酵素です。
他の選択肢が間違っている理由:
- Carboxylase: CO₂を結合させる反応を触媒しますが、酸化反応には関与しません。
- Phosphorylase: 糖や他の分子にリン酸を付加する反応を触媒しますが、酸化反応には関与しません。
- Ligase: ATPを使って分子を結合させますが、酸化には関与しません。
16.
Which of the following enzymes participates in ATP hydrolysis during bond formation?
A) Lyase
B) Ligase
C) Transferase
D) Isomerase
Answer: B) Ligase
Explanation:
リガーゼ(Ligases)はATPを加水分解してエネルギーを供給し、二つの分子を結合させる反応を触媒します。これにより、DNAリガーゼなどがDNA鎖の断片を結合する役割を果たします。
他の選択肢が間違っている理由:
- Lyase: 化学結合を切断しますが、ATPの加水分解には関与しません。
- Transferase: 基を移動させる反応を触媒しますが、ATP加水分解は行いません。
- Isomerase: 分子内の原子配置を変化させるが、ATPの加水分解は行いません。
17.
Which is a holoenzyme?
A) Enzyme without a cofactor
B) Enzyme with an inhibitor
C) Enzyme with a cofactor
D) Inactive enzyme
Answer: C) Enzyme with a cofactor
Explanation:
ホロ酵素(Holoenzyme)は、酵素(アポ酵素)が補因子(Cofactor)と結合して活性を持つ完全な酵素です。補因子がない状態の酵素はアポ酵素(Apoenzyme)と呼ばれ、触媒活性を持ちません。
他の選択肢が間違っている理由:
- Enzyme without a cofactor: これはアポ酵素の定義です。
- Enzyme with an inhibitor: 阻害剤が結合していると、酵素の活性は抑制されますが、それはホロ酵素ではありません。
- Inactive enzyme: ホロ酵素は活性を持つため、酵素が不活性である場合はホロ酵素ではありません。
18.
Which enzyme breaks down triglycerides into fatty acids and glycerol?
A) Lipase
B) Protease
C) Amylase
D) Kinase
Answer: A) Lipase
Explanation:
リパーゼ(Lipase)は、トリグリセリドを脂肪酸とグリセロールに加水分解する酵素です。脂質の消化や代謝において重要な役割を果たし、主に膵臓から分泌されます。
他の選択肢が間違っている理由:
- Protease: タンパク質をペプチドやアミノ酸に分解する酵素です。
- Amylase: デンプンを糖に分解する酵素です。
- Kinase: リン酸基を転移させる酵素であり、脂質の分解には関与しません。
19.
Which model of enzyme activity emphasizes a rigid active site?
A) Lock and Key Model
B) Induced Fit Model
C) Allosteric Model
D) Acid-Base Catalysis
Answer: A) Lock and Key Model
Explanation:
ロック&キー理論(Lock and Key Model)は、酵素の活性部位が事前に固定された形状を持っており、基質がその形にぴったり合うというモデルです。このモデルは、酵素が厳密な特異性を持つことを説明しますが、後に誘導適合モデル(Induced Fit Model)が提唱され、酵素の柔軟性が強調されました。
他の選択肢が間違っている理由:
- Induced Fit Model: 酵素が基質と結合する際に形状を変化させることを説明するモデルです。
- Allosteric Model: アロステリック部位に結合した分子が酵素の活性を調節するモデルで、活性部位の形状には直接関係ありません。
- Acid-Base Catalysis: 酸塩基反応を促進するメカニズムで、結合モデルではありません。
20.
What does LDH-1 primarily indicate when elevated in serum?
A) Liver damage
B) Heart damage
C) Muscle damage
D) Lung damage
Answer: B) Heart damage
Explanation:
LDH-1(乳酸脱水素酵素アイソフォーム1)は心臓に特異的であり、血清中でその濃度が上昇している場合、心筋損傷、特に急性心筋梗塞(AMI)を示唆します。LDHは組織損傷の指標として使用されますが、アイソフォームによって異なる臓器の損傷を示します。
他の選択肢が間違っている理由:
- Liver damage: LDH-5が肝臓の損傷を示します。
- Muscle damage: 骨格筋の損傷は主にLDH-3とLDH-4が関与します。
- Lung damage: LDH-3が肺の損傷を示します。
酵素補足(熱法則、エンタルピー、プロテオリティック活性化)
Question 1:
Which of the following best describes enthalpy (H)?
a) The measure of disorder in a system
b) The total energy of a system, including internal energy and pressure-volume work
c) The energy available for work in a system
d) The energy required to break bonds in a chemical reaction
Answer: b) The total energy of a system, including internal energy and pressure-volume work
解説:
エンタルピー (Enthalpy, H) は、システムの内部エネルギー (Internal Energy, U) と圧力 (P) と体積 (V) を考慮した総エネルギーです。選択肢aの「無秩序の測定」はエントロピー (Entropy) に関連し、選択肢cは自由エネルギーに関するもので、選択肢dは反応に必要な結合エネルギーに関するものです。
Question 2:
Which of the following statements is true about the second law of thermodynamics?
a) Energy can neither be created nor destroyed
b) The entropy of an isolated system always increases
c) At absolute zero, the entropy of a perfect crystal is zero
d) All systems tend to move towards lower entropy
Answer: b) The entropy of an isolated system always increases
解説:
第二法則では、孤立系のエントロピー (Entropy) は常に増加することが述べられています。選択肢aは第一法則、選択肢cは第三法則に関係しています。選択肢dは誤解であり、システムはエントロピーが増加する方向に進むことが一般的です。
| 法則名 | 概要 |
|---|---|
| 第零法則(Zeroth Law) | 2つの物体が熱的平衡状態にある場合、それらの温度は同じです。熱の流れがない場合、熱的平衡にあります。 |
| 第一法則(First Law) | 閉じたシステムの内部エネルギーの変化は、供給された熱量から行った仕事を差し引いたものです。エネルギー保存の法則。 |
| 第二法則(Second Law) | 孤立系のエントロピーは常に増加します。宇宙全体のエントロピーは増加し、減少しません(エントロピー増大の法則)。 |
| 第三法則(Third Law) | 物体の温度が絶対零度に近づくと、そのエントロピーは一定の値に近づきます。 |
Question 3:
What does a positive change in enthalpy (ΔH > 0) indicate?
a) The system releases energy to its surroundings
b) The system absorbs energy from its surroundings
c) The system does not exchange energy with its surroundings
d) The system is at thermal equilibrium
Answer: b) The system absorbs energy from its surroundings
解説:
正のエンタルピー変化 (ΔH > 0) は、吸熱反応 (Endothermic Reaction) に相当し、システムが周囲からエネルギーを吸収することを示します。選択肢aは発熱反応、選択肢cはエネルギーの交換がない状態、選択肢dは熱平衡を示しますが、これらはΔH > 0の説明には当てはまりません。
Question 4:
In an exothermic reaction, what can be said about the enthalpy change (ΔH)?
a) ΔH is positive
b) ΔH is negative
c) ΔH is zero
d) ΔH can either be positive or negative
Answer: b) ΔH is negative
解説:
発熱反応 (Exothermic Reaction) では、エネルギーが周囲に放出されるため、エンタルピー変化 (ΔH) は負の値を取ります。選択肢aは吸熱反応の説明、選択肢cはエネルギーの出入りがない状態、選択肢dは誤りです。
Question 5:
Which law of thermodynamics explains the conservation of energy?
a) Zeroth law
b) First law
c) Second law
d) Third law
Answer: b) First law
解説:
第一法則 (First Law of Thermodynamics) は、エネルギー保存の法則 (Law of Conservation of Energy) を説明し、孤立系のエネルギーは常に保存され、形を変えるだけであると述べています。選択肢aは熱的平衡に関する法則、選択肢cはエントロピーの増大、選択肢dは絶対零度に近づくときのエントロピーに関する法則です。
Question 6:
Which of the following describes the third law of thermodynamics?
a) Energy can be transferred but not created or destroyed
b) The entropy of an isolated system increases over time
c) As temperature approaches absolute zero, the entropy of a system approaches a constant minimum
d) Two objects in thermal equilibrium have the same temperature
Answer: c) As temperature approaches absolute zero, the entropy of a system approaches a constant minimum
解説:
第三法則 (Third Law of Thermodynamics) では、物体が絶対零度に近づくと、エントロピーが一定の最小値に近づくとされています。選択肢aは第一法則、選択肢bは第二法則、選択肢dは第零法則に関係しています。
Question 7:(へモ)
Which factor stabilizes deoxygenated hemoglobin by forming additional salt bridges?
a) Oxygen
b) Carbon dioxide
c) 2,3-Bisphosphoglycerate (BPG)
d) Hydrogen ions (H+)
Answer: c) 2,3-Bisphosphoglycerate (BPG)
解説:
2,3-BPGは酸素の結合がないヘモグロビン(脱酸素ヘモグロビン)を安定化し、塩橋を形成します。酸素は酸素化ヘモグロビンを安定化し、二酸化炭素とH+はボーア効果を通じて酸素解離に関与しますが、塩橋形成には直接関与しません。
Question 8:(へモ)
Which of the following processes is irreversible in the body?
a) Activation of zymogens
b) Phosphorylation of proteins
c) Binding of ligands to receptors
d) Hemoglobin oxygenation
Answer: a) Activation of zymogens
解説:
プロ酵素(Zymogen)のプロテオリティック活性化は生理的に不可逆的であり、一度活性化されるとその酵素は持続的に働きます。選択肢bやcは可逆的な過程であり、選択肢dの酸素化も可逆的です。
Question 9:
Which of the following represents the change in entropy during a reaction?
a) ΔH
b) ΔG
c) ΔS
d) ΔU
Answer: c) ΔS
解説:
ΔSはエントロピー (Entropy) の変化を示します。ΔHはエンタルピー、ΔGは自由エネルギー、ΔUは内部エネルギーの変化を示すため、それぞれ間違いです。
Question 10:
The term “enthalpy” refers to which of the following?
a) The disorder of a system
b) The internal energy of a system at constant volume
c) The total heat content of a system
d) The temperature change of a system
Answer: c) The total heat content of a system
解説:
エンタルピー (Enthalpy, H) はシステムの総熱量を表します。選択肢aはエントロピー、選択肢bは内部エネルギー、選択肢dはエンタルピーとは異なる概念です。
Question 11:
Which of the following is an example of an exothermic reaction?
a) Ice melting
b) Combustion of methane
c) Evaporation of water
d) Photosynthesis
Answer: b) Combustion of methane
解説:
メタンの燃焼 (Combustion of methane) は発熱反応 (Exothermic Reaction) の代表例で、エネルギーが周囲に放出されます。選択肢aの氷の融解や選択肢cの水の蒸発、選択肢dの光合成はすべて吸熱反応 (Endothermic Reactions) であり、エネルギーが周囲から吸収されます。
Question 12:
What is the term used for the internal energy change of a system plus the product of its pressure and volume?
a) Entropy
b) Free energy
c) Enthalpy
d) Heat capacity
Answer: c) Enthalpy
解説:
エンタルピー (Enthalpy, H) は、システムの内部エネルギー (U) と、圧力 (P) と体積 (V) の積を足したもので表されます。選択肢aのエントロピーは無秩序の度合いを示し、選択肢bの自由エネルギーは系のエネルギーを仕事に変える能力を示し、選択肢dの熱容量は物質が熱を吸収する能力を指します。
Question 13:(へモ)
Which of the following conditions would shift the hemoglobin-oxygen dissociation curve to the right?
a) Decrease in pH
b) Decrease in CO2 levels
c) Decrease in temperature
d) Increase in oxygen affinity
Answer: a) Decrease in pH
解説:
pHの低下はヘモグロビン酸素解離曲線を右にシフトさせ、酸素親和性が低下します。これはボーア効果 (Bohr Effect) と呼ばれます。選択肢bのCO2レベルの低下や選択肢cの温度の低下は左シフトを引き起こし、選択肢dも右シフトとは逆の効果です。
Question 14:
What does the second law of thermodynamics state about entropy in a closed system?
a) Entropy remains constant
b) Entropy tends to increase
c) Entropy tends to decrease
d) Entropy can increase or decrease depending on conditions
Answer: b) Entropy tends to increase
解説:
第二法則は、孤立系のエントロピーが自然に増加することを述べています。選択肢aのエントロピーが一定になるのは理想的な状況であり、選択肢cのエントロピーの減少は自然には起こりません。選択肢dも誤りです。
Question 15:(へモ)
Which of the following molecules is responsible for the proteolytic activation of trypsinogen?
a) Pepsin
b) 2,3-BPG
c) Enterokinase
d) Carbonic anhydrase
Answer: c) Enterokinase
解説:
エンテロキナーゼ (Enterokinase) は、トリプシノーゲンをトリプシンに活性化する役割を果たします。選択肢aのペプシンはペプシノーゲンを活性化し、選択肢bの2,3-BPGはヘモグロビンの酸素親和性に関与し、選択肢dの炭酸脱水酵素 (Carbonic anhydrase) は二酸化炭素の変換に関与します。
Question 16:
Which of the following is a characteristic of the first law of thermodynamics?
a) Heat flows from a hotter to a colder body
b) The total energy of an isolated system is constant
c) Entropy of a system never decreases
d) The entropy of a perfect crystal is zero at absolute zero
Answer: b) The total energy of an isolated system is constant
解説:
第一法則では、孤立系のエネルギーは保存され、一定であると述べられています。選択肢aは熱の流れの法則に関連し、選択肢cは第二法則、選択肢dは第三法則に関係しています。
Question 17:(へモ)
Which of the following processes occurs in a reversible manner?
a) Activation of zymogens
b) Binding of oxygen to hemoglobin
c) Proteolytic activation of trypsinogen
d) Myoglobin release during muscle injury
Answer: b) Binding of oxygen to hemoglobin
解説:
酸素のヘモグロビンへの結合と解離は可逆的なプロセスです。選択肢aやcのプロテオリティック活性化は不可逆的であり、選択肢dは筋損傷時のミオグロビンの放出であり、可逆的なプロセスではありません。
Question 18:(へモ)
What is the result of an increase in 2,3-BPG on hemoglobin’s oxygen affinity?
a) Increases oxygen affinity
b) Decreases oxygen affinity
c) No effect on oxygen affinity
d) Increases oxygen affinity in the lungs but decreases in tissues
Answer: b) Decreases oxygen affinity
解説:
2,3-BPGの増加はヘモグロビンの酸素親和性を低下させ、酸素が組織に放出されやすくなります。選択肢aは逆の効果であり、選択肢cは誤りです。選択肢dも、同時に両方の効果が現れることはありません。
Question 19:
Which law of thermodynamics describes the relationship between two systems in thermal equilibrium with a third system?
a) First law
b) Second law
c) Third law
d) Zeroth law
Answer: d) Zeroth law
解説:
第零法則 (Zeroth Law of Thermodynamics) は、3つのシステムが熱的平衡状態にある場合、それらの温度が等しいことを述べています。選択肢aはエネルギー保存、選択肢bはエントロピー、選択肢cは絶対零度に関する法則です。
Question 20:
Which of the following correctly describes a spontaneous process in thermodynamics?
a) A process with ΔH > 0 and ΔS > 0
b) A process with ΔH < 0 and ΔS > 0
c) A process with ΔH > 0 and ΔS < 0
d) A process with ΔH < 0 and ΔS < 0
Answer: b) A process with ΔH < 0 and ΔS > 0
解説:
自発的プロセスは一般的にエンタルピーが減少し (ΔH < 0)、エントロピーが増加する (ΔS > 0) 状況で起こります。選択肢aやcのΔHが正の場合は、エネルギーが吸収されるため自発的ではなく、選択肢dはエントロピーが減少するために自発的ではありません。
自作:補足(Gエナジー、遅い早い制御)
Question 1:
What does a negative ΔG indicate about a chemical reaction?
a. The reaction is nonspontaneous.
b. The reaction is at equilibrium.
c. The reaction is spontaneous.
d. The reaction is reversible.
Answer: c. The reaction is spontaneous.
解説: ΔGが負の値を示す場合、その反応は自発的に進行することを意味します。つまり、エネルギーが放出されて反応が自然に進む傾向にあります。反対に、ΔGが正の値を示す場合、その反応は自発的ではなく、エネルギーを外部から供給する必要があります。選択肢aは、ΔGが正の値の場合に該当し、選択肢bは、ΔGが0のときに平衡状態にあることを示します。選択肢dの「reversible(可逆)」は、反応の方向性ではなく、その反応が進むかどうかに直接関係しません。
Question 2:
Which of the following factors would decrease the value of ΔG in a reaction?
a. Increasing enthalpy (ΔH).
b. Increasing entropy (ΔS).
c. Decreasing temperature (T).
d. Decreasing entropy (ΔS).
Answer: b. Increasing entropy (ΔS).
解説: ΔG = ΔH – TΔSの式において、エントロピー(ΔS)が増加すると、TΔSの値が大きくなり、ΔGの値が減少します。したがって、反応はより自発的になる傾向があります。選択肢aのエンタルピーが増加するとΔGは増加し、反応は非自発的になる可能性があります。選択肢cの温度を下げるとTΔSの影響が減少し、ΔGの減少が抑えられます。選択肢dのエントロピーの減少はΔGを増加させ、反応は非自発的になる方向に進みます。
Question 3:
At equilibrium, what is the value of ΔG?
a. Positive
b. Negative
c. Zero
d. Undefined
Answer: c. Zero
解説: 化学反応が平衡状態にある場合、ΔGの値は0です。この状態では、反応が前方にも後方にも進行せず、反応物と生成物の濃度は一定です。選択肢aの「positive」は非自発的な反応を、選択肢bの「negative」は自発的な反応を意味します。選択肢dの「undefined(未定義)」は誤りです。
Question 4:
In an enzyme-catalyzed reaction, which step is usually the rate-limiting step?
a. Substrate binding to the enzyme.
b. Product release from the enzyme.
c. Formation of the enzyme-substrate complex.
d. Conversion of the enzyme-substrate complex to the product.
Answer: d. Conversion of the enzyme-substrate complex to the product.
解説: 酵素触媒反応において、律速段階は通常、酵素-基質複合体(ES Complex)が生成物に変換される過程(k₂)です。これは反応全体の速度を決定するステップです。選択肢aやcは酵素-基質複合体の形成に関連し、これらは比較的速く進行します。選択肢bの生成物の放出は、最終的な段階であり、律速段階ではありません。
Question 5:
Which of the following statements is true regarding the Gibbs Free Energy of a reaction?
a. It determines the reaction rate.
b. It is independent of the reaction mechanism.
c. It provides information on the reaction intermediates.
d. It is not related to the reaction direction.
Answer: b. It is independent of the reaction mechanism.
解説: ギブス自由エネルギーは、反応の進行方向や平衡状態についての情報を提供しますが、反応速度や反応のメカニズム(途中で発生する中間体など)には関与しません。選択肢aの反応速度は、ギブス自由エネルギーではなく、反応の活性化エネルギーに依存します。選択肢cは、反応メカニズムに依存するため誤りです。選択肢dも誤りで、ΔGは反応の進行方向に密接に関係しています。
Question 6:
If the equilibrium constant (Keq) of a reaction is greater than 1, what does this indicate?
a. The reaction favors the formation of reactants.
b. The reaction favors the formation of products.
c. The reaction is at equilibrium.
d. The reaction has a positive ΔG.
Answer: b. The reaction favors the formation of products.
解説: Keq > 1の場合、生成物の濃度が反応物の濃度よりも高いことを示し、反応が生成物の生成に有利であることを意味します。選択肢aの反応物が優位になるのはKeq < 1の場合です。選択肢cは、Keqが1に近い場合に当てはまります。選択肢dの「positive ΔG」はKeqが1未満の時に関連するため誤りです。
Question 7:
Which of the following modifications is an example of covalent enzyme regulation?
a. Phosphorylation
b. Allosteric inhibition
c. Competitive inhibition
d. Noncompetitive inhibition
Answer: a. Phosphorylation
解説: 共有結合修飾の例として、リン酸化(phosphorylation)は酵素活性を制御する一つの方法です。これにより、酵素が活性化されたり不活性化されたりします。選択肢bのアロステリック阻害(allosteric inhibition)は、酵素の別の部位に分子が結合することで活性が調整されますが、これは共有結合修飾とは異なります。選択肢cとdは酵素の阻害様式であり、共有結合修飾に関与しません。
Question 8:
Which parameter is essential for determining the spontaneity of a reaction?
a. ΔH only
b. ΔS only
c. Both ΔH and ΔS
d. Keq
Answer: c. Both ΔH and ΔS
解説: 反応の自発性を決定するためには、ΔH(エンタルピー変化)とΔS(エントロピー変化)の両方が必要です。これらの値はギブス自由エネルギーの式ΔG = ΔH – TΔSを通じて自発性に影響を与えます。選択肢aやbは一部の情報しか提供しません。選択肢dのKeqは反応の平衡状態に関する情報を提供しますが、自発性には直接関与しません。
Question 9:
What is the main role of the enzyme-substrate complex (ES complex) in a reaction?
a. It decreases the activation energy of the reaction.
b. It increases the equilibrium constant of the reaction.
c. It provides energy for the reaction to proceed.
d. It prevents the formation of products.
Answer: a. It decreases the activation energy of the reaction.
解説: 酵素-基質複合体(ES Complex)は、反応の活性化エネルギーを減少させることで、反応を速やかに進行させる役割を果たします。これにより、酵素反応が効率的に進行します。選択肢bの平衡定数(Keq)は、反応の進行度を示しますが、酵素がそれを直接変化させるわけではありません。選択肢cの反応に必要なエネルギーは、酵素ではなく基質から供給されます。選択肢dは誤りで、酵素は生成物の形成を助けます。
Question 10:
What does a higher value of the equilibrium constant (Keq) suggest about a reaction?
a. The reaction is nonspontaneous.
b. The formation of reactants is favored.
c. The formation of products is favored.
d. The reaction rate is increased.
Answer: c. The formation of products is favored.
解説: Keqの値が大きい場合、生成物の生成が優勢であることを意味します。生成物が反応物よりも多く生成される反応において、Keqは1を超える傾向があります。選択肢aの非自発的反応は、Keqが1未満の場合に関連します。選択肢bは反応物の生成が優勢な場合に当てはまりますが、これはKeq < 1の時です。選択肢dはKeqが反応速度に直接影響することを示していません。
Question 11:
Which factor does not affect the Gibbs Free Energy (ΔG) of a reaction?
a. Enthalpy (ΔH)
b. Entropy (ΔS)
c. Temperature (T)
d. Enzyme concentration
Answer: d. Enzyme concentration
解説: ギブス自由エネルギー(ΔG)は、エンタルピー(ΔH)、エントロピー(ΔS)、温度(T)に依存します。これらの値が反応の自発性や進行方向を決定しますが、酵素濃度はΔGに影響を与えません。選択肢a、b、cはすべてΔGに直接影響を与える要因です。酵素は反応の速度を変える役割を果たしますが、反応のエネルギー自体には関与しません。
Question 12:
What is the relationship between Gibbs Free Energy (ΔG) and the equilibrium constant (Keq)?
a. When ΔG is negative, Keq is less than 1.
b. When ΔG is positive, Keq is greater than 1.
c. When ΔG is zero, Keq is equal to 1.
d. When ΔG is negative, Keq is equal to zero.
Answer: c. When ΔG is zero, Keq is equal to 1.
解説: ギブス自由エネルギーがゼロ(ΔG = 0)の場合、反応は平衡状態にあり、平衡定数(Keq)は1です。これは、反応物と生成物の濃度が等しいことを示します。選択肢aとbは誤りで、ΔGが負の時にはKeqが1より大きく、ΔGが正の時にはKeqが1未満になります。選択肢dは誤りで、Keqが0の場合、反応は進行しません。
Question 13:
Which of the following statements is correct regarding enzyme-catalyzed reactions?
a. Enzymes alter the equilibrium constant (Keq).
b. Enzymes lower the activation energy of the reaction.
c. Enzymes increase the Gibbs Free Energy of the reaction.
d. Enzymes make nonspontaneous reactions spontaneous.
Answer: b. Enzymes lower the activation energy of the reaction.
解説: 酵素は反応の活性化エネルギーを低下させることで、反応が速やかに進行するように助けます。しかし、KeqやΔGには影響を与えず、非自発的な反応を自発的に変えることもありません。選択肢aの平衡定数は酵素の影響を受けません。選択肢cとdは酵素の役割とは異なるため誤りです。
Question 14:
Which of the following conditions would lead to a negative ΔG?
a. High enthalpy (ΔH) and low entropy (ΔS).
b. Low enthalpy (ΔH) and high entropy (ΔS).
c. Low temperature and low entropy (ΔS).
d. High enthalpy (ΔH) and high entropy (ΔS).
Answer: b. Low enthalpy (ΔH) and high entropy (ΔS).
解説: 反応が自発的であるためには、エンタルピー(ΔH)は小さく、エントロピー(ΔS)は大きい必要があります。これにより、ΔGが負の値を取り、反応が自然に進む傾向があります。選択肢aは反応が非自発的になる可能性があり、選択肢cはエントロピーが低いため自発性が制限されます。選択肢dの高いエンタルピーは自発性を減少させます。
Question 15:
What effect does an increase in temperature have on ΔG if ΔS is positive?
a. It increases ΔG.
b. It decreases ΔG.
c. It has no effect on ΔG.
d. It makes the reaction nonspontaneous.
Answer: b. It decreases ΔG.
解説: ΔG = ΔH – TΔSの式において、エントロピー(ΔS)が正である場合、温度(T)の増加によりTΔSの項が大きくなり、ΔGが減少します。これにより、反応がより自発的になります。選択肢aは誤りで、温度が上がるとΔGが減少します。選択肢cは誤りで、温度はΔGに影響を与えます。選択肢dも誤りです。
Question 16:
Which type of regulation involves the addition or removal of a chemical group to modulate enzyme activity?
a. Gene expression
b. Covalent modification
c. Allosteric regulation
d. Competitive inhibition
Answer: b. Covalent modification
解説: 共有結合修飾(covalent modification)は、酵素の活性を調整する方法の一つで、リン酸化やアセチル化などの化学修飾を介して行われます。選択肢aの遺伝子発現は酵素の量を制御しますが、即時の活性調整には使われません。選択肢cのアロステリック調節は、酵素の別の部位に分子が結合することで制御されます。選択肢dの競争的阻害は、基質の結合部位に阻害剤が競争的に結合することで起こります。
Question 17:
What is the Hill equation primarily used for?
a. To describe enzyme inhibition.
b. To calculate the equilibrium constant.
c. To describe cooperative binding of substrates.
d. To determine Gibbs Free Energy.
Answer: c. To describe cooperative binding of substrates.
解説: Hill式は、複数の基質が酵素の複数の活性部位に協同的に結合する様子を記述する方程式です。これは特にヘモグロビンのような多量体酵素に適用されます。選択肢aはHill式の役割ではなく、選択肢bの平衡定数計算や選択肢dのギブス自由エネルギーの計算にも関与しません。
Question 18:
In the context of proteolytic activation, which of the following is an inactive precursor of an enzyme?
a. Apoenzyme
b. Coenzyme
c. Zymogen
d. Holoenzyme
Answer: c. Zymogen
解説: プロ酵素(zymogen)は、不活性状態の酵素前駆体であり、特定の条件下で活性化されて酵素として働きます。例として、ペプシノーゲン(Pepsinogen)がペプシン(Pepsin)に変換される過程があります。選択肢aのアポ酵素(apoenzyme)は補因子が結合していない酵素を指し、選択肢bの補酵素(coenzyme)は酵素の補助分子です。選択肢dのホロ酵素(holoenzyme)は、補因子が結合した完全な酵素を意味します。
Question 19:
Which of the following is an example of rapid enzyme regulation?
a. Transcriptional control
b. Gene expression
c. Allosteric regulation
d. Covalent modification
Answer: c. Allosteric regulation
解説: アロステリック調節は、既存の酵素の活性を素早く調整する方法で、酵素のアロステリック部位に他の分子が結合することで、活性が変化します。選択肢aとbは遺伝子レベルでの制御で、比較的遅いプロセスです。選択肢dの共有結合修飾も酵素活性を調整しますが、アロステリック調節ほど迅速ではありません。
Question 20:
What happens to the value of ΔG when the entropy of the system increases while the temperature remains constant?
a. ΔG decreases.
b. ΔG increases.
c. ΔG becomes zero.
d. ΔG remains unchanged.
Answer: a. ΔG decreases.
解説: ΔG = ΔH – TΔSの式において、温度が一定の場合、エントロピー(ΔS)が増加すると、TΔSの値が大きくなり、ΔGの値は減少します。したがって、反応はより自発的になる可能性があります。選択肢bは誤りで、エントロピーの増加はΔGの減少を引き起こします。選択肢cとdは状況に当てはまりません。
Question 1:
What is an example of slow enzyme regulation?
a. Allosteric regulation
b. Phosphorylation
c. Gene expression
d. Feedback inhibition
Answer: c. Gene expression
解説: 遅い酵素の制御(Slow Control)は、遺伝子発現(Gene Expression)を介して行われます。遺伝子が転写され、タンパク質として酵素が合成されるプロセスには、数分から数時間かかるため、遅い制御として分類されます。選択肢aのアロステリック調節や選択肢bのリン酸化(Phosphorylation)は迅速な制御(Rapid Control)に該当します。選択肢dのフィードバック阻害も迅速な制御に該当します。
Question 2:
Which of the following is a rapid enzyme regulation mechanism?
a. Gene expression
b. Ubiquitination
c. Allosteric regulation
d. Protein synthesis
Answer: c. Allosteric regulation
解説: 迅速な制御(Rapid Control)の一例として、アロステリック調節(Allosteric Regulation)は、エフェクター分子が酵素のアロステリック部位に結合することで、即座に酵素活性を調整します。選択肢aの遺伝子発現や選択肢dのタンパク質合成は遅い制御に該当します。選択肢bのユビキチン化(Ubiquitination)は酵素の分解に関与し、迅速な制御の範疇には入りません。
Question 3:
What is the effect of phosphorylation on enzyme regulation?
a. It always activates the enzyme.
b. It always inhibits the enzyme.
c. It can activate or inhibit the enzyme.
d. It has no effect on enzyme activity.
Answer: c. It can activate or inhibit the enzyme.
解説: リン酸化(Phosphorylation)は、酵素に共有結合修飾を加えることで、酵素の活性を増加させる場合もあれば、逆に抑制することもあります。したがって、リン酸化は一貫して活性化や阻害を引き起こすわけではありません。選択肢aやbは正しくなく、選択肢dの「影響がない」は誤りです。
Question 4:
Which of the following molecules is typically involved in ubiquitination?
a. Coenzyme
b. Ubiquitin
c. Phosphate
d. ATP
Answer: b. Ubiquitin
解説: ユビキチン化(Ubiquitination)では、ユビキチン分子が酵素に付加され、分解のマーカーとして働きます。ユビキチンが結合された酵素はプロテアソームによって分解されます。選択肢aの補酵素(Coenzyme)は酵素活性に関与しますが、分解には関与しません。選択肢cのリン酸(Phosphate)はリン酸化に関連し、選択肢dのATPはエネルギーを供給しますが、ユビキチン化に直接関係しません。
Question 5:
What is the primary role of feedback regulation in enzymatic pathways?
a. To increase the production of the final product.
b. To regulate enzyme activity based on the concentration of the final product.
c. To decrease the substrate concentration.
d. To activate the first enzyme in the pathway.
Answer: b. To regulate enzyme activity based on the concentration of the final product.
解説: フィードバック調節(Feedback Regulation)は、経路の最終産物の濃度が高くなると、その経路の初期段階に関与する酵素を阻害し、反応を抑制します。これにより、産物が過剰に生成されることを防ぎます。選択肢aの「産物を増加させる」や、選択肢dの「経路の最初の酵素を活性化する」は誤りです。選択肢cは、フィードバック調節の直接的な目的ではありません。
Question 6:
Which modification is typically irreversible?
a. Allosteric regulation
b. Phosphorylation
c. Proteolytic activation
d. Methylation
Answer: c. Proteolytic activation
解説: プロテオリティック活性化(Proteolytic Activation)は、酵素が不活性な前駆体(プロ酵素)から活性化される過程であり、これは不可逆的なプロセスです。一度活性化された酵素は元に戻りません。選択肢aのアロステリック調節や選択肢bのリン酸化、選択肢dのメチル化は可逆的な調節です。
Question 7:
What type of effector increases enzyme activity in allosteric regulation?
a. Negative effector
b. Competitive inhibitor
c. Positive effector
d. Noncompetitive inhibitor
Answer: c. Positive effector
解説: アロステリック調節において、正のエフェクター(Positive Effector)は酵素の活性を増加させます。これに対して、負のエフェクター(Negative Effector)は活性を抑制します。選択肢bとdの競合阻害剤(Competitive Inhibitor)や非競合阻害剤(Noncompetitive Inhibitor)は、アロステリック調節のエフェクターではありません。
Question 8:
What is a common feature of enzymes regulated by cooperative binding?
a. They follow Michaelis-Menten kinetics.
b. They have multiple binding sites for a single substrate.
c. They are always active at low substrate concentrations.
d. They are inhibited by substrate binding.
Answer: b. They have multiple binding sites for a single substrate.
解説: 協同性結合(Cooperative Binding)は、酵素が複数の活性部位を持ち、それぞれの部位が基質に結合することで他の部位の親和性が変化する現象です。これにより、反応が非線形に進行します。選択肢aのミカエリス-メンテン動態に従うわけではなく、選択肢cの低濃度で常に活性化されるわけでもありません。選択肢dの基質結合による阻害は、協同結合とは逆の現象です。
Question 9:
Which of the following is a characteristic of homotropic allosteric modulation?
a. The effector is different from the substrate.
b. The effector is the same as the substrate.
c. The enzyme is only active with competitive inhibitors.
d. The enzyme is deactivated upon substrate binding.
Answer: b. The effector is the same as the substrate.
解説: ホモトロピック調節(Homotropic Allosteric Modulation)では、基質分子自体が調節に関与し、他の活性部位に基質が結合する親和性を変化させます。典型的な例として、ヘモグロビンが挙げられます。選択肢aの「エフェクターが基質と異なる」はヘテロトロピック調節を指します。選択肢cとdはホモトロピック調節とは無関係です。
Question 10:
What is the main function of proteolytic activation?
a. To reversibly regulate enzyme activity.
b. To permanently activate enzymes.
c. To inhibit enzyme activity.
d. To increase substrate concentration.
Answer: b. To permanently activate enzymes.
解説: プロテオリティック活性化(Proteolytic Activation)は、酵素の不活性前駆体であるプロ酵素を不可逆的に活性化するプロセスです。このプロセスは一度起こると元に戻せません。選択肢aの可逆的な調節は、このプロセスには当てはまりません。選択肢cやdもこのプロセスの目的ではありません。
Question 11:
Which of the following is an example of a zymogen?
a. Pepsin
b. Trypsin
c. Pepsinogen
d. Carboxypeptidase
Answer: c. Pepsinogen
**解説
**: ペプシノーゲン(Pepsinogen)は、胃で活性化されてペプシン(Pepsin)に変換される不活性前駆体(プロ酵素)です。選択肢aのペプシンや選択肢bのトリプシン、選択肢dのカルボキシペプチダーゼはすでに活性化された酵素であり、プロ酵素ではありません。
Question 12:
What is a characteristic of cooperative binding?
a. The binding of one substrate decreases the enzyme’s affinity for additional substrates.
b. It only occurs in single-subunit enzymes.
c. It results in a sigmoidal reaction curve.
d. It is independent of substrate concentration.
Answer: c. It results in a sigmoidal reaction curve.
解説: 協同性結合(Cooperative Binding)は、基質の濃度が増加するにつれて、反応速度が急激に上昇するシグモイド曲線を描くことが特徴です。選択肢aの親和性の低下は誤りで、基質の結合によって親和性は通常増加します。選択肢bは誤りで、協同性は多量体酵素に見られます。選択肢dは協同性結合の特徴とは無関係です。
Question 13:
What type of enzyme regulation involves the binding of a molecule at a site other than the active site?
a. Competitive inhibition
b. Allosteric regulation
c. Gene expression
d. Ubiquitination
Answer: b. Allosteric regulation
解説: アロステリック調節(Allosteric Regulation)は、エフェクター分子が酵素のアロステリック部位に結合し、活性部位に影響を与えることで酵素の活性を調整するメカニズムです。選択肢aの競争的阻害(Competitive Inhibition)は、基質と同じ部位で競合します。選択肢cとdは遺伝子レベルの制御や分解に関与し、アロステリック調節とは異なります。
Question 14:
What is a feature of heterotropic allosteric modulation?
a. The effector is the same as the substrate.
b. The effector is different from the substrate.
c. It always decreases enzyme activity.
d. It only occurs in monomeric enzymes.
Answer: b. The effector is different from the substrate.
解説: ヘテロトロピック調節(Heterotropic Allosteric Modulation)では、基質とは異なる分子が酵素のアロステリック部位に結合し、酵素の活性を調整します。選択肢aはホモトロピック調節に当てはまります。選択肢cは誤りで、エフェクターは酵素活性を促進する場合もあります。選択肢dも誤りで、多量体酵素に多く見られます。
Question 15:
How does feedback inhibition regulate metabolic pathways?
a. By activating the first enzyme in the pathway.
b. By increasing the concentration of the final product.
c. By inhibiting the rate-limiting enzyme of the pathway.
d. By degrading the first enzyme in the pathway.
Answer: c. By inhibiting the rate-limiting enzyme of the pathway.
解説: フィードバック阻害(Feedback Inhibition)は、代謝経路の最終産物が、その経路の律速酵素(Rate-Limiting Enzyme)を抑制することで、経路全体の活動を調整します。選択肢aやdのように最初の酵素を活性化または分解することではありません。選択肢bの産物濃度の増加は逆効果です。
Question 16:
Which of the following is an example of covalent modification in enzyme regulation?
a. Allosteric regulation
b. Gene expression
c. Phosphorylation
d. Feedback inhibition
Answer: c. Phosphorylation
解説: 共有結合修飾(Covalent Modification)の代表例はリン酸化(Phosphorylation)であり、これは酵素にリン酸基が付加されることで酵素の活性を調節します。選択肢aのアロステリック調節は酵素の別の部位に分子が結合することで行われ、選択肢bの遺伝子発現や選択肢dのフィードバック阻害は異なるメカニズムによるものです。
Question 17:
Which of the following describes the process by which an enzyme precursor is converted into an active enzyme?
a. Ubiquitination
b. Allosteric activation
c. Proteolytic activation
d. Methylation
Answer: c. Proteolytic activation
解説: プロテオリティック活性化(Proteolytic Activation)は、酵素の不活性前駆体であるプロ酵素が、特定の条件下で切断されて活性化酵素に変わるプロセスです。選択肢aのユビキチン化や選択肢dのメチル化は、酵素の活性化や分解に関連するものの、プロ酵素を活性化するメカニズムではありません。選択肢bのアロステリック活性化は酵素の別の部位に結合することで活性を変化させますが、プロ酵素の活性化には直接関与しません。
Question 18:
What is the role of ubiquitination in enzyme regulation?
a. It increases enzyme activity.
b. It decreases enzyme degradation.
c. It marks enzymes for degradation.
d. It increases the production of enzymes.
Answer: c. It marks enzymes for degradation.
解説: ユビキチン化(Ubiquitination)は、酵素にユビキチン分子が付加されることで、その酵素がプロテアソームで分解されるマーカーとして機能します。これは、不要または損傷した酵素を除去するためのメカニズムです。選択肢aの「活性の増加」や選択肢dの「酵素の生産の増加」はユビキチン化とは無関係であり、選択肢bの「分解の減少」も誤りです。
Question 19:
What happens to Vmax in the presence of a noncompetitive inhibitor?
a. Vmax increases.
b. Vmax decreases.
c. Vmax remains unchanged.
d. Vmax becomes zero.
Answer: b. Vmax decreases.
解説: 非競合阻害剤(Noncompetitive Inhibitor)は、酵素の活性部位とは異なる部位に結合し、酵素の機能を阻害します。これにより、基質濃度がどれだけ増加しても最大反応速度(Vmax)は減少します。選択肢aの「増加」や選択肢cの「変化なし」は誤りで、選択肢dも正しくありません。
Question 20:
Which of the following changes when a competitive inhibitor is present?
a. Vmax
b. Km
c. Gibbs Free Energy (ΔG)
d. Reaction spontaneity
Answer: b. Km
解説: 競合阻害剤(Competitive Inhibitor)は、基質と同じ活性部位に結合するため、基質の結合にはより高い濃度が必要となります。これにより、ミカエリス定数(Km)が増加しますが、最大反応速度(Vmax)には影響を与えません。選択肢aのVmaxや選択肢cのギブス自由エネルギー(ΔG)は変化しません。選択肢dの「反応の自発性」も競合阻害には関係ありません。


コメント