Contents
- 1 酵素 (Enzymes)
- 2 化学反応 (Chemical Reactions)
- 3 補因子 (Cofactors)
- 4 酵素の触媒作用と反応速度の増加 (Enzymatic Process and Acceleration of Reactions)
- 5 化学反応と活性化エネルギー (Chemical Reactions and Activation Energy)
- 6 触媒作用を促進する酵素のメカニズム (Enzymatic Mechanisms to Facilitate Catalysis)
- 7 基質アナログと遷移状態アナログ (Substrate Analog vs Transition State Analog)
- 8 活性化エネルギーを低下させる方法 (How to Lower the Activation Energy)
- 9 酵素の特徴と特異性 (Characteristics and Specificity of Enzymes)
- 10 酵素の「三点接触モデル」 (“Three-Point Attachment Model” of Enzymes)
- 11 酵素の命名法 (Naming of Enzymes)
- 12 酵素の分類 (Classification of Enzymes)
- 13 アイソザイム (Isozymes)
- 14 酵素の分析と診断 (Analysis of Certain Enzymes and Diagnosis)
酵素 (Enzymes)
学習目標 (Learning Objectives for Today)
- 酵素の定義と生物学的役割の説明: 酵素が何であり、体内でどのような役割を果たしているかを説明します。
- 酵素の種類とその機能の列挙: 酵素の異なる種類とそれぞれの機能を挙げます。
- 酵素における基質結合の説明: 酵素がどのように基質と結合するかを説明します。
- 酵素触媒のメカニズムの列挙と説明: 酵素が触媒としてどのように機能するか、そのメカニズムを説明します。
- アイソザイムの定義とその医学的重要性の説明: アイソザイムの定義と、それが医学的にどのように重要かを説明します。
1. 酵素とは? (What are Enzymes?)
酵素(Enzymes)は、生体内で化学反応を促進する触媒(Catalysts)です。酵素は、反応の速度を高めることで、体内のさまざまな生化学的プロセス(Biochemical Processes)をサポートします。これにより、反応が生体にとって必要な速度で進行します。
2. 酵素の種類と機能 (Types and Functions of Enzymes)
酵素には多くの種類がありますが、主なものには以下があります:
- 酸化還元酵素 (Oxidoreductases): 酸化還元反応(Oxidation-Reduction Reactions)を触媒します。
- 転移酵素 (Transferases): 基本的な化学基(Functional Groups)を一つの分子から別の分子に移動させます。
- 加水分解酵素 (Hydrolases): 水を使用して化学結合を切断します。
- リアーゼ(Lyases): 分子内で化学結合を切断または形成します(通常は化学変化を伴います)。
- 異性化酵素 (Isomerases): 分子内の原子の配置を変化させて異性体(Isomers)を生成します。
- 合成酵素 (Ligases): 二つの分子を結合して新しい化学結合を形成します。
3. 基質結合の説明 (Substrate Binding in Enzymes)
酵素は特定の基質(Substrate)と結合し、反応を促進します。基質は酵素の活性部位(Active Site)に結合し、反応が起こります。酵素-基質複合体(Enzyme-Substrate Complex)は、基質が酵素に結合することで形成され、反応が進行します。
4. 酵素触媒のメカニズム (Mechanisms of Enzyme Catalysis)
酵素触媒(Enzyme Catalysis)にはいくつかのメカニズムがあります:
- 酵素誘導効果 (Induced Fit Model): 酵素は基質と結合すると、その形状が変化し、基質とよりよく結合します。
- 鎖切断(Transition State Stabilization): 酵素は反応中間体(Transition State)を安定化させ、反応を容易にします。
- プロトン移動(Proton Transfer): 酵素はプロトンの移動を促進することがあります。
5. アイソザイム (Isozymes) の定義と生医学的重要性 (Definition and Biomedical Importance of Isozymes)
アイソザイム(Isozymes)は、同じ反応を触媒する異なる構造を持つ酵素のバリエーションです。これらは異なる組織や細胞で異なる役割を果たし、体内の反応の調節に重要です。例えば、心臓と筋肉には異なるアイソザイムが存在し、それぞれの部位で特有の機能を持ちます。アイソザイムの検出は、特定の病状の診断やモニタリングに役立ちます。
化学反応 (Chemical Reactions)
化学反応 (Chemical Reaction) は、物質が相互作用して新しい物質を形成するプロセスです。化学反応では、化学結合(Chemical Bonds)が切断されたり、新たに形成されたりします。
物理変化と化学変化 (Physical Change vs Chemical Change)
- 物理変化 (Physical Change): 物質のサイズ、形状、状態(固体、液体、気体)が変化しますが、化学組成は変わりません。例:水の氷への変化。
- 化学変化 (Chemical Change): 新しい化学物質が形成されるプロセスです。証拠としては、ガスの発生、温度変化、色の変化、沈殿の形成などがあります。例:鉄が錆びる。
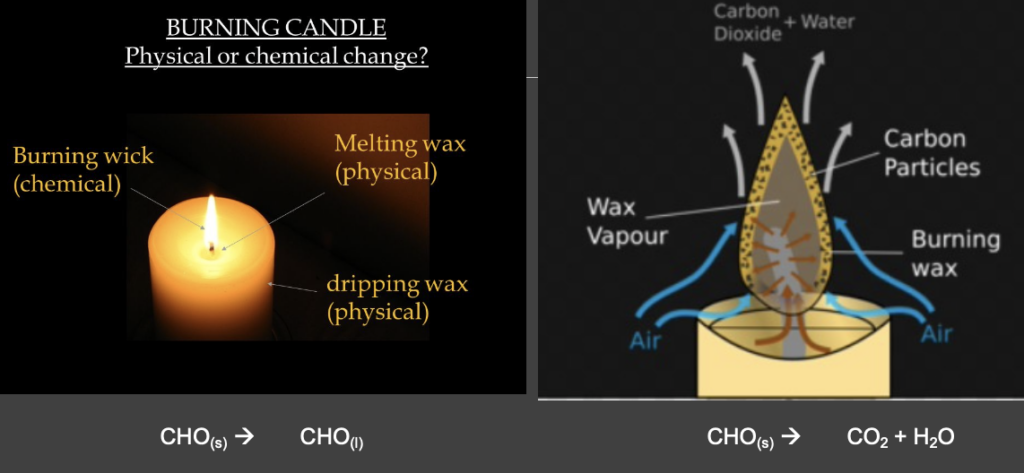
化学反応の基本 (Basics of Chemical Reactions)
化学反応は、反応物(Reactants/Substrates)と生成物(Products)が関与します。
- 反応物/基質 (Reactants/Substrates): 相互作用する原子や分子。
- 生成物 (Products): 反応によって生成される原子や分子。
化学反応 = 反応物 (Substrates) & 生成物 (Products)
例: 過酸化水素 (Hydrogen Peroxide) → 水 (Water) と酸素 (Oxygen)
化学反応では:
- 反応物が接触し、結合が切断され、原子が再配置されて新しい結合が形成されることで生成物ができます。
- 反応物に存在する原子だけが生成物に現れ、新しい原子は生成されず、原子も消失しません。
質量保存の法則 (Law of Conservation of Mass): 反応物の総質量は生成物の質量と等しくなければなりません。質量は創造されず、消失することもありません。
化学反応の化学量論 (Stoichiometry): 化学反応のバランスを取る化学です。反応物の質量 = 生成物の質量
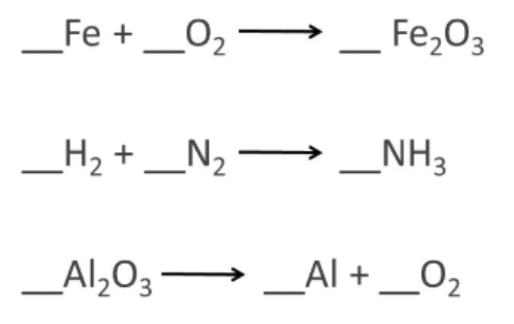
酵素の実践問題と重要性 (Practice Samples for Balancing Equations and Importance of Enzymes)
酵素の重要性 (Importance of Enzymes)
すべての生物学的反応は酵素(Enzymes)に依存しています。酵素は、生体内での化学反応を促進し、反応速度を劇的に高めます。以下の引用は、酵素の重要性を示しています:
- Dr. Richard Wolfenden:
- 「酵素触媒(Enzyme Catalysts)がなければ、最も遅い知られている生物学的反応は1兆年かかります。酵素はこれを10ミリ秒で実現できます。」
- 「触媒がなければ、微生物から人間に至るまで生命は存在しません。自然選択がどのようにして、これほど遅い反応のための原始的な触媒として機能するタンパク質を生み出したのか、不思議に思わざるを得ません。」
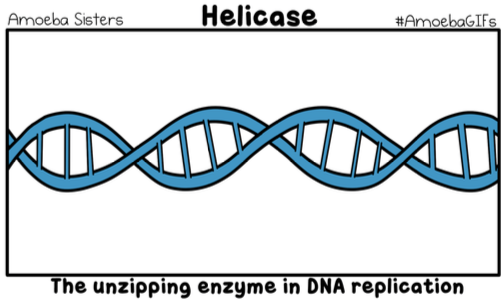
酵素とは? (What are Enzymes?)
酵素は生化学的触媒(Biochemical Catalysts)であり、化学反応を加速(Accelerate/Speed Up)しますが、反応自体には関与しません。ほとんどの酵素は、球状のタンパク質(Globular Proteins)です。
酵素の構成部分 (Parts of Enzyme)
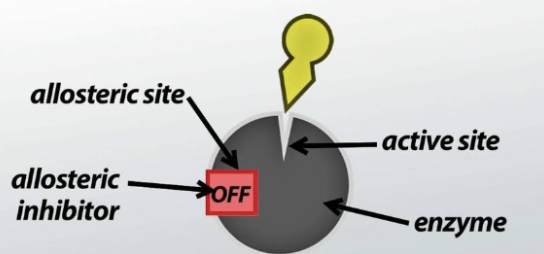
- 活性部位 (Active Site): 酵素が触媒作用を行う部分。
- E-S複合体 (E-S Complex): 基質(Substrate)が酵素の活性部位に結合する状態。
- アロステリック部位 (Allosteric Site): 調節部位で、正のモジュレーター(Positive Modulator)または負のモジュレーター(Negative Modulator)として機能します。
酵素の反応速度 (Enzymes and Rate of Reaction)
酵素は反応速度を増加させます。以下は、いくつかの酵素とその反応速度の例です(反応速度の単位は通常、反応物のミリモル(mmol)/分です):
- パパイン (Papain): 10²
- リボヌクレアーゼ (Ribonuclease): 10²
- カルボキシペプチダーゼ (Carboxypeptidase): 10²(〜10³)
- トリプシン (Trypsin): 10³
- アセチルコリンエステラーゼ (Acetylcholinesterase): 10³
- キナーゼ (Kinases): 10³
- デヒドロゲナーゼ (Dehydrogenases): 10³
- トランスアミナーゼ (Transaminases): 10³
- 炭酸脱水酵素 (Carbonic Anhydrase): 10⁶
酵素の補因子と補酵素 (Cofactors vs Coenzymes)
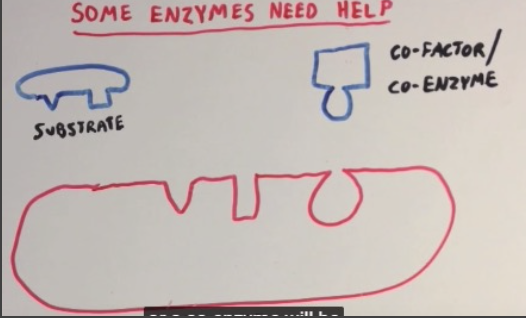
すべての酵素が単独で反応を触媒できるわけではありません。一部の酵素は、反応を助けるために補因子(Cofactors)や補酵素(Coenzymes)が必要です。
- 補因子 (Cofactors): 酵素の機能に必要な無機イオン(Inorganic Ions)や金属(Metals)など。
- 補酵素 (Coenzymes): ビタミン由来の有機分子(Organic Molecules)で、酵素の補助的な役割を果たします。例としては、ビタミンB群(Vitamin B Complex)やニコチンアミドアデニンジヌクレオチド(NAD⁺)などがあります。
補因子 (Cofactors)
補因子(Cofactors)は、酵素(Enzyme)や基質(Substrate)に一時的に結合し、反応の触媒(Catalysis)を補助する分子です。補因子は、以下の2種類に分けられます:
1. 金属イオン (Metal Ions)
金属イオンは無機分子(Inorganic Molecules)であり、直接的に触媒反応に関与します。これらは酵素や基質を安定化させたり、基質を生成物に変換するのを助けたりします。
- 例:
- DNAポリメラーゼ (DNA Polymerase): Mg²⁺ イオンが必要です。Mg²⁺は酵素の活性部位に結合し、DNA合成を助けます。
2. 補酵素 (Coenzymes)
補酵素は有機分子(Organic Molecules)であり、酵素の触媒作用を補助します。これらは一般的に再利用可能なキャリア分子(Carrier Molecules)であり、多くの基質を生成地点から利用地点へと運ぶ役割を果たします。
- 例:
- ニコチンアミドアデニンジヌクレオチド (NAD): 酸化還元反応に関与し、電子とプロトンの運搬を助けます。
- チアミンピロリン酸 (TPP): 糖代謝に関与する補酵素で、脱炭酸反応を助けます。
- フラビンアデニンジヌクレオチド (FAD): 酸化還元反応に関与し、電子の移動を助けます。
- コエンザイムA (CoA): 脂肪酸の代謝などに関与し、アシル基(Acyl Groups)の移動を助けます。

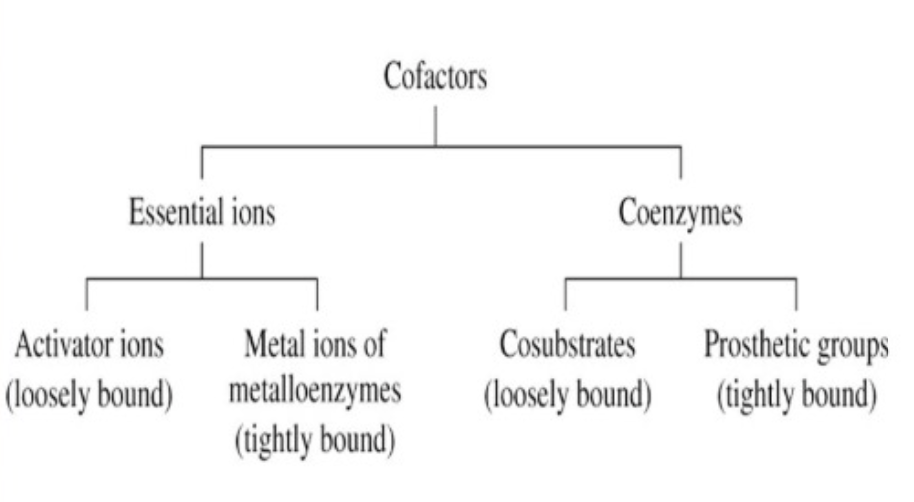
補因子の分類 (Classification of Cofactors)
- 必須イオン (Essential Ions): 酵素の機能に不可欠な金属イオン。
- 補酵素 (Coenzymes):
- 活性化イオン (Activator Ions): ゆるく結合し、酵素の活性を調節します。
- 金属酵素の金属イオン (Metal Ions of Metalloenzymes): 酵素に強く結合し、その機能をサポートします。
- コサブストレート (Cosubstrates): ゆるく結合し、酵素とともに機能します。
- プロステティックグループ (Prosthetic Groups): 酵素に強く結合し、酵素の機能に直接関与します。
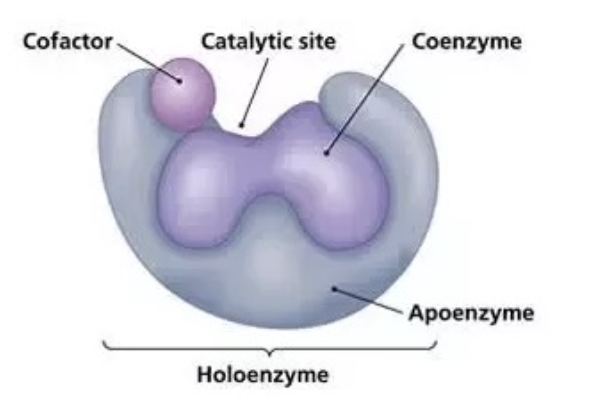
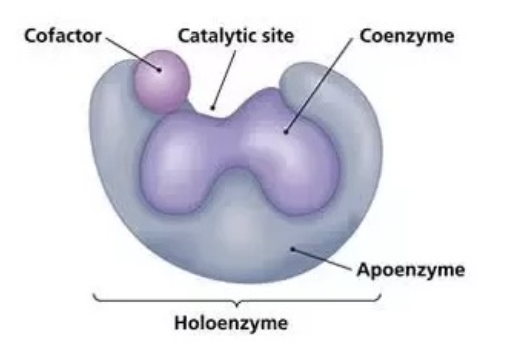
ホロ酵素とアポ酵素 (Holoenzyme vs Apoenzyme)
- アポ酵素 (Apoenzyme): 酵素単独の状態で、補因子が結合していない状態。
- ホロ酵素 (Holoenzyme): 酵素とその補因子が結合した完全な状態で、活性を持ちます。
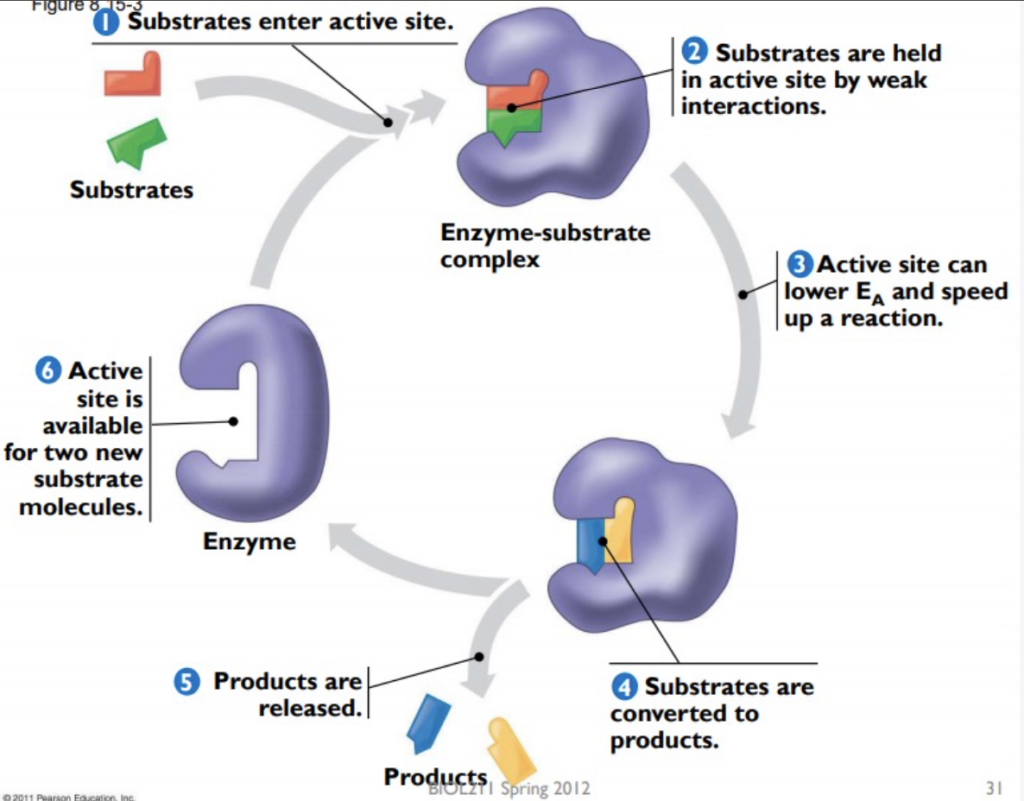
酵素の触媒作用と反応速度の増加 (Enzymatic Process and Acceleration of Reactions)
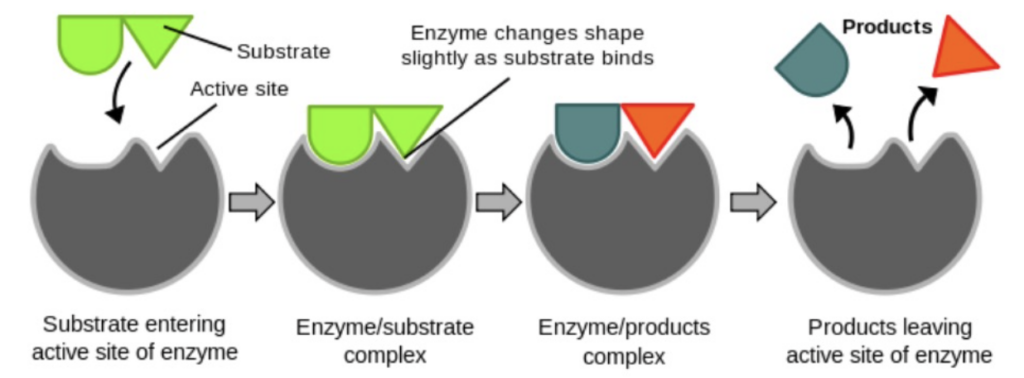
- 基質が活性部位に入る
- 基質が酵素の活性部位 (Active site) に結合します。
- 基質が酵素-基質複合体 (Enzyme-substrate complex) によって保持される
- 基質は、酵素の活性部位において弱い相互作用 (Weak interactions) によって保持されます。
- 酵素は基質に結合する際にわずかに形を変える
- 活性部位が基質と結合する際に、酵素がわずかに形を変えます。これにより、反応が進行しやすくなります。
- 基質が生成物に変換される
- 基質は酵素の活性部位で化学反応を経て生成物 (Products) に変換されます。
- 生成物が活性部位から放出される
- 反応後、生成物は活性部位から放出され、酵素は再び基質を受け入れる準備が整います。
- 活性部位が再び二つの新しい基質分子に対して利用可能になる
- 生成物が放出された後、活性部位は再び新しい基質分子と結合するために利用可能になります。
- 基質が活性部位に入る (Substrate entering active site of enzyme)
- 基質が酵素の活性部位 (Active site) に結合するために接近します。
- 酵素-基質複合体 (Enzyme/substrate complex)
- 基質が活性部位に結合し、酵素-基質複合体が形成されます。酵素は基質と弱い相互作用 (Weak interactions) によって基質を保持します。
- 酵素が基質に結合する際にわずかに形を変える (Enzyme changes shape slightly as substrate binds)
- 活性部位は基質と結合する際にわずかに変形し、基質とより良く相互作用できるようになります。これにより反応が進行しやすくなります。
- 酵素-生成物複合体 (Enzyme/products complex)
- 基質が化学反応を経て生成物 (Products) に変換され、酵素-生成物複合体が形成されます。
- 生成物が活性部位から放出される (Products leaving active site of enzyme)
- 生成物が酵素の活性部位から放出され、酵素は再び新しい基質を結合できる状態になります。
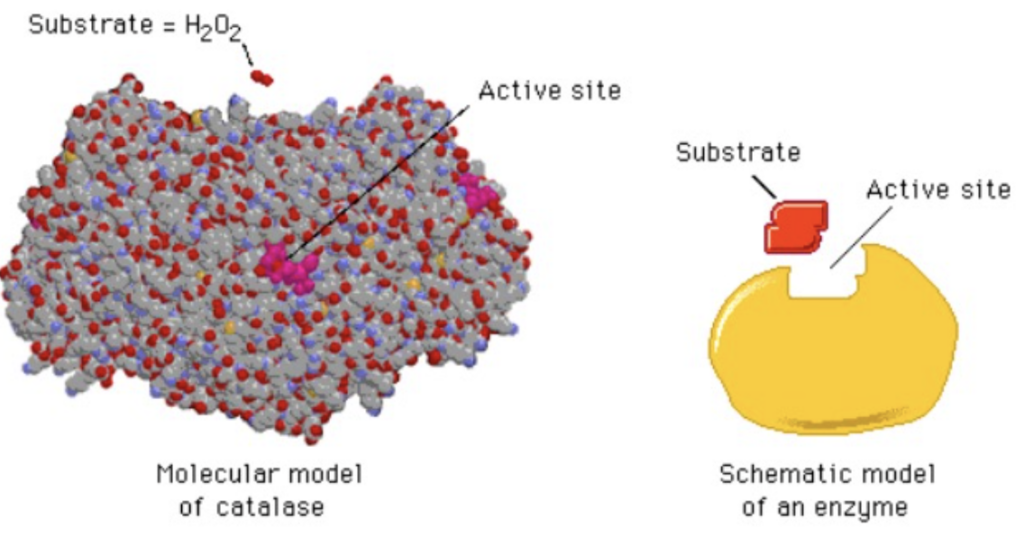
酵素の触媒特性 (Catalytic Properties of Enzymes)
酵素(Enzymes)の触媒特性は驚くべきものです。たとえば、カタラーゼ (Catalase) は非常に高い活性を持ち、有害な過酸化水素 (H₂O₂) を水(H₂O)と酸素(O₂)に変換します:
2H2O2→2H2O+O2
このカタラーゼの1分子は、1秒間に1億7千万回(10⁷回)この反応を繰り返すことができます(ターンオーバー [Turnover])。
ほとんどの酵素は同様の高い速度で反応を促進しますが、例外もあります。例えば、リゾチーム (Lysozyme) は、細菌の細胞壁にあるグリコシド結合 (Glycosidic Bonds) を溶解する酵素であり、一度に1分子の基質としか結合しません。
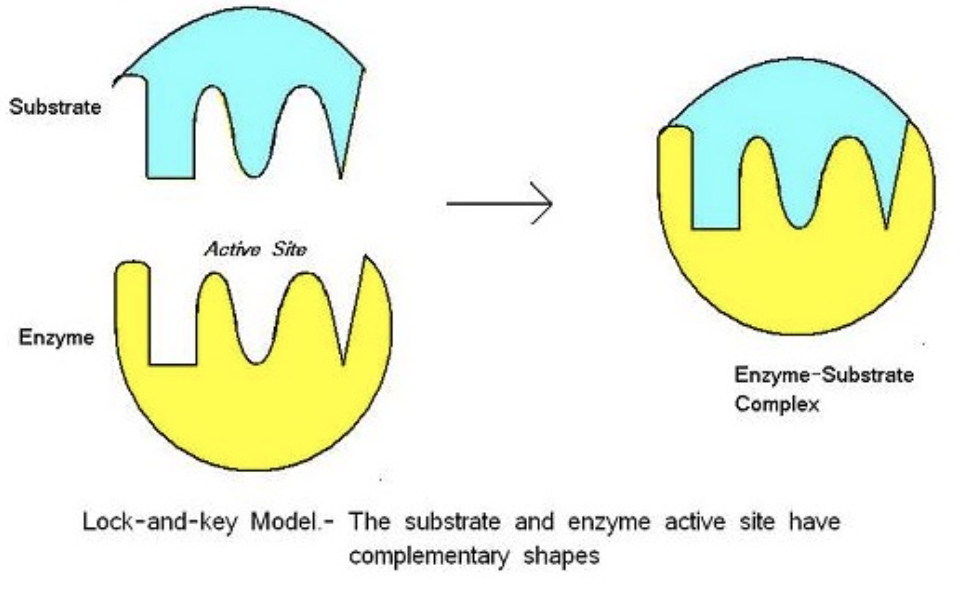
基質結合のモデル (Models for Substrate Binding)
酵素が基質(Substrate)とどのように結合するかを説明するために、二つのモデルがあります:
- ロック・アンド・キー仮説 (Lock-and-Key Hypothesis)
- 提唱者: エミール・フィッシャー (Emil Fischer)
- モデル: ロック(酵素 [Enzyme])とキー(基質 [Substrate])の例え。正確なサイズのキー(基質)のみがロックの鍵穴(活性部位 [Active Site])に合います。このモデルでは、酵素と基質の形がぴったり合うと仮定しています。
- 誘導適合仮説 (Induced Fit Hypothesis)
- 提唱者: ダニエル・コシュランド (Daniel Koshland)
- モデル: より最近提唱され、証拠により広く受け入れられているモデル。活性部位の形状は基質の存在により変化し、基質に合わせて形を変えます。このモデルでは、酵素と基質が最初から完全に一致しているわけではなく、基質が結合することで酵素の形が変わるとされています。

酵素が化学反応をどのように加速するか? (How do Enzymes Speed Up Chemical Reactions?)
酵素は以下の方法で化学反応を加速します:
- 活性化エネルギーの低下 (Lowering Activation Energy)
- 酵素は反応の活性化エネルギー (Activation Energy) を低下させます。これにより、反応がより迅速に進行します。
- 反応中間体の安定化 (Stabilizing Reaction Intermediates)
- 酵素は反応の中間体(Transition State)を安定化させることで、反応が起こりやすくします。
- 基質の近接と配置 (Proximity and Orientation)
- 酵素は基質を正確な位置に配置し、反応が起こりやすい状態にします。これにより、反応の確率が増加します。
- 化学環境の提供 (Providing a Chemical Environment)
- 酵素は反応に適した化学的環境を提供します。例えば、酸性または塩基性の環境を提供することで、反応を促進します。
化学反応と活性化エネルギー (Chemical Reactions and Activation Energy)
化学反応は化学結合の切断と再形成を含みます。反応を始めるにはエネルギーが必要で、このエネルギーは活性化エネルギー (Activation Energy, EA) と呼ばれます。活性化エネルギーは、化学反応が起こるために必要な最小限のエネルギーです。全体としてはエネルギー的に有利であっても、反応を開始するにはこのエネルギーが必要です。
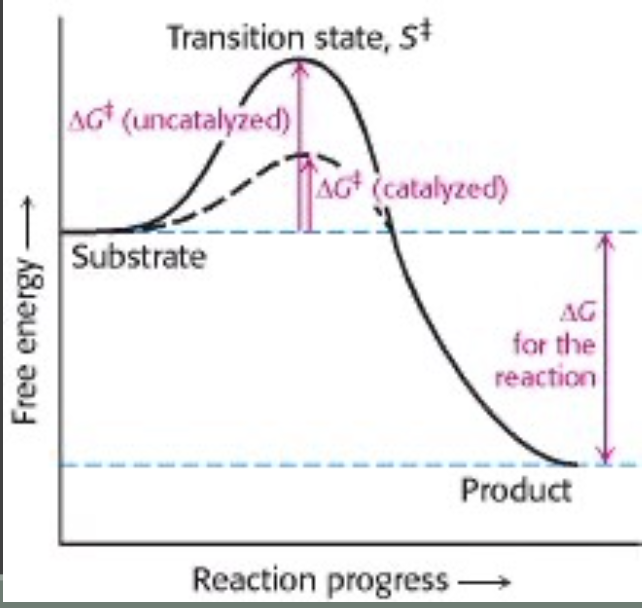
触媒作用を促進する酵素のメカニズム (Enzymatic Mechanisms to Facilitate Catalysis)
酵素は様々なメカニズムを用いて触媒作用を促進します。主なメカニズムは以下の通りです:
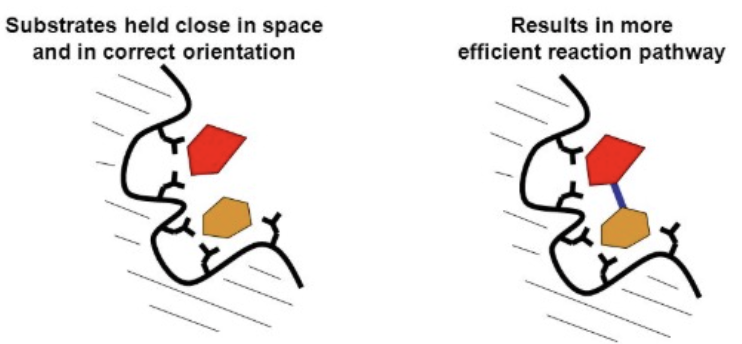
- 近接触媒 (Catalysis by Proximity)
- 説明: 分子が相互作用するためには、結合形成の距離にある必要があります。酵素の活性部位 (Active Site) は高い局所基質濃度を創出し、分子が化学的に相互作用するのに理想的な位置に配置します。
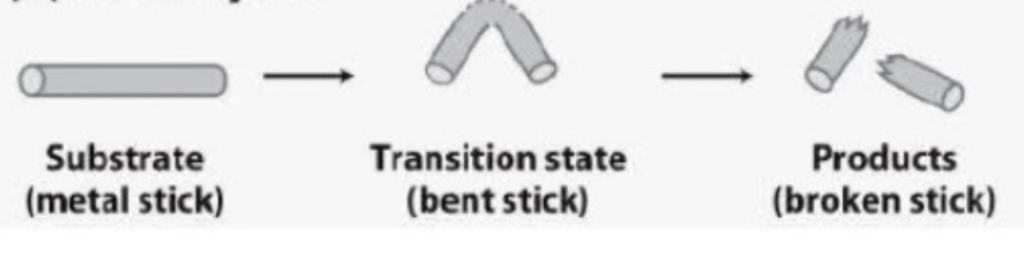
- ひずみ触媒 (Catalysis by Strain)
- 説明: 酵素は通常、基質をわずかに不利な立体構造に結合します。このひずんだ構造は遷移状態中間体 (Transition State Intermediate) の構造を模倣します。これにより、反応がより速く進行します。
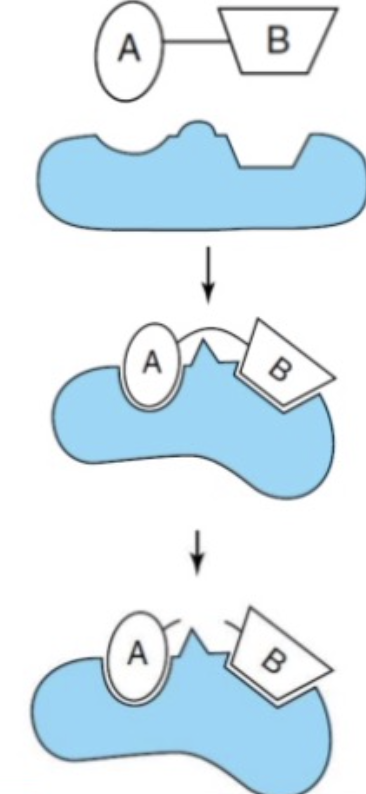
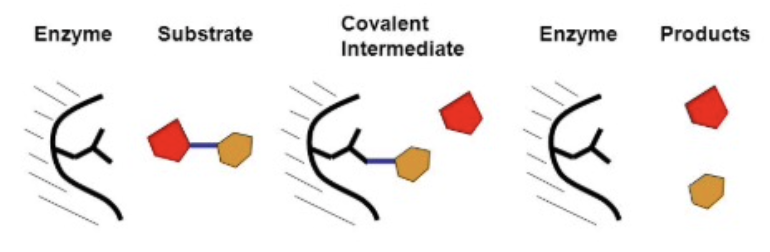
- 共有結合触媒 (Covalent Catalysis)
- 説明: 酵素と1つまたは複数の基質の間に共有結合を形成します。修飾された酵素は一時的な反応物となります。よく使われるアミノ酸はシステイン (Cysteine)、セリン (Serine)、ヒスチジン (Histidine) です。共有結合触媒には核酸(Nucleophile)が必要で、シュッフ基(Schiff Base)として中間体が形成されることがよくあります。
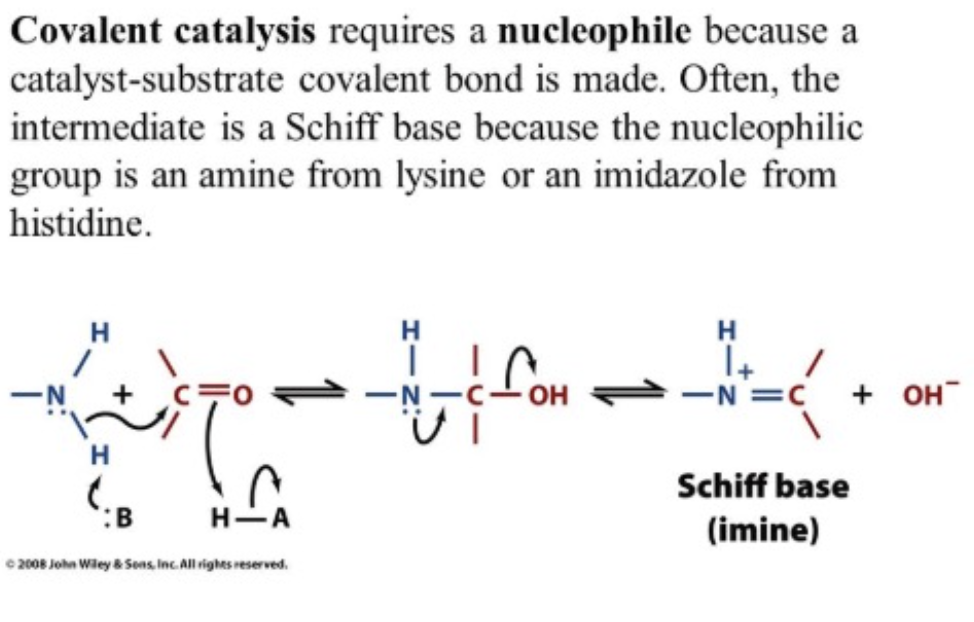
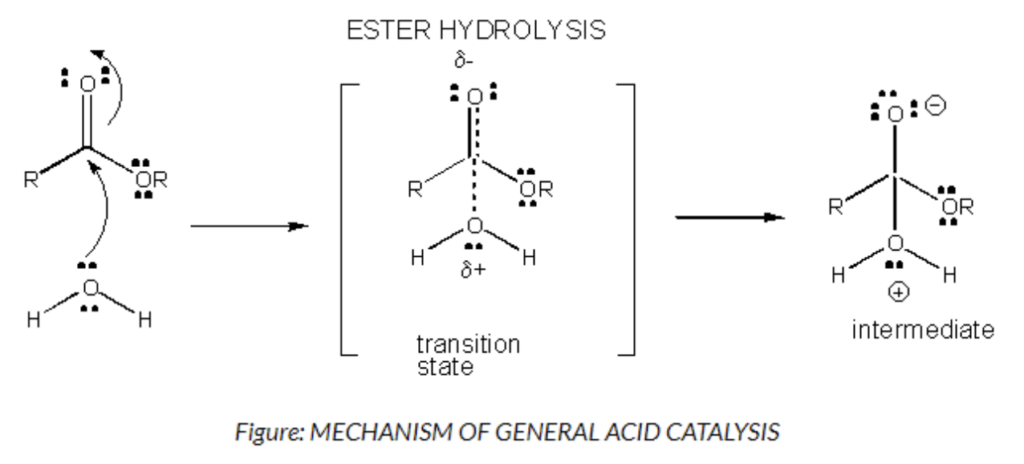
- 酸-塩基触媒 (Acid-Base Catalysis)
- 説明: 酵素の補因子 (Prosthetic Groups) が酸または塩基として作用し、基質のプロトンを取り除いたり、プロトンを供給したりします。
- 酸触媒 (Acid Catalysis): H⁺ またはプロトンに敏感です。
- 塩基触媒 (Base Catalysis): OH⁻ イオンに敏感です。
- 説明: 酵素の補因子 (Prosthetic Groups) が酸または塩基として作用し、基質のプロトンを取り除いたり、プロトンを供給したりします。
基質アナログと遷移状態アナログ (Substrate Analog vs Transition State Analog)
遷移状態アナログ (Transition State Analog) は、酵素の効果因子または阻害剤として、より効果的です。遷移状態アナログは、実際の遷移状態中間体の構造を模倣し、酵素の活性部位に強く結合します。これにより、基質アナログ(基質の模倣体)よりも効果的に酵素の活性を阻害します。
活性化エネルギーを低下させる方法 (How to Lower the Activation Energy)
酵素が活性化エネルギーを低下させる方法は、遷移状態中間体の安定化を達成することにあります。遷移状態を達成するためには、以下の方法が用いられます:
- 基質の正しい近接と配置 (Approximate and Orient Substrates Correctly)
- 酵素は基質を正確な位置に配置し、反応に最適な距離に保ちます。これにより、結合が形成されやすくなります(近接触媒 (Proximity Catalysis))。
- 分子内の結合にストレスをかける (Put Stress on the Bonds Within the Molecule)
- 酵素は基質をわずかに変形させ、遷移状態中間体に似た構造を模倣します。これにより、反応が進行しやすくなります(ひずみ触媒 (Strain Catalysis))。
- 反応のための低エネルギー経路を提供する (Provide a Lower-Energy Pathway for the Reaction)
- 酵素は反応に対して別の低エネルギー経路を提供し、反応が進行しやすくします(共有結合触媒 (Covalent Catalysis))。
- 基質に対して電荷分布を誘導する (Induce Charge Distribution on Substrates)
- 酵素は酸または塩基として作用し、基質の電荷分布を変化させ、反応を促進します(酸-塩基触媒 (Acid-Base Catalysis))。
酵素の特徴と特異性 (Characteristics and Specificity of Enzymes)
酵素は以下の特徴を持ち、高い特異性を示します:
- 消費されず、永久的に変化しない (Neither Consumed nor Permanently Altered in the Reaction)
- 酵素は反応中に消費されず、反応後も元の状態に戻ります。
- 高い特異性と選択性 (High Specificity and Selectivity)
- 酵素は特定の基質に対して非常に高い特異性を持ちます。
- 立体特異性 (Stereospecific)
- 酵素は立体異性体に対しても特異的に作用します。
酵素の「三点接触モデル」 (“Three-Point Attachment Model” of Enzymes)
酵素は基質の少なくとも3つの部位に結合します:
- 第一の接触: 最も高い親和性 (First Attachment)
- 基質のC末端とN末端に結合し、最も特異的です。
- 第二の接触: 中程度の親和性 (Second Attachment)
- 通常、リン脂質の頭部群を通じて結合します。
- 第三の接触: 最も低い親和性 (Third Attachment)
- 疎水性相互作用を介して結合します。
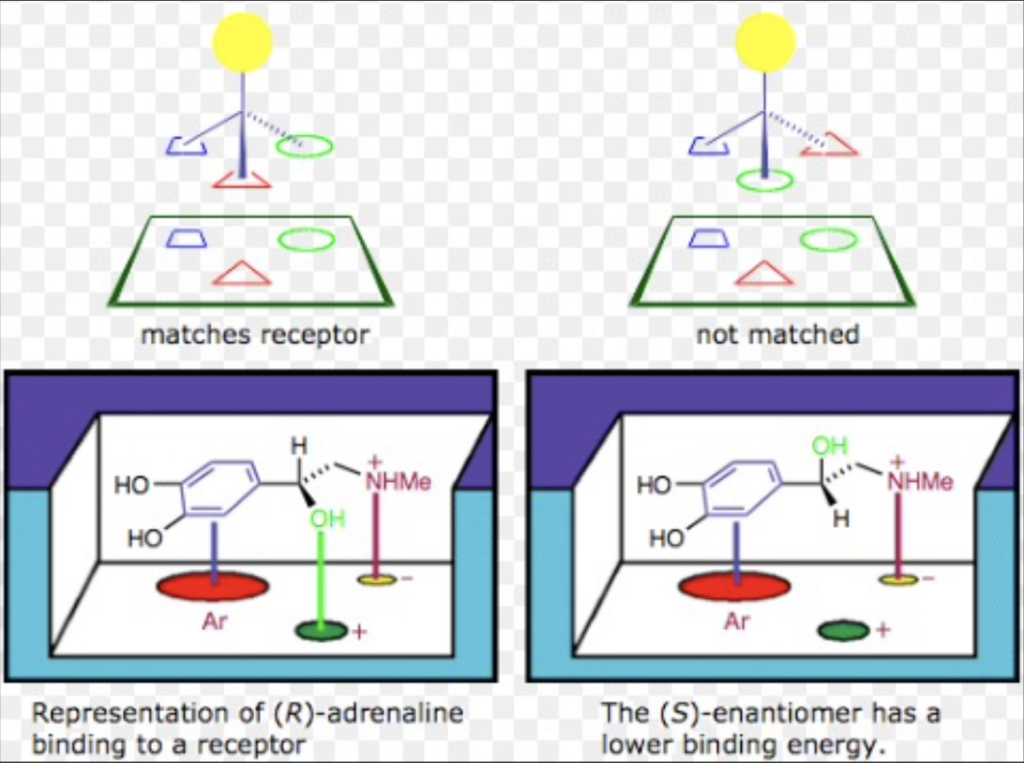
酵素の命名法 (Naming of Enzymes)
酵素の命名には以下の原則があります:
- 第一原則: 酵素名の末尾は通常「-ase」 (First Principle)
- 例: Succinate Oxidase, Cytochrome Oxidase, Hexokinase
- 例外: Trypsin, Chymotrypsin, Pepsin
- 第二原則: 酵素は触媒する反応に基づいて分類される (Second Principle)
- 例: 酸化還元反応 (Redox Reactions): Oxidoreductases, Dehydrogenases, Oxidases
- タンパク質分解 (Protein Degradation): Protease
- 脂質分解 (Lipid Degradation): Lipase
- 第三原則: 酵素名の最初の名詞は通常基質 (Third Principle)
- 例: Glucose-6-Phosphate Dehydrogenase, Pyruvate Dehydrogenase
酵素の分類 (Classification of Enzymes)
酵素は主に6つのクラスに分類されます。これらの分類は酵素が触媒する反応の種類に基づいています。
- 酸化還元酵素 (Oxidoreductases)
- 説明: 酸化還元反応を触媒します。電子を一つの分子(酸化剤)から別の分子(還元剤)へ移動させます。
- 反応式: A⁻ + B → A + B⁻
- 例:
- 酸化酵素 (Oxidases): 分子酸素が水素や電子を受け取る。
- 脱水素酵素 (Dehydrogenases): NAD⁺/NADP⁺やフラビン酵素に水素を転送します。
- ペルオキシダーゼ (Peroxidases): ペルオキシソームに見られ、過酸化水素を還元します。
- ヒドロキシラーゼ (Hydroxylases): 基質にOH基を追加します。
- 酸素化酵素 (Oxygenases): 分子酸素を有機基質に組み込みます。
- 還元酵素 (Reductases): 還元反応を触媒します。
- 転移酵素 (Transferases)
- 説明: 基質のグループ(例えばメチル基、グリコシル基、リン酸基など)を一つの化合物(供与体)から別の化合物(受容体)へ転送します。
- 反応式: A-B + C → A + B-C
- 例:
- キナーゼ (Kinases): 磷酸基を転送します。
- リン酸化酵素 (Phosphorylases): リン酸基を移動します。
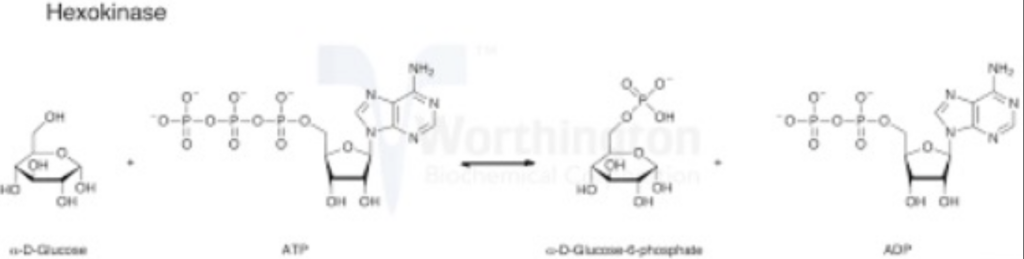
- 加水分解酵素 (Hydrolases)
- 説明: C-C、C-O、C-N などの共有結合を水の付加により加水分解します。
- 反応式: R-X + H₂O → R-OH + HX
- 例:
- プロテアーゼ (Proteases): タンパク質を加水分解します。
- リパーゼ (Lipases): 脂肪を加水分解します。
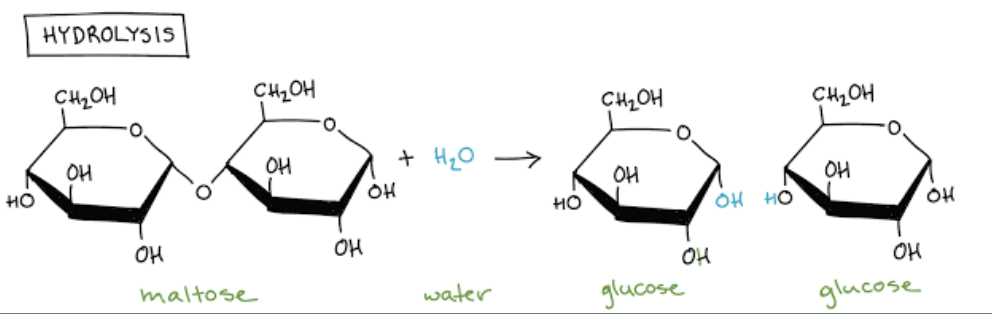
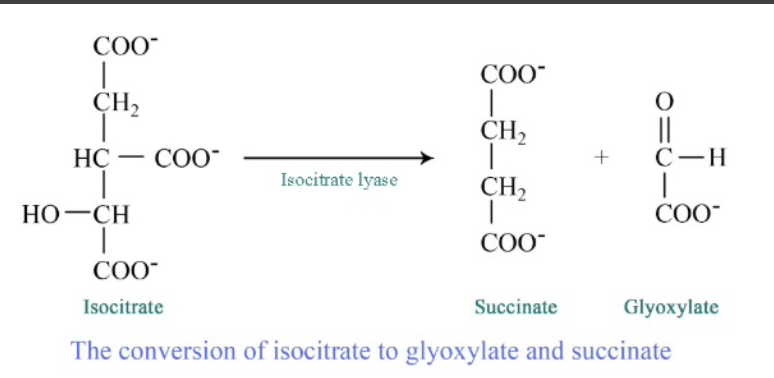
- 切断酵素 (Lyases)
- 説明: 加水分解や酸化以外の手段で化学結合を切断し、二重結合を形成します。
- 反応式: A-B → A + B
- 例:
- カルボニラーゼ (Carboxylases): 二酸化炭素を基質に付加します。
- アミノ酸脱炭酸酵素 (Amino Acid Decarboxylases): アミノ酸から炭酸を除去します。
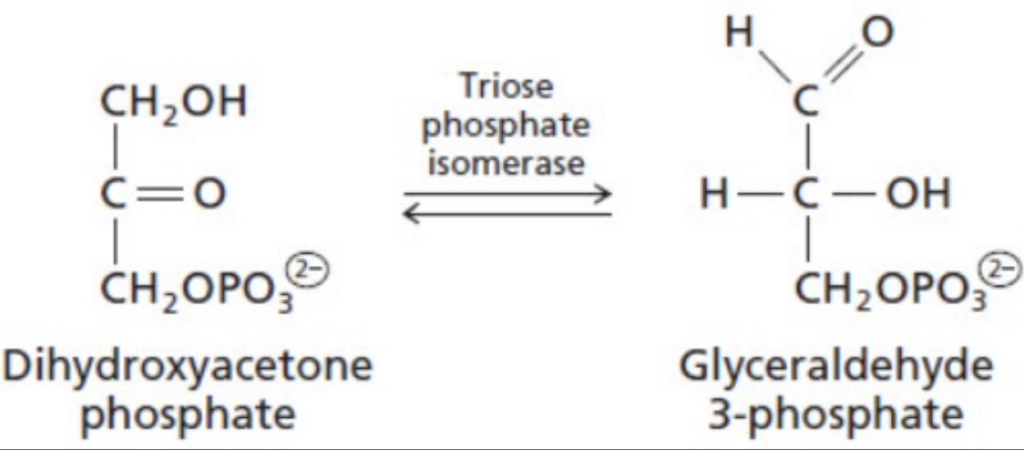
- 異性化酵素 (Isomerases)
- 説明: 分子内の官能基を移動させ、異性体の形態を生成します。
- 例:
- ラセマーゼ (Racemases): L型とD型の立体異性体を相互変換します。
- ミュータース (Mutases): 基質間でグループを転送します。
- 異性化酵素 (Isomerases): 異性体を形成するために基質の官能基を移動させます。
- リガーゼ (Ligases)
- 説明: ATPの加水分解に結びついた反応で、2つの分子を結合させます。
- 反応式: A + B + ATP → AB + ADP + Pi
- 例:
- リガーゼ (Ligases): 二つの分子を結合させます。
- 合成酵素 (Synthase): 分子を結合させる酵素。
- 合成体 (Synthetase): ATPを使って分子を合成します。
| 酵素の種類 (Type of Enzyme) | 説明 (Description) | 反応式 (Reaction Formula) | 例 (Examples) |
|---|---|---|---|
| 酸化還元酵素 (Oxidoreductases) | 酸化還元反応を触媒し、電子を一つの分子(酸化剤)から別の分子(還元剤)に移動させます。 | A⁻ + B → A + B⁻ | 酸化酵素 (Oxidases), 脱水素酵素 (Dehydrogenases), ペルオキシダーゼ (Peroxidases), ヒドロキシラーゼ (Hydroxylases), 酸素化酵素 (Oxygenases), 還元酵素 (Reductases) |
| 転移酵素 (Transferases) | 基質のグループ(メチル基、グリコシル基、リン酸基など)を一つの化合物(供与体)から別の化合物(受容体)へ転送します。 | A-B + C → A + B-C | キナーゼ (Kinases), リン酸化酵素 (Phosphorylases) |
| 加水分解酵素 (Hydrolases) | C-C、C-O、C-N などの共有結合を水の付加により加水分解します。 | R-X + H₂O → R-OH + HX | プロテアーゼ (Proteases), リパーゼ (Lipases) |
| 切断酵素 (Lyases) | 加水分解や酸化以外の手段で化学結合を切断し、二重結合を形成します。 | A-B → A + B | カルボキシラーゼ (Carboxylases), アミノ酸脱炭酸酵素 (Amino Acid Decarboxylases) |
| 異性化酵素 (Isomerases) | 分子内の官能基を移動させ、異性体の形態を生成します。 | A → B | ラセマーゼ (Racemases), ミュータース (Mutases), 異性化酵素 (Isomerases) |
| リガーゼ (Ligases) | ATPの加水分解に結びついた反応で、2つの分子を結合させます。 | A + B + ATP → AB + ADP + Pi | リガーゼ (Ligases), 合成酵素 (Synthase), 合成体 (Synthetase) |
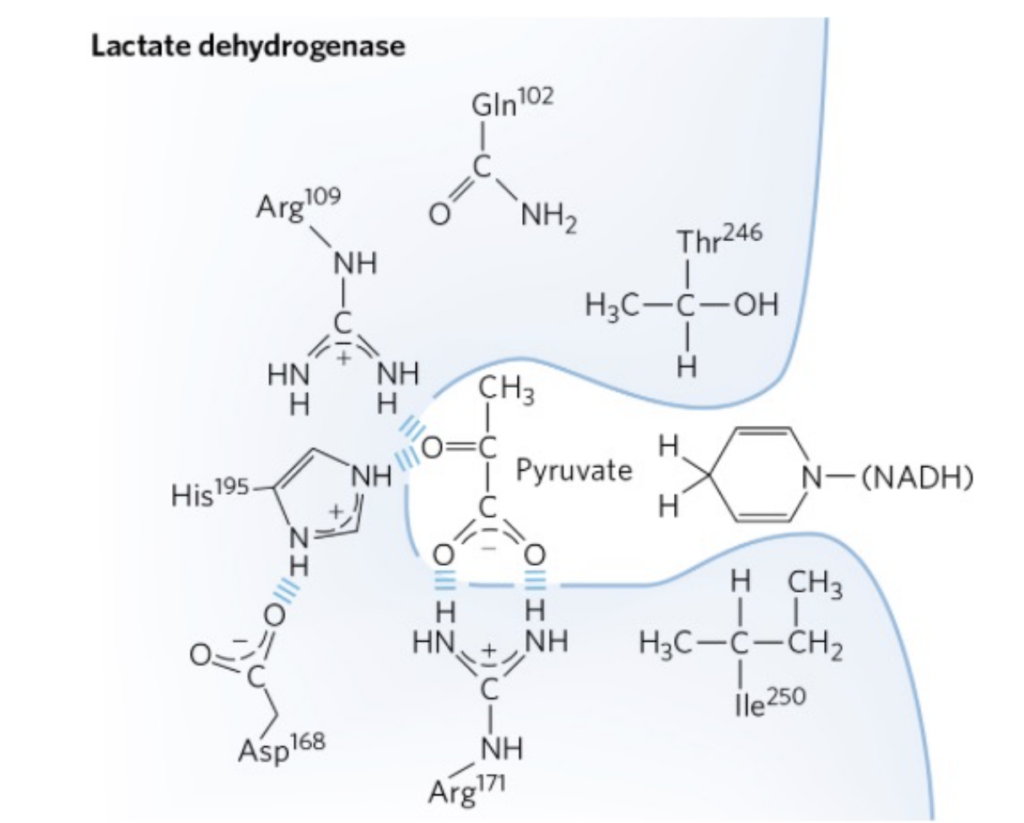
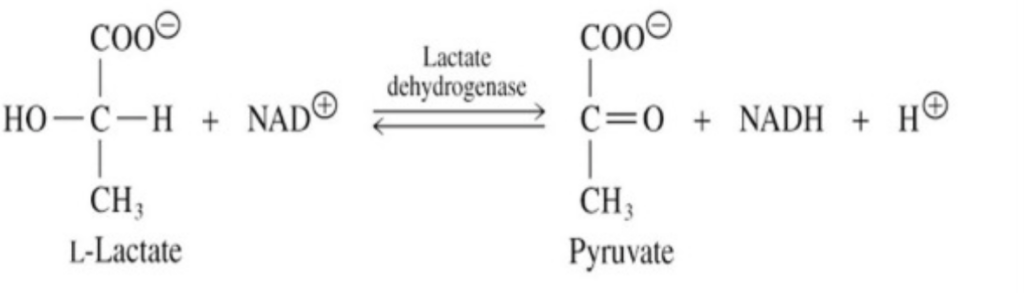
アイソザイム (Isozymes)
アイソザイムは、構造(アミノ酸配列)が異なるが、同じ反応を触媒する酵素の物理的に異なるバージョンです。これらは、同じ反応を触媒しますが、組織や生理的状況によって異なるアイソザイムが発現します。
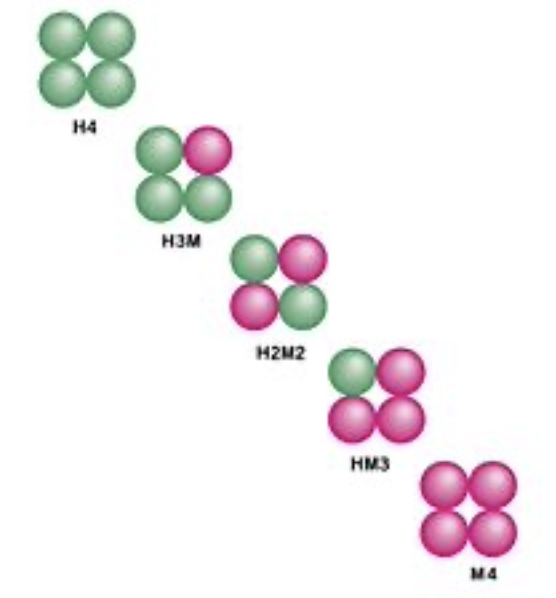
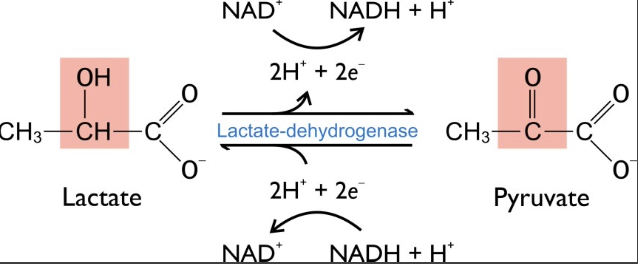
LDH(乳酸脱水素酵素)について
LDH (Lactate Dehydrogenase) は、ピルビン酸(解糖の最終産物)を乳酸に変換する酵素です。この変換は、酸素が不足している細胞で必要とされます。
LDHの5つのヒトアイソフォームがあります:
- LDH-1 (HHHH): 主に心臓と赤血球 (RBC) に存在します。
- LDH-2 (HHHM): 主に網内系 (Reticuloendothelial System) に存在します。
- LDH-3 (HHMM): 主に肺に存在します。
- LDH-4 (HMMM): 主に腎臓と胎盤に存在します。
- LDH-5 (MMMM): 主に肝臓に存在します。
血清中での主な形態は LDH-2 です。

酵素の分析と診断 (Analysis of Certain Enzymes and Diagnosis)
いくつかの酵素は細胞死や損傷の後に血漿に放出され、バイオマーカーとして利用されます。バイオマーカーは、特定の組織に影響を与える疾患の診断や予後を助ける分子です。
| 酵素 (Enzyme) | 主要診断用途 (Major Diagnostic Use) |
|---|---|
| アラニンアミノトランスフェラーゼ (ALT) | ウイルス性肝炎 (Viral hepatitis) |
| アミラーゼ (Amylase) | 急性膵炎 (Acute pancreatitis) |
| セルロプラスミン (Ceruloplasmin) | ヘパトレンティキュラー変性 (Wilson病) (Hepatolenticular degeneration, Wilson disease) |
| クレアチンキナーゼ (Creatine kinase) | 筋肉疾患 (Muscle disorders) |
| γ-グルタミルトランスフェラーゼ (γ-Glutamyltransferase) | 各種肝疾患 (Various liver diseases) |
| 乳酸脱水素酵素 (Lactate dehydrogenase) | 各種肝疾患 (Various liver diseases) |
| アイソザイム5 (Isozyme 5) | 急性膵炎 (Acute pancreatitis) |
| リパーゼ (Lipase) | ガウチャー病 (Gaucher disease) |
| β-グルコセレブロシダーゼ (β-Glucocerebrosidase) | 各種骨疾患、閉塞性肝疾患 (Various bone disorders, obstructive liver diseases) |
| アルカリフォスファターゼ (Phosphatase, alkaline) | 各種骨疾患、閉塞性肝疾患 (Various bone disorders, obstructive liver diseases) |
急性心筋梗塞 (AMI) の診断における酵素
急性心筋梗塞(AMI)の診断には以下の酵素が重要です:
- CK-MB: 心筋特異的なクレアチンキナーゼのアイソザイム。
- LDH: 乳酸脱水素酵素。心筋梗塞時に血清中のLDHアイソザイムのパターンが変わる。
- トロポニンIおよびT (Troponins I and T): 心筋の損傷を特異的に示す指標となる。
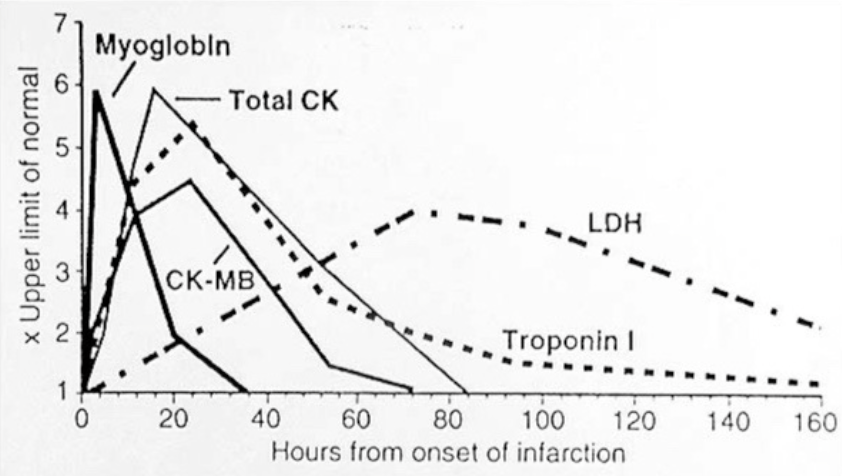
| マーカー (Marker) | 異常活性の検出時間 (Detectable (hr)) | 異常のピーク値 (Peak value of abnormality (hr)) | 異常の持続期間 (Duration of abnormality (days)) |
|---|---|---|---|
| CK-MB | 3-8 | 10-24 | 2-3 |
| LD | 8-12 | 72-144 | 8-14 |
| AST | 6-12 | 24-48 | 4-6 |
| ミオグロビン (MYOGLOBIN) | 1-3 | 6-9 | 1 |
| トロポニンI (TROPONIN I) | 3-8 | 24-48 | 3-5 |
| トロポニンT (TROPONIN T) | 3-8 | 72-100 | 5-10 |


コメント