Contents
- 1 教科書Ch30
- 1.1 細胞内カリウム分布の調整(Regulation of Internal Potassium Distribution)
- 1.2 カリウム分布に影響を与える要因
- 1.3 腸管におけるカルシウム吸収(Intestinal Calcium Absorption)
- 1.4 腎臓におけるカルシウム吸収(Calcium Reabsorption in the Kidneys)
- 1.5 腎臓でのカルシウム吸収に影響を与える因子(Factors Affecting Renal Regulation of Calcium)
- 1.6 カルシウム恒常性のホルモン調節(Hormonal Regulation of Calcium Homeostasis)
- 1.7 副甲状腺ホルモン(PTH)の役割(Role of Parathyroid Hormone, PTH)
- 1.8 PTHが血中カルシウム濃度を増加させるメカニズム(Mechanisms by which PTH increases Serum Calcium)
- 1.9 ビタミンDの命名法(Vitamin D Nomenclature)
- 2 図の解説
- 3 図からわかること
- 3.1 低カルシウム血症(Hypocalcemia)
- 3.2 高カルシウム血症(Hypercalcemia)
- 3.3 低カルシウム血症(Hypocalcemia)
- 3.4 高カルシウム血症(Hypercalcemia)
- 3.5 リンの体内貯蔵量
- 3.6 細胞外のリンの内訳
- 3.7 正常な血中リン濃度
- 3.8 カルシウム吸収の2つの主要メカニズム (Two Major Mechanisms for Calcium Absorption)
- 3.9 全体の解説 (日本語)
- 3.10 ネフロンにおけるリンの再吸収 (Phosphorus Reabsorption in the Nephron)
- 3.11 リンの吸収を減少させる因子
- 3.12 リンの吸収を増加させる因子
- 3.13 調節メカニズム
- 3.14 低リン血症(Hypophosphatemia)
- 3.15 リンの分画排泄率(Fractional Excretion of Phosphorus, FEPhos)
- 3.16 高リン血症(Hyperphosphatemia)
- 3.17 低リン血症(Hypophosphatemia)
- 3.18 体内のマグネシウムストレージ(Total body stores)
- 3.19 正常な血清マグネシウム濃度(Normal magnesium concentration)
- 3.20 血清マグネシウムの形態(Serum magnesium forms)
- 3.21 マグネシウムの機能(Functions of magnesium)
- 3.22 マグネシウム吸収を増加させる因子(Increase magnesium absorption)
- 3.23 マグネシウム吸収を減少させる因子(Decrease magnesium absorption)
- 3.24 高マグネシウム血症(Hypermagnesemia)
- 3.25 低マグネシウム血症(Hypomagnesemia)
- 3.26 フラクショナル排泄率(Fractional Excretion of Magnesium)
- 4 教科書31
- 4.1 酸(Acid)
- 4.2 塩基(Base)
- 4.3 酸と塩基の関係
- 4.4 体内のタンパク質と塩基(Bases)
- 4.5 アルカローシス(Alkalosis)
- 4.6 アシドーシス(Acidosis)
- 4.7 まとめ
- 4.8 pHの概念
- 4.9 pHのホームオスタシス(恒常性)
- 4.10 pHの異常とその影響
- 4.11 まとめ
- 4.12 揮発性酸(Volatile Acids)
- 4.13 非揮発性酸(Non-volatile Acids)
- 4.14 H⁺(水素イオン)の変動に対する防御機構
- 4.15 1. 体液の化学的緩衝剤(迅速だが一時的な対応)
- 4.16 2. 肺(迅速にCO₂を排出)
- 4.17 3. 腎臓(遅いが強力な調整)
- 4.18 体内の緩衝系(Buffer Systems)
- 4.19 1. 重炭酸塩緩衝系(Bicarbonate Buffer System)
- 4.20 2. リン酸緩衝系(Phosphate Buffer System)
- 4.21 3. アンモニア緩衝系(Ammonia Buffer System)
- 4.22 4. タンパク質緩衝系(Protein Buffer System)
- 4.23 まとめ
- 4.24 酸塩基バランスの障害(Disturbances of Acid-Base Balance)
- 4.25 1. 代謝性酸塩基障害(Metabolic Acid-Base Disorders)
- 4.26 2. 呼吸性酸塩基障害(Respiratory Acid-Base Disorders)
- 4.27 まとめ
- 4.28 1. 酸性血症(Acidosis)の場合
- 4.29 2. アルカリ血症(Alkalosis)の場合
- 4.30 診断: 混合性アルカローシス(Mixed Alkalosis)
- 4.31 解釈
- 4.32 診断: 混合性アルカローシス(Mixed Alkalosis)
- 4.33 ポイント
- 4.34 臨床的意義
教科書Ch30
来週のブロックテストカバーは全部


**細胞外液(Extracellular fluid)のカリウム濃度(Potassium concentration)**は通常 4.2 mEq/L です。
この濃度は、±0.3 mEq/L以内に収まることがほとんどです(つまり、大きな変動は珍しい)。
カリウム濃度の変化が重要なのは、多くの**細胞機能(Cell functions)**がその影響を受けるためです。たとえば、わずかな濃度変化でも、神経や筋肉の活動に影響を及ぼします。
**血漿中(Plasma)**のカリウム濃度が通常値より 3〜4 mEq/L増加すると、**心不整脈(Cardiac arrhythmias)**を引き起こす可能性があります。
これは、心臓の電気的な活動に影響を与えるためです。
さらに高い濃度では、**心停止(Cardiac arrest)や心室細動(Fibrillation)**といった重篤な状態になる可能性があります。これらの状態は生命を脅かします。
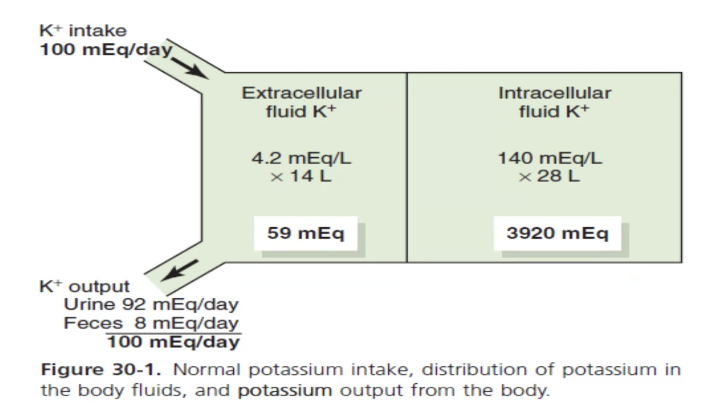
- **細胞内(Intracellular)と細胞外(Extracellular)**のカリウム濃度(Potassium concentration)の分布は非常に偏っています。
全身のカリウムのうち 98% が細胞内に存在し、細胞外液に存在するのは わずか2% に過ぎません。 - 例として、体重 70kg の成人では以下のように分布します:
- 細胞内液(Intracellular fluid): 約 28リットル(体重の40%)に約 3920 mEq のカリウムが含まれています。
- 細胞外液(Extracellular fluid): 約 14リットル(体重の20%)に約 59 mEq のカリウムが含まれています。
- さらに、**1回の食事(Single meal)**で摂取するカリウム量は 50 mEq に達することがあり、通常の1日摂取量(Daily intake)は 50~200 mEq/day です。
調整の難しさ(Difficulty in Regulation):
- 細胞外液は非常に少量のカリウムしか含まないため、食事で摂取されたカリウムを迅速に細胞外液から排除できなければ、高カリウム血症(Hyperkalemia)(血漿中カリウム濃度の上昇)を引き起こす可能性があります。これは生命を脅かす状況です。
- 逆に、細胞外液からわずかなカリウムが失われただけでも、適切で迅速な**代償反応(Compensatory responses)**がなければ、低カリウム血症(Hypokalemia)(血漿中カリウム濃度の低下)を引き起こす可能性があります。これも深刻な問題です。
細胞内カリウム分布の調整(Regulation of Internal Potassium Distribution)
食後のカリウム吸収
- カリウムの豊富な食事(野菜や果物など)を摂取すると、細胞外液中のカリウム濃度が危険なレベルまで上昇する可能性があります。
例:40 mEq のカリウムを摂取し、全量が細胞外液(14リットル)にとどまる場合、血漿カリウム濃度は 2.9 mEq/L 上昇します。 - 幸運にも、多くの摂取カリウムは細胞内(Intracellular)に迅速に移動し、腎臓が余剰分を排泄するまでの調整を行います。
- 食間には、細胞がカリウムを放出して腎臓の排泄とバランスを取ることで、血漿カリウム濃度がほぼ一定に保たれます。
カリウム分布に影響を与える要因
- インスリン(Insulin)
- インスリンは ナトリウム-カリウムATPアーゼ(Na+-K+ ATPase) を活性化し、カリウムを細胞内に取り込みます。
- 食後の細胞内カリウムの移動を促進する重要な役割を果たします。
- インスリン欠乏性糖尿病(Diabetes Mellitus) の場合、食後の血漿カリウム濃度上昇が通常より大きくなりますが、インスリン注射で高カリウム血症(Hyperkalemia)を改善できます。
- アルドステロン(Aldosterone)
- カリウム摂取の増加は アルドステロン分泌を刺激し、細胞内カリウムの取り込みを促進します。
- 過剰なアルドステロン分泌(Conn症候群) は低カリウム血症(Hypokalemia)を引き起こし、逆に アルドステロン欠乏(Addison病) は高カリウム血症を引き起こします。
- β-アドレナリン作動性刺激(β-Adrenergic Stimulation)
- カテコールアミン(Catecholamines)分泌(特にエピネフリン)は β2-アドレナリン受容体 を活性化し、カリウムを細胞内に移動させます。
- 一方、**β受容体遮断薬(例: プロプラノロール)**はカリウムを細胞外に移動させ、高カリウム血症を引き起こす可能性があります。
- 酸塩基平衡の異常(Acid–Base Abnormalities)
- 代謝性アシドーシス(Metabolic Acidosis): カリウムが細胞外に移動し、細胞外カリウム濃度が上昇します。
これは、Na+-K+ ATPaseの活動が低下し、カリウムの細胞内取り込みが減少するためです。 - 代謝性アルカローシス(Metabolic Alkalosis): カリウムが細胞内に移動し、低カリウム血症を引き起こす傾向があります。
- 代謝性アシドーシス(Metabolic Acidosis): カリウムが細胞外に移動し、細胞外カリウム濃度が上昇します。
- 細胞崩壊(Cell Lysis)
- 細胞破壊(筋肉損傷や赤血球溶解など)が起きると、大量のカリウムが細胞外液に放出され、高カリウム血症の原因となります。
- 激しい運動(Strenuous Exercise)
- 長時間の運動で骨格筋から細胞外液にカリウムが放出されます。
通常は軽度ですが、β遮断薬使用者やインスリン欠乏者では重大な高カリウム血症を引き起こす可能性があります。
- 長時間の運動で骨格筋から細胞外液にカリウムが放出されます。
- 細胞外液の浸透圧増加(Increased Extracellular Fluid Osmolarity)
- 細胞外液の浸透圧が上昇すると、水が細胞から細胞外に流出し、細胞内カリウム濃度が上昇します。これによりカリウムが細胞外に拡散し、血漿カリウム濃度が上昇します。
- 浸透圧が低下した場合は逆の効果が生じます。
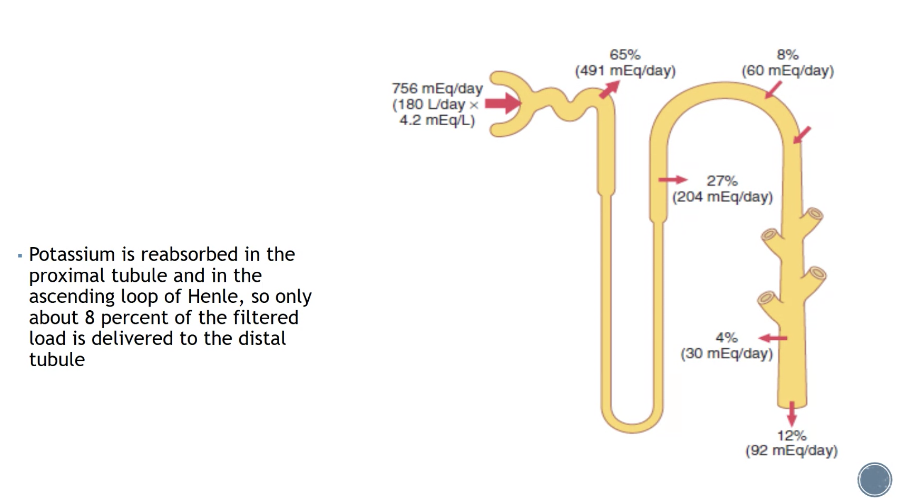
カリウム(Potassium)の再吸収は、腎臓(Kidney)の**近位尿細管(Proximal tubule)とヘンレの上行脚(Ascending loop of Henle)**で行われます。
- 近位尿細管では、大部分のカリウムが再吸収されます。
- ヘンレの上行脚では、さらにカリウムが再吸収されますが、その機構には**Na⁺-K⁺-2Cl⁻共輸送体(Na⁺-K⁺-2Cl⁻ cotransporter)**が関与します。
**遠位尿細管(Distal tubule)に到達するまでに、濾過されたカリウムの量(Filtered load)の約8%**のみが残ります。
つまり、カリウムは主に近位尿細管とヘンレのループで再吸収され、大部分が体内に戻されます。
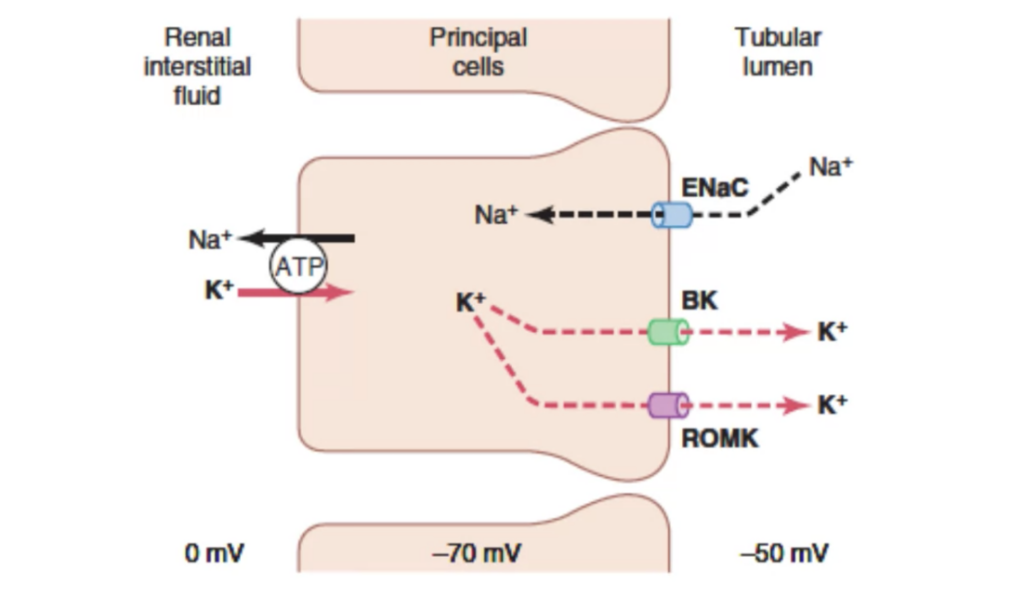
遠位尿細管後部および集合管の主細胞(Principal Cells)におけるカリウム分泌(Potassium Secretion)とナトリウム再吸収(Sodium Reabsorption)のメカニズム
- **主細胞(Principal cells)**は、遠位尿細管後部(Late distal tubule)および集合管(Collecting tubule)に存在し、カリウム分泌とナトリウム再吸収の重要な役割を担います。
1. ナトリウム再吸収(Sodium Reabsorption)
- ENaC(Epithelial Sodium Channel):
- 主細胞の管腔側(管内腔に接する側)に存在するナトリウムチャネルです。
- ナトリウムイオン(Na⁺)を尿細管内から細胞内に取り込みます。
- ナトリウムの細胞内取り込みにより、細胞内の負の電位が強化されます。この負の電位は、カリウム分泌を促進する重要な要因です。
2. カリウム分泌(Potassium Secretion)
- ROMK(Renal Outer Medullary Potassium Channel):
- 主細胞の管腔側に存在するカリウムチャネルです。
- 細胞内のカリウムイオン(K⁺)を尿細管内に放出します。
- ナトリウム再吸収によって生成される電気的勾配が、カリウム分泌を助長します。
- BKチャネル(“Big” Potassium Channel):
- 高いカリウム負荷や刺激がある場合に活性化されるチャネルです。
- ROMKに加えて、カリウムの追加的な分泌を可能にします。
3. ナトリウム-カリウムポンプ(Na⁺-K⁺ ATPase)
- 主細胞の基底膜側(血管側)に存在し、ナトリウムとカリウムの濃度勾配を維持する役割を果たします。
- 細胞内からナトリウムを血液中に排出。
- 血液中からカリウムを細胞内に取り込み。
- このポンプにより、細胞内のカリウム濃度が高く保たれ、分泌が効率よく行われます。
調整因子
- アルドステロン(Aldosterone):
- ENaCの発現と活性を増加させ、ナトリウム再吸収を促進。
- ROMKやBKチャネルの活性も増加させ、カリウム分泌を促進。

体内のカルシウム分布(Distribution of Calcium in the Body)
- 全体量(Total Body Content)
- **カルシウムの総量(Total body calcium)**は約 1,000~1,200 g に相当します。
- 骨(Bone)
- 体内カルシウムの99% は骨に存在します。
- このうち、約 1% が細胞外液(Extracellular fluid)と自由に交換可能(Freely exchangeable)です。
骨はカルシウムの主な貯蔵庫として、必要に応じて血漿カルシウム濃度を調整します。
- 細胞内(Intracellular)
- 体内カルシウムの約0.9% が細胞内に存在します。
- 細胞内カルシウム濃度は厳密に制御されており、酵素活性やシグナル伝達などの重要な細胞機能を担います。
- 細胞外液(Extracellular Fluid, ECF)
- 約0.1% のカルシウムが細胞外液中に存在します。
- 細胞外カルシウムは、生理的活動において非常に重要な役割を果たします。例:
- 筋収縮(Muscle contraction)
- 神経伝達(Neurotransmission)
- 血液凝固(Blood clotting)

血清カルシウムの化学的構造(Chemical Anatomy of Serum Calcium)
血清カルシウム濃度(Total Serum Calcium Concentration)
- 血清カルシウムの基準範囲は 8.4~10.2 mg/dL です。
- 血清カルシウムは、以下の3つの形態(コンパートメント)に分かれます。
1. イオン化カルシウム(Ionized Calcium, 48%)
- イオン化カルシウムは、生理的に活性を持つ形態で、次の機能に重要です:
- 筋収縮(Muscle Contraction)
- 血液凝固(Blood Coagulation)
- 細胞間接着(Intracellular Adhesion)
- 血液中での調整により、細胞外液の恒常性が維持されます。
2. タンパク質結合型カルシウム(Protein-Bound Calcium, 46%)
- 主に**アルブミン(Albumin)**と結合しています。
- **低アルブミン血症(Hypoalbuminemia)**があると、血清カルシウム値が実際より低く見える場合があります。
- 補正方法(Correction Formula): アルブミン濃度が4 g/dLを1単位下回るごとに、カルシウム濃度に 0.8 mg/dL を加算して補正します。
3. 無機化合物との複合体(Complexed Calcium, 7%)
- **クエン酸(Citrate)やリン酸(Phosphate)**などの無機化合物と結合して存在します。
- この形態は比較的少量ですが、体内での代謝過程に影響を与えます。
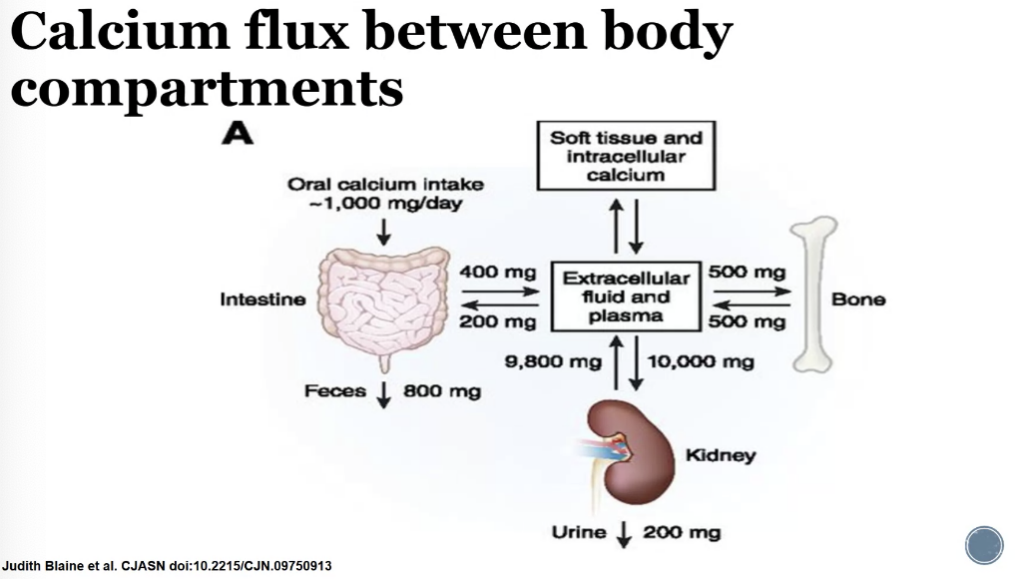
図の解説
- カルシウムの摂取と排泄:
- 私たちは、食事から1日に約1000mgのカルシウムを摂取します。
- 摂取されたカルシウムのうち、約400mgが腸から吸収され、体内に取り込まれます。
- 吸収されなかった残りの約800mgは、糞として体外に排出されます。
- 体内に吸収されたカルシウムは、腎臓を経由して尿として約200mgが排泄されます。
- 体内のカルシウムの分布:
- 体内に吸収されたカルシウムのほとんどが骨に蓄えられ、骨の強度を維持する役割を果たします。
- 骨以外の部分(軟組織や細胞内)にも少量のカルシウムが存在し、神経伝達や筋肉の収縮など、様々な生理機能に関わっています。
- 血液中のカルシウム濃度は一定に保たれており、骨と血液の間でカルシウムが常に移動しています。
- カルシウムの調節:
- 体内のカルシウム濃度は、副甲状腺ホルモンやカルシトリオール(ビタミンDの活性型)などのホルモンによって厳密に調節されています。
- カルシウム濃度が低下すると、これらのホルモンが分泌され、骨からのカルシウムの吸収を促進したり、腸からのカルシウムの吸収を増加させたりすることで、血液中のカルシウム濃度を上昇させます。
図からわかること
- カルシウムは、骨の形成や維持に不可欠な栄養素である。
- 腸からのカルシウムの吸収率は、年齢やビタミンDの摂取量などによって変化する。
- 腎臓は、体内のカルシウムバランスを維持する上で重要な役割を果たしている。

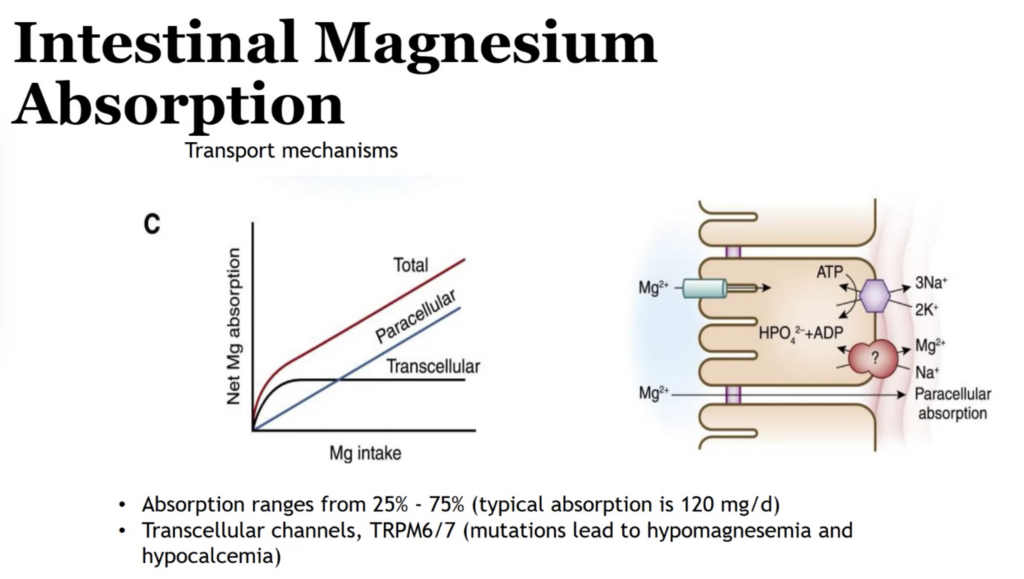
腸管におけるカルシウム吸収(Intestinal Calcium Absorption)
カルシウム吸収は腸管で行われ、主に2つの機構に分かれます。
1. 細胞間輸送(Paracellular Transport)
- 受動的(Passive): 細胞と細胞の間をカルシウムが通過する。
- メカニズム: 濃度勾配に依存する単純拡散。エネルギーは必要ありません。
- 特徴:
- **カルシウム摂取量が多い場合(High intake)**に定量的な寄与が大きい。
- 主に小腸後半(回腸)で優位。
2. 細胞内輸送(Transcellular Transport)
- 能動的(Active): 細胞内を通過する。
- 主に小腸上部(十二指腸)で優位。
機構詳細
- 小腸絨毛(Microvilli)での取り込み
- **カルシトリオール(Calcitriol, 活性型ビタミンD)**の影響を受ける。
- 微絨毛に存在するカルシウムチャネルを介して細胞内にカルシウムが取り込まれる。
- 細胞内移動
- カルビンジン(Calbindin):
- 細胞内のカルシウム結合タンパク質。
- 微絨毛のカルシウム濃度を低下させ、輸送効率を高める役割を持つ。
- カルシトリオールによって産生が促進される。
- カルビンジン(Calbindin):
- 細胞外への輸送(Exocytosis)
- アクチン(Actin)、ミオシン(Myosin)、カルモジュリン(Calmodulin)が関与する機構によって、カルシウムは細胞外に排出されます。

以下に、腎臓におけるカルシウムの調節(Renal Regulation of Calcium)について解説します。
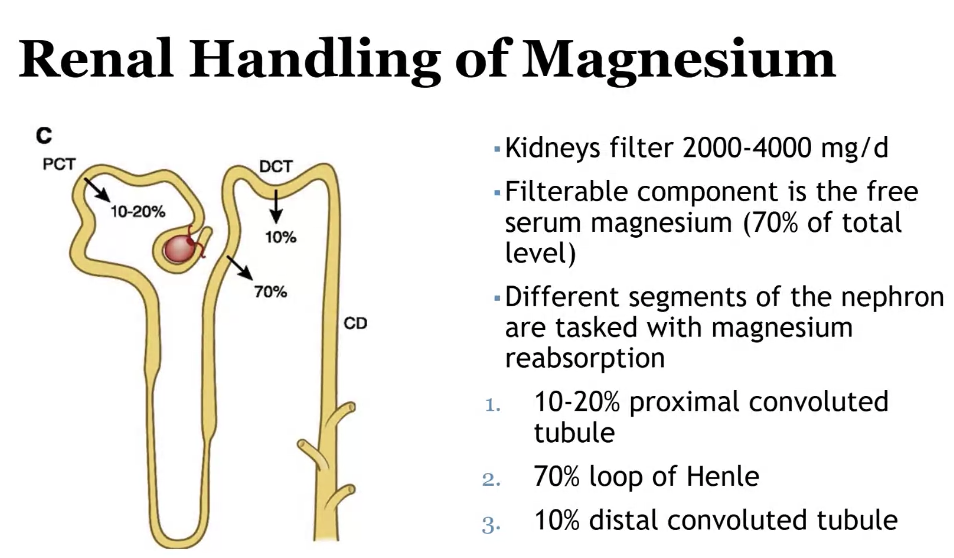
腎臓におけるカルシウム吸収(Calcium Reabsorption in the Kidneys)
1. フィルタリングと吸収
- 腎臓は1日に約10 gのカルシウムを濾過します(Filtered load)。
- しかし、通常はそのうち200 mgのみが尿中に排出され、**98~99%**のカルシウムが再吸収されます。
2. 再吸収の部位と割合
カルシウムは腎臓の異なる部位で段階的に再吸収されます:
- 近位尿細管(Proximal Tubule)
- **65%**程度のカルシウムが再吸収されます。
- 主に**受動輸送(Paracellular Transport)**による。
- ナトリウムや水の再吸収に伴い、カルシウムも一緒に再吸収されます。
- ヘンレの上行脚(Thick Ascending Limb of Henle’s Loop)
- **20~25%**が再吸収されます。
- 電気化学的勾配に依存し、パラセル輸送と部分的に能動輸送が関与します。
- 遠位尿細管(Distal Tubule)
- **5~10%**が再吸収されます。
- **能動輸送(Transcellular Transport)**による。
- この過程は**副甲状腺ホルモン(PTH: Parathyroid Hormone)**によって調節されます。
- 集合管(Collecting Duct)
- 残りのわずかな量が再吸収されます。
3. 調節因子
- 副甲状腺ホルモン(PTH):
- 遠位尿細管でのカルシウム再吸収を増加させます。
- カルシトリオール(Calcitriol, 活性型ビタミンD):
- 遠位尿細管および集合管での再吸収を促進します。
- カルシトニン(Calcitonin):
- 高カルシウム血症時に、カルシウム排泄を増加させます。

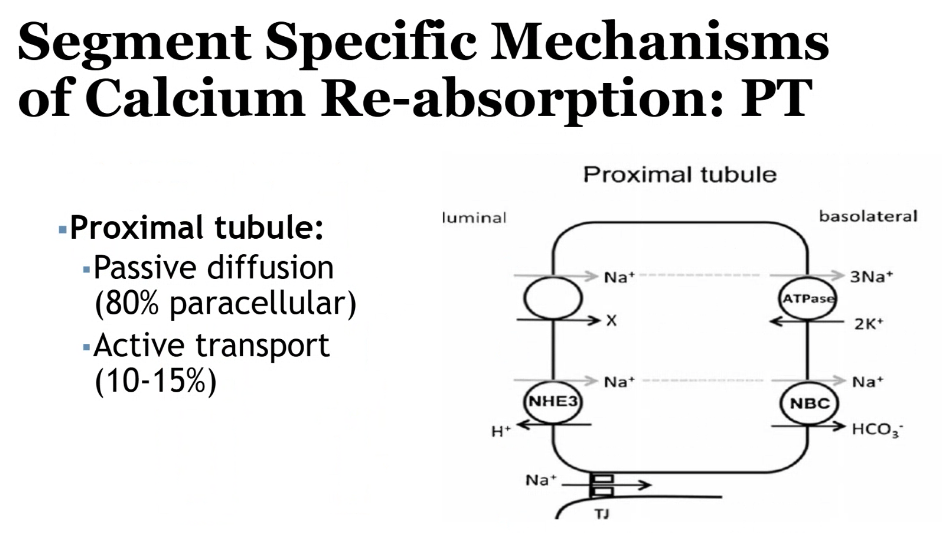
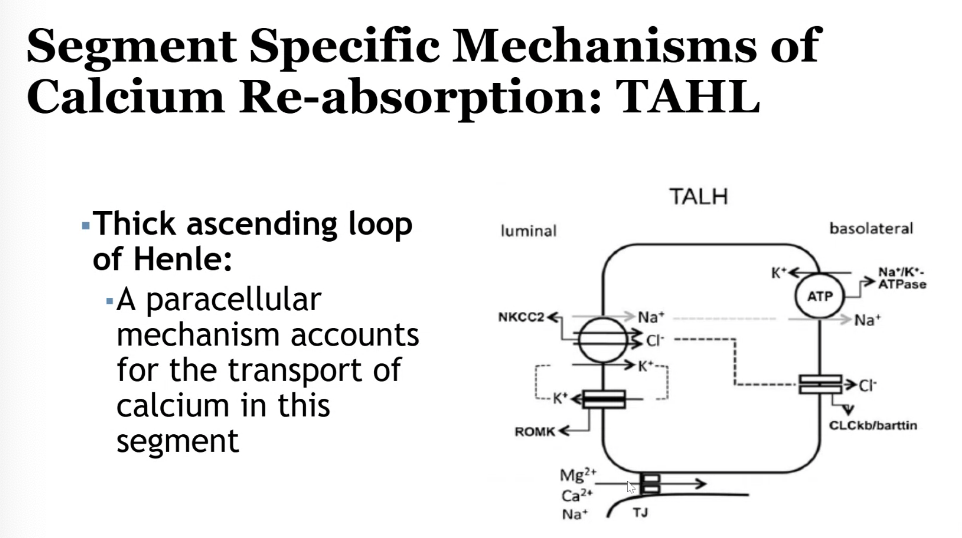
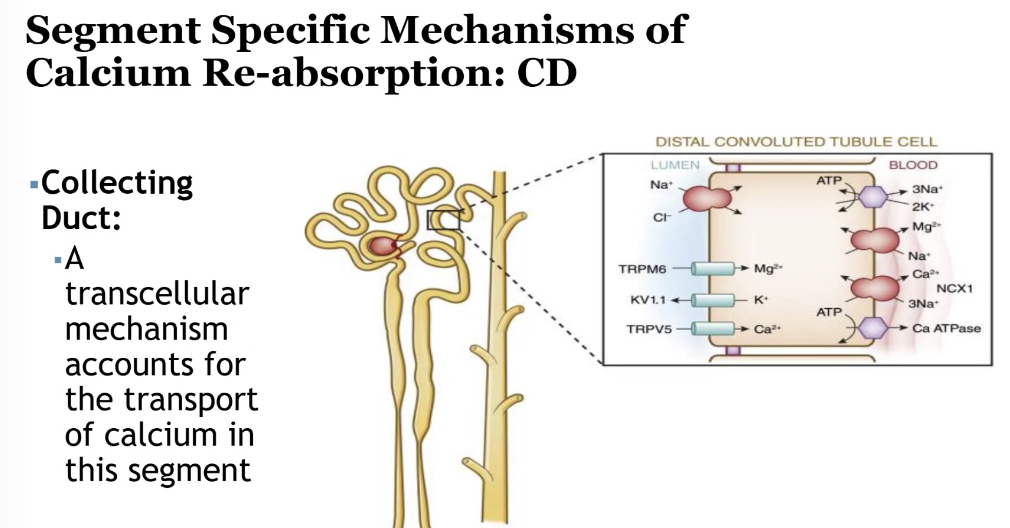


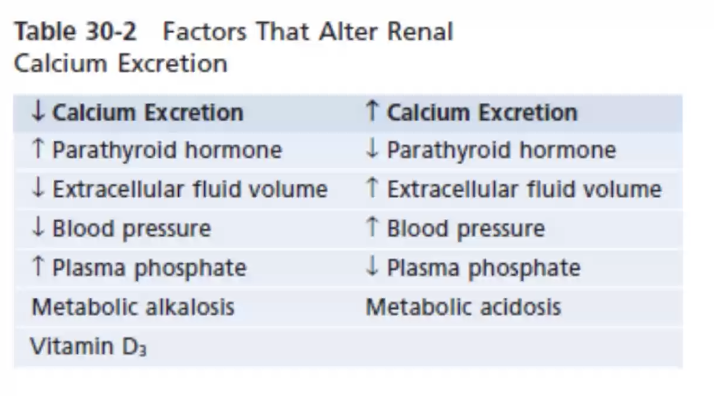
腎臓でのカルシウム吸収に影響を与える因子(Factors Affecting Renal Regulation of Calcium)
カルシウム吸収を増加させる因子(Increase Calcium Absorption)
- 副甲状腺機能亢進症(Hyperparathyroidism)
- **副甲状腺ホルモン(PTH)**が増加し、腎臓でのカルシウム再吸収を促進します。
- カルシトリオール(Calcitriol)
- 活性型ビタミンDが遠位尿細管でのカルシウム再吸収を増加させます。
- 低カルシウム血症(Hypocalcemia)
- 血中カルシウム濃度が低下すると、PTH分泌が刺激され、カルシウム吸収が増加します。
- 体液収縮(Volume Contraction)
- ナトリウムと水の再吸収が増加し、それに伴いカルシウムも再吸収されます。
- 代謝性アルカローシス(Metabolic Alkalosis)
- アルカローシスでは、カルシウムの尿中排泄が減少します。
- サイアザイド系利尿薬(Thiazide Diuretics)
- 遠位尿細管でのカルシウム再吸収を増加させます。
カルシウム吸収を減少させる因子(Decrease Calcium Absorption)
- 副甲状腺機能低下症(Hypoparathyroidism)
- PTH分泌の低下により、カルシウム吸収が減少します。
- 低カルシトリオール濃度(Low Calcitriol Levels)
- 活性型ビタミンD不足により、カルシウム再吸収が抑制されます。
- 高カルシウム血症(Hypercalcemia)
- 負のフィードバックで腎臓でのカルシウム吸収が低下します。
- 細胞外液量の拡張(Extracellular Fluid Expansion)
- ナトリウムと水の排泄が増加し、それに伴いカルシウム排泄も増加します。
- 代謝性アシドーシス(Metabolic Acidosis)
- アシドーシスでは、尿中へのカルシウム排泄が増加します。
- ループ利尿薬(Loop Diuretics)
- ヘンレのループでのカルシウム再吸収を抑制します。

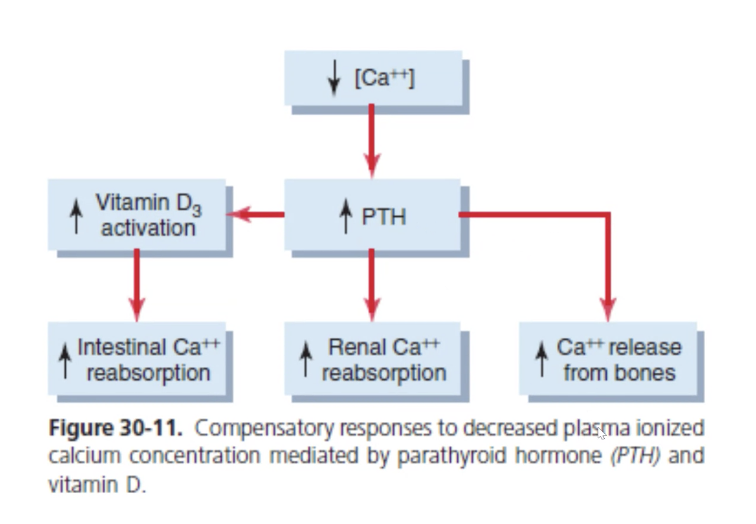
カルシウム恒常性のホルモン調節(Hormonal Regulation of Calcium Homeostasis)
関与するホルモン(Involved Hormones)
- 副甲状腺ホルモン(PTH)
- **副甲状腺(Parathyroid Glands)**で産生されます。
- 低カルシウム血症時に分泌が増加し、以下のようにカルシウム濃度を調整します:
- 骨からのカルシウム放出促進。
- 腎臓でのカルシウム再吸収増加。
- カルシトリオール産生の促進。
- カルシトリオール(Calcitriol, 活性型ビタミンD)
- **腎臓(Kidneys)**で産生されます。
- 小腸でのカルシウム吸収促進、骨からのカルシウム放出、腎臓での再吸収を助けます。
作用する3つの臓器(Actions in Three Organs)
- 骨(Bone)
- カルシウムを貯蔵する場所であり、必要に応じて放出を行います。
- 腸(Intestine)
- カルシトリオールの作用でカルシウム吸収を促進します。
- 腎臓(Kidneys)
- カルシウムの再吸収を調整し、尿中排泄を制御します。
カルシウム感知受容体(Calcium Sensing Receptor, CaSR)
- 腎臓および副甲状腺に存在し、カルシウム濃度の変化を感知する主要なセンサーです。
- フィードバックループを調整し、カルシウム恒常性を維持します。


副甲状腺ホルモン(PTH)の役割(Role of Parathyroid Hormone, PTH)
カルシウム濃度の主要な生理的調節因子
- **副甲状腺ホルモン(PTH)**は、血中カルシウム濃度を調整するための重要なホルモンです。
- 副甲状腺(Parathyroid Glands)から分泌され、主に低カルシウム血症(hypocalcemia)、高リン血症(hyperphosphatemia)、および**カルシトリオール(calcitriol)**によって刺激されます。
刺激メカニズム
- **カルシウム感知受容体(Calcium Sensing Receptor, CaSR)**が血中カルシウム濃度を感知し、PTHの分泌を調節します。
- 血中カルシウム濃度が低下するとPTHの分泌が増加し、カルシウム濃度を上げる作用を持つメカニズムが活性化されます。
- PTHの発現は副甲状腺で厳密に調節されており、**翻訳(translation)および転写(transcription)**レベルで細かく制御されています。
PTHが血中カルシウム濃度を増加させるメカニズム(Mechanisms by which PTH increases Serum Calcium)
PTHは以下の3つの主要なメカニズムによって血中カルシウム濃度を増加させます:
1. 骨吸収の促進(Stimulates Bone Resorption)
- **骨(Bone)**からカルシウムとリンが放出されることにより、血中カルシウム濃度が上昇します。
- PTHは骨を破壊する**破骨細胞(osteoclasts)**を活性化し、カルシウムを血中に放出させます。
2. 腸管におけるカルシウムおよびリンの吸収促進(Enhances Intestinal Absorption of Calcium and Phosphorus)
- PTHは腎臓での**カルシトリオール(calcitriol)**の産生を促進します。
- カルシトリオールは腸管でのカルシウムおよびリンの吸収を促進し、血中のカルシウム濃度を増加させます。
3. 腎臓でのカルシウム再吸収の促進(Augments Renal Calcium Reabsorption)
- PTHは腎臓でのカルシウム再吸収を増加させ、カルシウムの排泄を減少させます。
- 特に**近位尿細管(proximal tubule)と遠位尿細管(distal tubule)**で再吸収が促進され、尿中のカルシウム排泄が減少します。

ビタミンDの命名法(Vitamin D Nomenclature)
1. ビタミンD(Vitamin D)
- ビタミンDは、主に2つの形態が存在します:
- コレカルシフェロール(cholecalciferol):紫外線(UV放射線)によって皮膚で合成されます。
- エルゴカルシフェロール(ergocalciferol):主に食事から摂取されます。
2. 25-ヒドロキシビタミンD(25-Hydroxyvitamin D)
- **25-ヒドロキシビタミンD(25(OH)D)**は、ビタミンDが肝臓で25位で水酸化されて生成される代謝産物です。
- 別名:
- **エルゴカルシジオール(ergocalcidiol)またはカルシジオール(calcidiol)**としても知られています。
3. カルシトリオール(Calcitriol)
- **カルシトリオール(1,25(OH)₂D)**は、ビタミンDの最も活性な形態で、腎臓で1位で水酸化されて生成されます。
- 略称:1,25(OH)₂D。
4. ビタミンD類似体(Vitamin D Analogs)
- **ビタミンD類似体(vitamin D analogs)**は、ビタミンDから誘導された合成化合物です。
- 臨床で調査されている合成ビタミンD類似体には以下が含まれます:
- ドキセカルシフェロール(doxercalciferol)
- パリカルシトール(paricalcitol)
- アルファカルシジオール(alfacalcidol)
- ファレカルシトリオール(falecalcitriol)
- 22-オキサカルシトリオール(maxacalcitol)
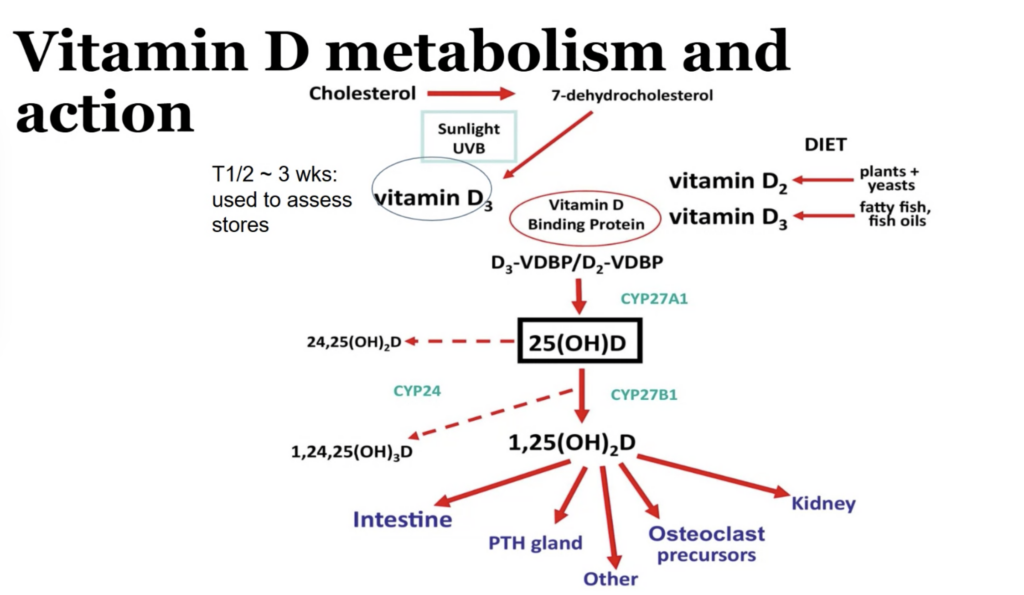
この図は、ビタミンDの代謝と作用について簡潔にまとめたものです。ビタミンDは、カルシウムの吸収を促進し、骨の健康維持に不可欠な栄養素です。この図を見ることで、ビタミンDが体内でどのように作られ、どのように作用しているのかを理解することができます。
図の解説
ビタミンDの生成
- 皮膚での生成: 太陽光(UVB)を浴びることで、皮膚内のコレステロールからビタミンD3が生成されます。
- 食事からの摂取: 食事で摂取するビタミンD2(植物、酵母)やビタミンD3(魚、魚油)も、ビタミンDの供給源となります。
ビタミンDの輸送と活性化
- ビタミンD結合タンパク質 (VDBP): 生成されたビタミンDは、VDBPと結合して血液中を運ばれます。
- 肝臓での活性化: 肝臓で25-ヒドロキシビタミンD(25(OH)D)に変換され、これが血中濃度で最も多い形態です。
- 腎臓での活性化: 腎臓で1,25-ジヒドロキシビタミンD(1,25(OH)2D)に変換され、これが最も活性のある形態です。
ビタミンDの作用
- 腸: 1,25(OH)2Dは、腸管でのカルシウム吸収を促進します。
- 骨: 骨へのカルシウム沈着を促進し、骨の強度を維持します。
- 副甲状腺: 副甲状腺ホルモン(PTH)の分泌を抑制します。
- その他: 免疫機能の調節、細胞増殖の制御など、様々な生理作用に関わっています。
図中の用語解説
- CYP27A1, CYP27B1, CYP24: ビタミンDの代謝に関わる酵素
- PTH: 副甲状腺ホルモン
- Osteoclast precursors: 破骨細胞の前駆細胞
図からわかること
- ビタミンDは、太陽光を浴びることで体内で生成されるだけでなく、食事からも摂取できる。
- ビタミンDは、肝臓と腎臓で活性化され、その活性型が様々な生理作用を示す。
- ビタミンDは、カルシウムの恒常性維持に重要な役割を果たしている。

カルシウムのバランスに変化があると、臨床的に重要な影響を及ぼすことがあります。以下に、**低カルシウム血症(Hypocalcemia)と高カルシウム血症(Hypercalcemia)**について説明します。
低カルシウム血症(Hypocalcemia)
低カルシウム血症は、血中カルシウム濃度が低くなる状態で、以下の原因があります:
1. 副甲状腺ホルモン(PTH)の欠乏
- **遺伝性または後天性の副甲状腺機能低下症(Hypoparathyroidism)**が原因で、PTHが不足し、カルシウムの再吸収が低下します。
2. ビタミンDの欠乏
- ビタミンD不足により、腸でのカルシウム吸収が減少し、血中カルシウム濃度が低下します。
3. カルシウムの過剰な複合(カルシウム複合体の形成)
- **横紋筋融解症(rhabdomyolysis)や膵炎(pancreatitis)**では、細胞内からカルシウムが外部に放出され、その結果、カルシウムが他の物質と複合して、血中カルシウム濃度が低下します。
4. カルシウム感知受容体(CaSR)の障害
- **カルシウム感知受容体(CaSR)**に異常がある場合、カルシウムの調節に問題が生じ、低カルシウム血症を引き起こすことがあります。
高カルシウム血症(Hypercalcemia)
高カルシウム血症は、血中カルシウム濃度が高くなる状態で、以下の原因があります:
1. PTHの過剰分泌
- **原発性副甲状腺機能亢進症(Primary Hyperparathyroidism)**により、副甲状腺ホルモン(PTH)が過剰に分泌され、骨からカルシウムが過剰に放出されます。
2. ビタミンDの過剰(カルシトリオールの過剰)
- **ビタミンD中毒(vitamin D intoxication)やサルコイドーシス(sarcoidosis)**では、カルシウムの腸管吸収が増加し、高カルシウム血症を引き起こします。
3. 骨からのカルシウムの過剰な放出
- **腫瘍性高カルシウム血症(humoral hypercalcemia of malignancy)**では、腫瘍から分泌される物質が骨のカルシウムを放出させ、血中カルシウム濃度が上昇します。
4. 腸管でのカルシウム吸収の増加
- **乳製品の過剰摂取(milk alkali syndrome)**により、カルシウム吸収が増加し、高カルシウム血症を引き起こすことがあります。
5. 腎臓でのカルシウム排泄の低下
- **チアジド系利尿薬(thiazides)**は、腎臓でのカルシウム排泄を減少させ、カルシウム濃度が上昇します。
6. カルシウム感知受容体(CaSR)の障害
- **カルシウム感知受容体(CaSR)**に異常がある場合、カルシウムの過剰が生じ、血中カルシウム濃度が上昇します。

カルシウム濃度の異常は、さまざまな臨床症状を引き起こすことがあります。以下に、低カルシウム血症(Hypocalcemia)と高カルシウム血症(Hypercalcemia)の症状について説明します。
低カルシウム血症(Hypocalcemia)
低カルシウム血症では、カルシウム濃度が低下することによって神経筋の興奮性が増し、以下のような症状が現れます:
軽度の低カルシウム血症
- 無症状のことが多いです。
大きな変化に伴う症状
- 神経筋の過剰な興奮により、以下の症状が現れることがあります:
- 口唇周囲のしびれ(Perioral paresthesias)
- 口唇や指先、足先などにしびれ感が生じる。
- 手足の痙攣(Carpopedal spasms)
- 手や足の筋肉が収縮して痙攣を起こすことがあります。
- トルソー徴候(Trousseau sign)
- 手首に血圧計を巻き、圧迫を加えることで手足が痙攣する現象です。
- ショヴステック徴候(Chvostek sign)
- 顔面神経(特に耳の前方)を軽く叩くと、顔の筋肉が反応して引きつる現象です。
- 口唇周囲のしびれ(Perioral paresthesias)
高カルシウム血症(Hypercalcemia)
高カルシウム血症では、カルシウム濃度が過剰になり、さまざまな臓器に影響を与えます。主な症状には以下のものがあります:
- 消化器症状
- 吐き気、嘔吐(Nausea, Vomiting)
- 便秘(Constipation)
- 神経症状
- 集中力の低下(Difficulty concentrating)
- 傾眠(Lethargy)
- エネルギーが低下し、眠気や無気力を感じることがあります。
- 筋肉の症状
- 筋力低下(Muscle weakness)
- 筋肉が弱くなり、身体を動かすことが難しくなることがあります。
- 筋力低下(Muscle weakness)
- 心血管症状
- 高血圧(Hypertension)
- QT間隔の短縮(Shortening QT interval)
- 心電図でQT間隔が短くなることがあり、心臓のリズムに異常をきたすことがあります。
- 腎機能への影響
- 尿濃縮障害(尿崩症、Diabetes insipidus)
- 腎臓での水の再吸収が障害され、尿が多く、薄くなることがあります。
- 尿濃縮障害(尿崩症、Diabetes insipidus)

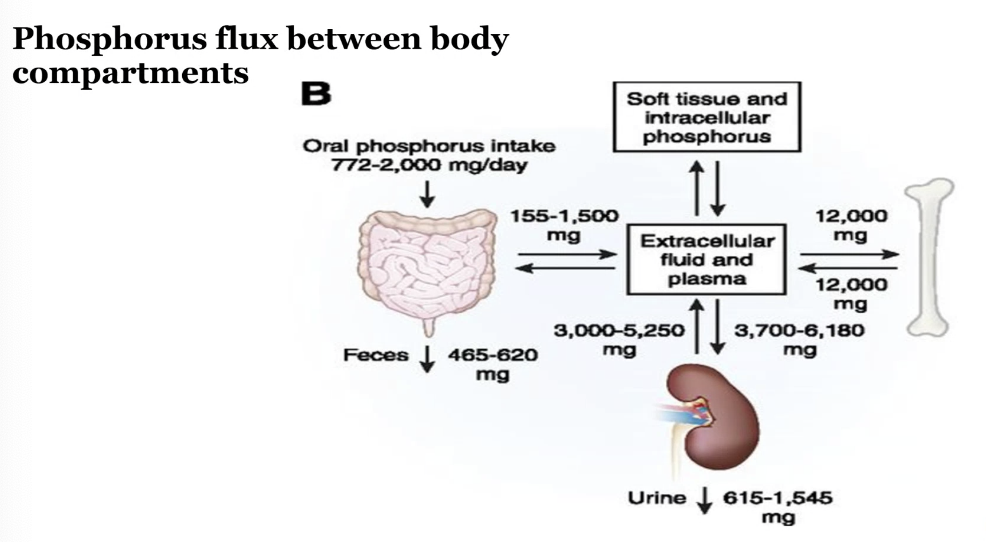
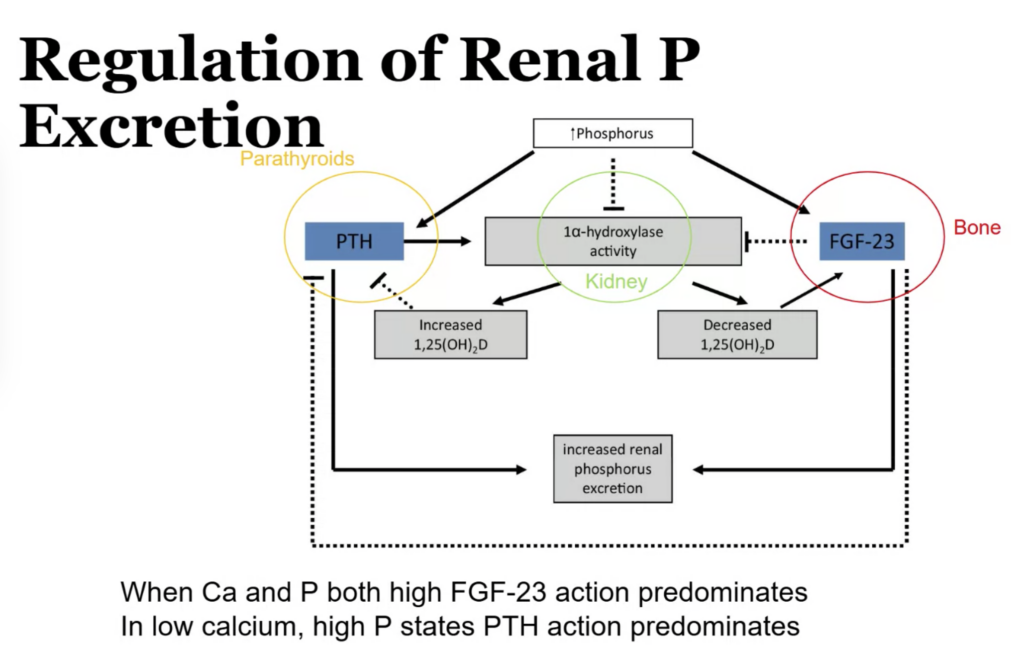
リン(Phosphorus)の貯蔵量と血中濃度について
リンは体内で重要な役割を果たしており、その大部分は骨に蓄えられています。以下は、リンの貯蔵場所と血中濃度に関する情報です。
リンの体内貯蔵量
- 総体内量: 約700g
- 85% は骨に存在
- 14% は細胞内に存在
- 1% は細胞外液に存在
細胞外のリンの内訳
- **細胞外液中のリンの70%は有機リン(organic phosphorus)として存在し、残りの30%**は無機リン(inorganic phosphorus)です。
- 無機リンの内訳:
- 15% はタンパク質に結合(protein-bound)
- 85% はカチオンと複合しているか、遊離状態で存在(化学分析で測定されるリン)
- 無機リンの内訳:
正常な血中リン濃度
- 正常値: 2.5〜4.5 mg/dL
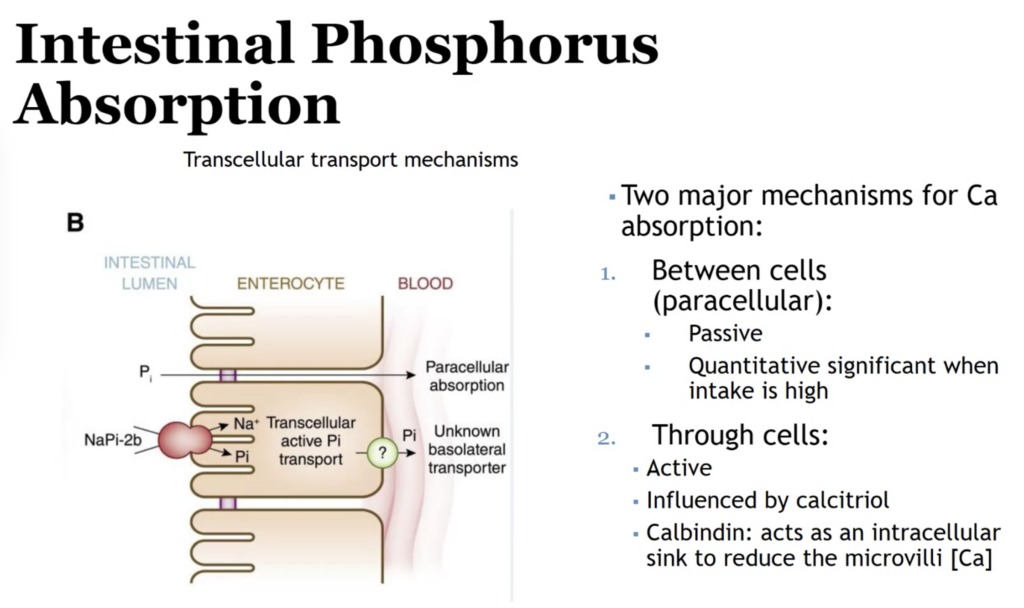
カルシウム吸収の2つの主要メカニズム (Two Major Mechanisms for Calcium Absorption)
カルシウムの吸収は、腸管で主に以下の2つのメカニズムによって行われます。
1. 細胞間経路 (Paracellular Pathway)
- 特徴:
- 受動的 (Passive) なメカニズムにより、カルシウムが腸管上皮細胞の間を通過して吸収されます。
- この経路は、カルシウム摂取量が多いときに特に重要です。
- 細胞間結合の透過性に依存しており、主に濃度勾配に基づいています。
2. 細胞内経路 (Transcellular Pathway)
- 特徴:
- 能動的 (Active) なメカニズムです。
- カルシトリオール (Calcitriol) の影響を受けて、効率的にカルシウムを吸収します。
- 吸収の流れ:
- 微絨毛 (Microvilli) を介してカルシウムが細胞内に取り込まれる。
- 細胞内で、カルビンディン (Calbindin) がカルシウムを結合して一時的に保持し、細胞内のカルシウム濃度を低下させることで吸収の効率を高める。
- 細胞の基底側からカルシウムが排出され、血液に取り込まれる(主にATP駆動型CaポンプやNa+/Ca2+交換体による)。
全体の解説 (日本語)
腸管でのカルシウム吸収には、摂取量やホルモンの影響が重要です。
- 摂取量が多い場合:受動的な「細胞間経路」が優位となり、カルシウムは濃度勾配に従って吸収されます。
- 摂取量が少ない場合:能動的な「細胞内経路」が活性化され、カルシトリオールがカルシウム吸収を強化します。
カルビンディンのような結合タンパク質が、細胞内のカルシウム濃度を低く保つことで、吸収効率を向上させる役割を果たします。
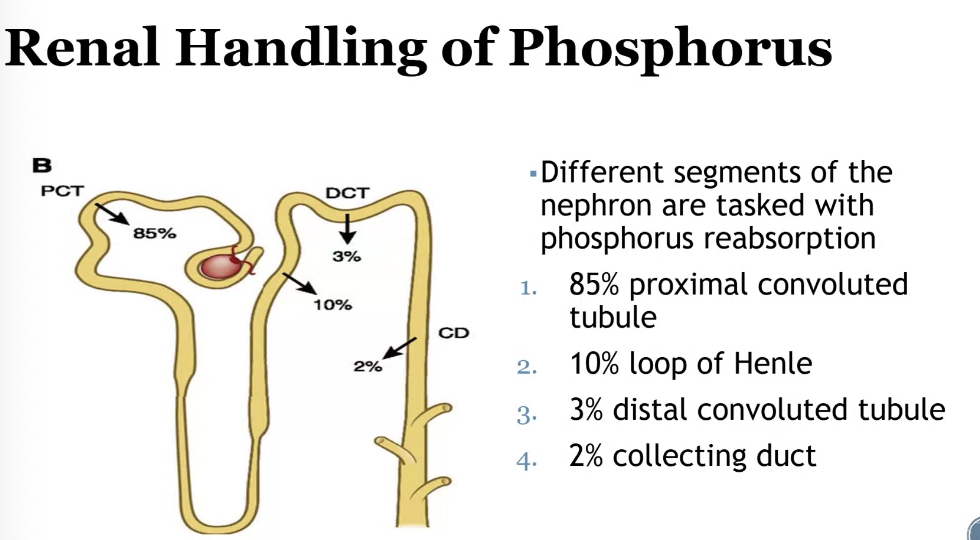
ネフロンにおけるリンの再吸収 (Phosphorus Reabsorption in the Nephron)
腎臓内のネフロンの異なる部位が、リンの再吸収を担当しています。それぞれの割合と特徴を以下に示します。
1. 近位尿細管 (Proximal Convoluted Tubule)
- 再吸収割合: 約85%
- 説明:
- 主なリン再吸収の場です。
- ナトリウム-リン共輸送体(NaPi cotransporters)を介して再吸収が行われます。
- ホルモン(例: パラソルモン(PTH))や食事中のリンの摂取量によって調節されます。
2. ヘンレのループ (Loop of Henle)
- 再吸収割合: 約10%
- 説明:
- 特に皮質部(cortical segments)でリンの再吸収が行われます。
- この部位での再吸収は、近位尿細管に比べると限定的です。
3. 遠位尿細管 (Distal Convoluted Tubule)
- 再吸収割合: 約3%
- 説明:
- リン再吸収の残りの一部を担いますが、その役割は小さいです。
- 主に他のイオン(カルシウムやナトリウム)の調節が優先される部位です。
4. 集合管 (Collecting Duct)
- 再吸収割合: 約2%
- 説明:
- リンの再吸収は最小限であり、主にリンの排泄調節が行われる部位です。
- 他のイオン(ナトリウムや水素イオン)の交換による間接的な影響を受けます。


リンの腎臓での調節に影響を与える因子
腎臓でのリンの吸収と排泄は、さまざまな因子によって調節されます。以下に、リンの吸収を増加させる要因と減少させる要因を示します。
リンの吸収を減少させる因子
- 副甲状腺ホルモン(PTH)
- PTHはリンの再吸収を抑制し、尿中への排泄を促進します。
- ホスファトニン(Phosphatonins)(例: FGF23)
- FGF23はリンの吸収を減少させ、腎臓でのリンの排泄を増加させる働きがあります。
- 高リン食(High-phosphate diet)
- 食事中のリンが過剰な場合、腎臓はリンの吸収を減少させます。
- 代謝性アシドーシス(Metabolic acidosis)
- 体内が酸性に傾くと、腎臓でのリンの再吸収が抑制されます。
- カリウム欠乏(Potassium deficiency)
- 低カリウム血症は、リンの再吸収を減少させることがあります。
- グルココルチコイド(Glucocorticoids)
- ステロイドホルモン(グルココルチコイド)はリンの吸収を抑制する作用があります。
- ドパミン(Dopamine)
- ドパミンは腎臓でのリンの吸収を減少させる可能性があります。
- 高血圧(Hypertension)
- 高血圧もリンの再吸収に影響を与えることがあります。
- エストロゲン(Estrogen)
- エストロゲンはリンの吸収を減少させることがあるとされています。
リンの吸収を増加させる因子
- 1,25-ビタミンD(Calcitriol)
- ビタミンDの活性型である1,25-ジヒドロキシビタミンDは、腸管や腎臓でのリンの吸収を促進します。
- 甲状腺ホルモン(Thyroid hormone)
- 甲状腺ホルモンは腎臓でのリンの吸収を増加させる作用があります。
- 低リン食(Low-phosphate diet)
- 食事中のリンが少ない場合、腎臓はリンの吸収を抑制します。
調節メカニズム
リンの腎臓での調節は、主に**ナトリウム-リン共輸送体(sodium-phosphate cotransporters)**の量を変化させることによって行われます。これらの輸送体の量は、上記のホルモンや食事の影響を受けて変化します。

リンのバランスの臨床的変化
リンの異常は、さまざまな病状や身体の反応によって引き起こされることがあります。以下に、低リン血症(Hypophosphatemia) と**高リン血症(Hyperphosphatemia)**に関する主な原因とメカニズムを示します。
低リン血症(Hypophosphatemia)
リンの血中濃度が低くなる状態です。以下の要因が低リン血症を引き起こす可能性があります。
細胞内への移行(Shift into cells)
- 呼吸性アルカローシス(Respiratory alkalosis)
- 呼吸性アルカローシスは血液中の二酸化炭素が減少し、pHが上昇することで、リンが細胞内に移動することを引き起こします。
- 呼吸性アルカローシスにおいてリン(主に無機リン酸)が細胞内に移動する理由は、血液中のpHが上昇(アルカローシス)することによる以下のメカニズムに関連しています。
- アルカローシスによる血液pHの上昇
呼吸性アルカローシスでは、過換気(過剰な呼吸)によって二酸化炭素(CO₂)が排出され、血液中のCO₂濃度(PCO₂)が低下します。
CO₂濃度の低下は、炭酸(H₂CO₃)の濃度を減少させ、血液のpHが上昇します。 - 細胞膜上のナトリウム-リン共輸送体の活性化
血液のpHが高くなると、細胞外液中の水素イオン(H⁺)濃度が低下します。
これに応じて、細胞膜のナトリウム-リン共輸送体が活性化され、無機リン酸(Pi)がナトリウムと共に細胞内に輸送されます。
- 呼吸性アルカローシスは血液中の二酸化炭素が減少し、pHが上昇することで、リンが細胞内に移動することを引き起こします。
- インスリン療法(Insulin therapy)
- インスリンは細胞へのリンの取り込みを促進し、血中のリン濃度を低下させる可能性があります。
- カテコラミン(Catecholamines)
- カテコラミン(例:アドレナリン)はリンの細胞内移動を促す作用があります。
- 飢餓骨症(Hungry bone syndrome)
- 飢餓骨症では、骨が急激にリンを吸収することにより、血中のリン濃度が低下します。
腸管での吸収減少(Decreased intestinal absorption)
- 吸収不良:消化管からのリンの吸収が減少すると、血中リン濃度が低下します。これには栄養不良や腸疾患などが関与します。
摂取減少(Decreased intake)
- 飢餓やアルコール依存症(Starvation/alcoholism)
- 栄養不足やアルコール依存症は、リンの摂取を減少させ、低リン血症を引き起こすことがあります。
腎臓でのリン排泄増加(Increased renal loss of phosphate)
- ファンコニ症候群(Fanconi syndrome)
- ファンコニ症候群は、腎臓でのリンの再吸収障害によりリンの排泄が増加し、低リン血症を引き起こします。
- ナトリウム-リン共輸送体変異(NaP transporter mutation)
- ナトリウム-リン共輸送体の異常によって腎臓でのリンの再吸収が阻害され、リンの排泄が増加します。
リンの分画排泄率(Fractional Excretion of Phosphorus)
- 低値(Low fractional excretion): 低リン血症では、腎臓がリンを再吸収しようとするため、分画排泄率が低くなります。
- 高値(High fractional excretion): 高リン血症や腎臓でのリンの再吸収障害がある場合、分画排泄率は高くなります。



リンの分画排泄率(Fractional Excretion of Phosphorus, FEPhos)
1. 分画排泄率が低い場合
- 低リン血症(Hypophosphatemia)の原因として、腎臓からのリン排泄が低下している可能性があります。これは、体がリンを保持しようとする調節メカニズムが働いている状態です。
- 高リン血症(Hyperphosphatemia)では腎臓の濾過障害が疑われます。この場合、腎機能が十分にリンを排泄できないことが原因です。
高リン血症(Hyperphosphatemia)
原因
- 腎機能低下(急性腎障害や慢性腎疾患, CKD)
- 高リン血症の最も一般的な原因です。腎臓がリンを排泄できなくなり、血中リン濃度が上昇します。
- リンの摂取過剰
- **経口リン酸塩製剤(下剤など)**を摂取した場合に見られる。
- チューブ再吸収の亢進
- ビタミンD中毒や副甲状腺機能低下症が原因。
- 組織からの放出増加
- **横紋筋融解症(Rhabdomyolysis)**や腫瘍崩壊症候群(tumor lysis)によって細胞内のリンが血中に放出される。
- 細胞外へのシフト
- 乳酸アシドーシスや糖尿病性ケトアシドーシスがこれを引き起こします。
臨床的影響
- 急性高リン血症
- **急性腎障害(AKI)**を引き起こすことがあり、「リン酸腎症(phosphate nephropathy)」と呼ばれます。
- 慢性高リン血症(CKDによる)
- 心血管石灰化を引き起こし、心血管系疾患の罹患率および死亡率を増加させます。
低リン血症(Hypophosphatemia)
原因
- 細胞内へのリンのシフト
- 呼吸性アルカローシス、インスリン療法、カテコラミン、骨吸収亢進(hungry bone syndrome)などが関与。
- 腸での吸収低下
- 栄養不足やアルコール依存症が原因。
- 腎臓からの過剰なリン排泄
- **ファンコーニ症候群(Fanconi syndrome)**やナトリウム-リン輸送体の変異が原因。
臨床的影響
- 急性低リン血症
- 横紋筋融解症など、急性の筋肉障害を引き起こします。
- 慢性低リン血症
- 骨代謝の異常として、**骨軟化症(osteomalacia)**やくる病(rickets)を引き起こします。
- ATP欠乏による症状
- エネルギー供給の不足により、筋力低下や神経機能障害が見られることがあります。

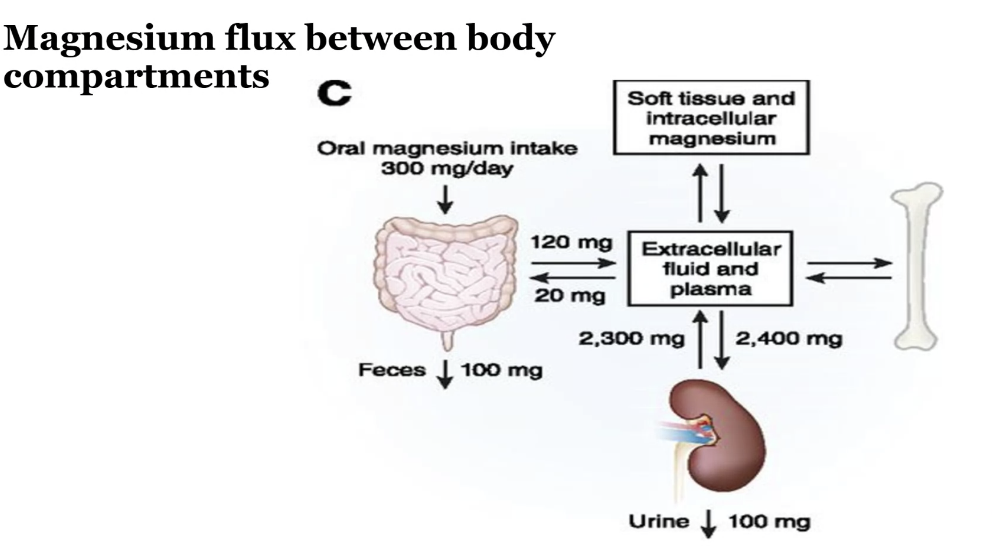
マグネシウムの体内ストレージと機能
マグネシウム(Mg)は、体内で非常に重要な役割を果たすミネラルで、特に酵素の補因子として働きます。以下に、マグネシウムに関する詳細な情報を示します。
体内のマグネシウムストレージ(Total body stores)
- 体内のマグネシウム量:約24g
- 99%は細胞内に存在
- ほとんどのマグネシウムは細胞内にあり、細胞内でのエネルギー代謝や酵素反応に重要な役割を果たします。
正常な血清マグネシウム濃度(Normal magnesium concentration)
- 血清マグネシウム濃度:1.7-2.6 mg/dL(または0.7-1.05 mmol/L)
- これは血液中に存在するマグネシウムの正常な範囲で、主に神経や筋肉の機能、酵素活性に関与しています。
血清マグネシウムの形態(Serum magnesium forms)
- 血清中の70%は遊離マグネシウム
- 血清中のマグネシウムの約70%は「遊離型」として存在しており、実際に生理的な作用を持ちます。
- 残りの30%はアルブミンに結合している
- アルブミンと結合しているマグネシウムは、生理学的にはあまり活性を持ちませんが、マグネシウムの血中濃度に影響を与えます。
マグネシウムの機能(Functions of magnesium)
- 酵素補因子としての役割
- マグネシウムは数百種類の酵素反応に必須の補因子です。特にATP(細胞エネルギー源)を使う反応において重要な役割を果たします。これにより、エネルギー代謝、DNA合成、タンパク質合成、神経伝達、筋肉の収縮など、多くの生理的過程に関与します。
マグネシウムは、体の多くの重要な機能を支えるミネラルであり、その濃度の異常は筋肉の痙攣や心拍の乱れ、神経の異常などを引き起こすことがあります。
ここの一枚ミス
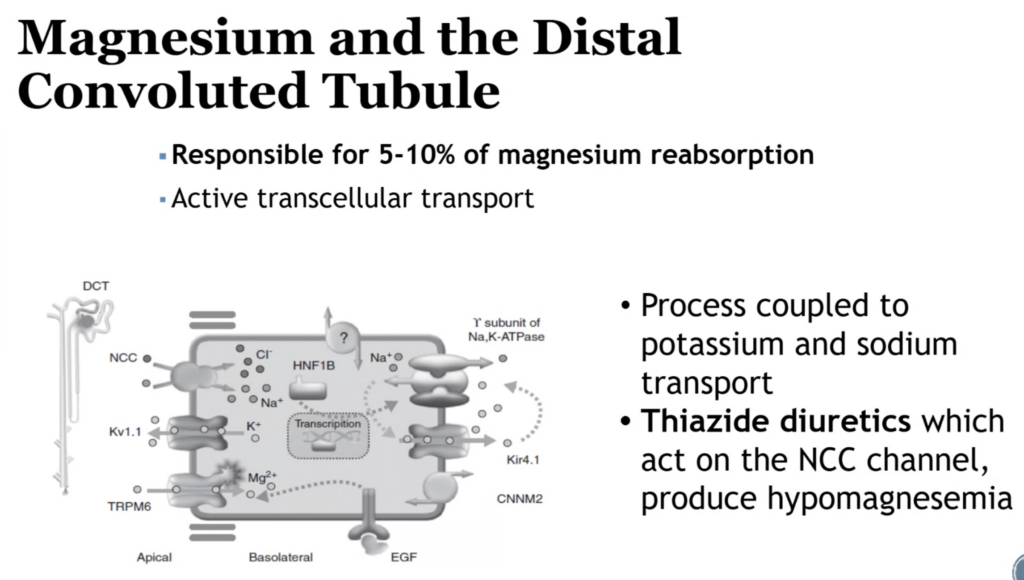


マグネシウム吸収を増加させる因子(Increase magnesium absorption)
- 食事制限(Dietary restriction)
- マグネシウムの摂取が制限されると、腎臓はその吸収を増加させて血中濃度を維持します。
- 副甲状腺ホルモン(PTH)
- PTHは腎臓でのマグネシウム再吸収を促進し、血中マグネシウム濃度を上げます。
- グルカゴン(Glucagon)
- グルカゴンも腎臓でのマグネシウムの吸収を増加させる作用があります。
- カルシトニン(Calcitonin)
- カルシトニンは骨からのカルシウムとマグネシウムの放出を抑制し、腎臓でのマグネシウム吸収を促進することがあります。
- バソプレシン(Vasopressin)
- バソプレシンは水分の再吸収を促進し、これに伴ってマグネシウムの吸収も増加する場合があります。
- アルドステロン(Aldosterone)
- アルドステロンはナトリウムの再吸収を促進し、それに伴いマグネシウムの再吸収を増加させる可能性があります。
- アミロライド(Amiloride)
- アミロライドは、ナトリウムチャンネルを抑制することで、間接的にマグネシウムの再吸収を促進します。
- 代謝性アルカローシス(Metabolic alkalosis)
- 代謝性アルカローシスでは、腎臓がマグネシウムを保持しようとするため、マグネシウムの吸収が増加します。
- 上皮成長因子(EGF)
- 上皮成長因子は腎臓でのマグネシウムの吸収を促進する作用があります。
マグネシウム吸収を減少させる因子(Decrease magnesium absorption)
- 高マグネシウム血症(Hypermagnesemia)
- 血中マグネシウム濃度が高い場合、腎臓は過剰なマグネシウムを排泄しようとし、吸収が抑制されます。
- 代謝性アシドーシス(Metabolic acidosis)
- 代謝性アシドーシスでは、腎臓が酸性の環境に適応するため、マグネシウムの吸収が減少します。
- リン欠乏(Phosphate depletion)
- リンの不足は腎臓でのマグネシウム吸収に影響を与え、吸収が減少することがあります。
- 利尿薬(Loop and thiazide diuretics)
- ループ利尿薬やサイアザイド系利尿薬は、マグネシウムの排泄を促進し、吸収が減少します。
- アニオン系抗菌薬(Anionic antimicrobials)
- アミノグリコシド系抗生物質やアムホテリシンB(抗真菌薬)は、腎臓でのマグネシウム吸収を妨げ、高マグネシウム血症を引き起こすことがあります。
- 化学療法薬(Chemotherapy)
- シスプラチンなどの化学療法薬は腎臓でのマグネシウムの再吸収を抑制し、マグネシウム欠乏を引き起こすことがあります。
- 免疫抑制剤(Immunosuppressants)
- タクロリムスやシクロスポリンなどの免疫抑制剤は腎臓に対して影響を及ぼし、マグネシウムの再吸収を抑制する可能性があります。

臨床的なマグネシウムの異常
マグネシウムの濃度が異常であることは、さまざまな臨床的な問題を引き起こす可能性があります。ここでは、高マグネシウム血症(Hypermagnesemia) と 低マグネシウム血症(Hypomagnesemia) について説明します。
高マグネシウム血症(Hypermagnesemia)
高マグネシウム血症は、血中のマグネシウム濃度が正常範囲を超えて高くなる状態です。以下の原因が考えられます:
- 摂取過剰(Increased intake)
- 制酸薬(Antacids) や 浣腸(Enemas) に含まれるマグネシウムが過剰に摂取されると、高マグネシウム血症を引き起こすことがあります。
- 静脈内投与(IV therapy):特に妊娠高血圧症(pre-eclampsia)の治療に使われる 硫酸マグネシウム(magnesium sulfate) の投与が原因となることがあります。
- 腎臓でのろ過低下(Decreased renal filtration)
- 腎不全などにより、腎臓がマグネシウムを適切に排泄できない場合、血中濃度が上昇します。
低マグネシウム血症(Hypomagnesemia)
低マグネシウム血症は、血中のマグネシウム濃度が低くなる状態で、以下の要因が関与します:
- 摂取不足(Reduced intake)
- 不十分な食事や栄養失調、アルコール依存症などで、マグネシウムの摂取が不足することがあります。
- マグネシウムの再分配(Redistribution)
- 代謝性アシドーシスや急性アルコール中毒など、血液中でマグネシウムが異常に再分配されることにより低下します。
- 腎臓でのマグネシウムの排泄増加(Renal Magnesium Wasting)
- 利尿薬(Diuretics) や ホルモン異常(Hormone induced magnesuria) により、腎臓でのマグネシウム排泄が増加することがあります。
- 例: アルドステロン症(Aldosteronism)、副甲状腺機能低下症(Hypoparathyroidism)、甲状腺機能亢進症(Hyperthyroidism) など。
- 利尿薬(Diuretics) や ホルモン異常(Hormone induced magnesuria) により、腎臓でのマグネシウム排泄が増加することがあります。
- 薬剤による損失(Drug-induced losses)
- 利尿薬やアミノグリコシド系抗生物質(例:アミカシン、ゲンタマイシン)などがマグネシウム排泄を増加させ、低マグネシウム血症を引き起こすことがあります。
- マグネシウムの管腔での損失(Ion or nutrient induced tubular losses)
- 高カルシウム血症(Hypercalcemia) や 体液量の増加(Extracellular fluid volume expansion) が、腎臓でのマグネシウムの再吸収を抑制し、排泄を促進することがあります。
フラクショナル排泄率(Fractional Excretion of Magnesium)
- 腎臓のマグネシウム排泄率が2%以上(>2%) であれば、これは腎臓によるマグネシウムの過剰排泄を示唆し、**腎臓性低マグネシウム血症(Renal hypomagnesemia)**が考えられます。
- 一方、**低い排泄率(<2%)**の場合、低マグネシウム血症が腎臓以外の原因(例えば、消化管からの吸収不良や薬剤による影響)による場合が多いです。
教科書31


酸と塩基の定義と意味
酸(Acid)と塩基(Base)の概念は、化学反応において水素イオン(H+)の移動に関連しています。以下に、酸と塩基の定義を説明します。
酸(Acid)
酸は、水溶液中で水素イオン(H+)を放出できる分子(Molecule)またはイオン(Ion)です。酸が水に溶けると、水素イオンを放出します。
例えば:
- 塩酸(HCl) は水に溶けると、水素イオン(H+)と塩化物イオン(Cl-)に解離(Dissociate)します。
- HCl → H+ + Cl-
- 炭酸(H2CO3) は水に溶けると、水素イオン(H+)と重炭酸イオン(HCO3-)に解離します。
- H2CO3 → H+ + HCO3-
酸は、通常、**水素イオン(H+)**を放出することで溶液を酸性にします。
塩基(Base)
塩基は、水素イオン(H+)を受け取ることができるイオン(Ion)または分子(Molecule)です。塩基が水中に存在すると、水素イオンを結合して塩基性を示します。
例えば:
- 重炭酸イオン(HCO3-) は、酸である水素イオン(H+)を受け取ることで炭酸(H2CO3)を形成します。
- HCO3- + H+ → H2CO3
- 水素リン酸イオン(HPO4^2-) は、水素イオン(H+)を受け取ることでジ水素リン酸イオン(H2PO4-)を形成します。
- HPO4^2- + H+ → H2PO4-
塩基は、**水素イオン(H+)**を受け取ることで溶液をアルカリ性にします。
酸と塩基の関係
- 酸は水素イオン(H+)を放出し、溶液を酸性にします。
- 塩基は水素イオン(H+)を受け取って、溶液をアルカリ性にします。
これらの定義に基づいて、酸と塩基は互いに反応して**中和反応(Neutralization)**を起こし、酸と塩基がそれぞれ水素イオン(H+)や水酸化物イオン(OH-)を交換することによって水と塩を生成します。

体内のタンパク質と塩基(Bases)
体内のタンパク質(Proteins)も塩基として機能します。これは、タンパク質を構成するアミノ酸(Amino Acids)の中には、**水素イオン(H+)**を容易に受け取る負の電荷(Net Negative Charge)を持つものがあるためです。これらのアミノ酸は、酸性環境で水素イオンを受け取ることができ、タンパク質が塩基性(Alkaline)として作用します。
アルカローシス(Alkalosis)
アルカローシスは、体液から水素イオン(H+)が過剰に排除される状態を指します。これは、血液や体液の**pHが高くなりすぎる(アルカリ性になる)**ことによって生じます。アルカローシスは、呼吸器や代謝の問題に起因することが多いです。
- 例:過呼吸(Hyperventilation)などによる二酸化炭素(CO2)の過剰排出が原因となり、血液中の水素イオンが低下してアルカローシスを引き起こすことがあります。
アシドーシス(Acidosis)
アシドーシスは、体内に過剰な水素イオン(H+)が蓄積される状態を指します。これにより血液や体液の**pHが低くなりすぎる(酸性になる)**ことが生じます。アシドーシスは呼吸器や代謝に問題がある場合に起こり、体液が過剰に酸性になることがあります。
- 例:糖尿病性ケトアシドーシス(Diabetic Ketoacidosis)や腎不全などによって、血中の水素イオン濃度が増加し、アシドーシスが引き起こされることがあります。
まとめ
- アルカローシス(Alkalosis) は水素イオン(H+)の過剰排除によって体液がアルカリ性になる状態です。
- アシドーシス(Acidosis) は水素イオン(H+)の過剰蓄積によって体液が酸性になる状態です。
これらの状態は、体内の酸・塩基のバランスに重要な影響を与え、健康に深刻な影響を及ぼすことがあります。


pHの概念
- 正常な血液のpH:7.35~7.45
- 細胞外液(Extracellular Fluid)のpH:約7.4
- 尿のpH:4.5~8.0の範囲で変動します。これは細胞外液の酸塩基状態に依存します。
pHのホームオスタシス(恒常性)
- pHは非常に厳密に調整されており、体内の酸塩基バランスを維持するために重要です。pHの小さな変動も体に重大な影響を及ぼします。
pHの異常とその影響
- アシドーシス(Acidosis) / 酸血症(Acidemia)
- pHが7.35未満の場合、アシドーシス(酸血症)と呼ばれ、血液が過剰に酸性になります。
- アシドーシスは、呼吸器や代謝の障害によって引き起こされることがあり、呼吸困難や心血管系の障害などの症状が現れることがあります。
- アルカローシス(Alkalosis) / アルカリ血症(Alkalemia)
- pHが7.45を超える場合、アルカローシス(アルカリ血症)と呼ばれ、血液が過剰にアルカリ性になります。
- アルカローシスは、呼吸器過換気症候群や過度の嘔吐などが原因で発生することがあり、筋肉のけいれんや痙攣が見られることがあります。
- 致死的なpHの範囲
- pHが6.8未満または8.0を超えると、致命的な状態となることがあります。
- これらの極端なpH変化は、臓器の機能不全を引き起こし、生命に危険を及ぼす可能性があります。
まとめ
- 正常な血液のpHは7.35~7.45の間であり、これを外れると酸塩基の不均衡が生じます。
- アシドーシスやアルカローシスは、体内のpHの変化による症状や障害を引き起こします。
- pHが6.8未満または8.0を超えると致命的となり、迅速な治療が必要です。


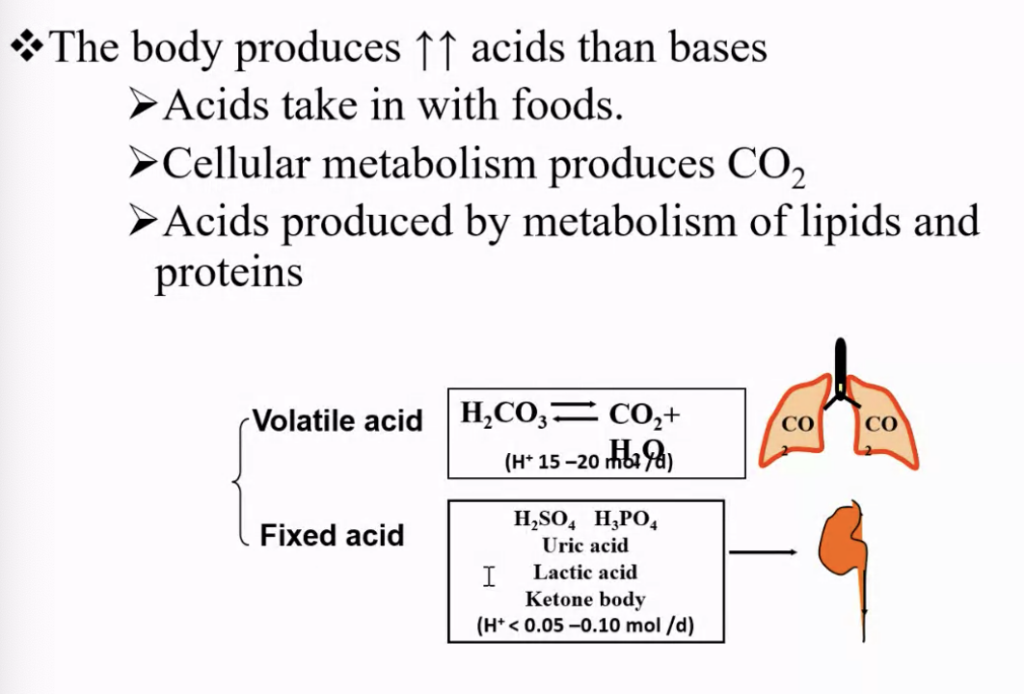
揮発性酸(Volatile Acids)
- **二酸化炭素(CO₂)**は、**炭酸(H₂CO₃)**として形成されます。この反応は、**炭酸脱水酵素(carbonic anhydrase)**によって進行します。
- H₂OとCO₂が反応してH₂CO₃を生成。
- H₂CO₃は次にH⁺(水素イオン)とHCO₃⁻(重炭酸イオン)に解離します。
- 揮発性酸の生成:
- CHO(炭水化物)や脂質の酸化代謝によって主に生成されます。これは、体内でのエネルギー生成過程の一部として行われます。
- 主に赤血球(RBC)や腎細管細胞内で生成されます。
- 排泄:
- 揮発性酸は主に肺からCO₂ガスとして排泄されます。
- H₂CO₃は再び炭酸脱水酵素によってH₂OとCO₂に戻され、CO₂ガスとして呼吸により体外に排出されます。
- 揮発性酸の特徴:
- H₂CO₃(炭酸)は、同じ炭酸脱水酵素によって再びH₂OとCO₂に変換されるため、「揮発性酸(volatile acid)」と呼ばれます。このように、揮発性酸は呼吸を通じて排泄されるため、呼吸によって体内の酸塩基バランスを調整することができます。

非揮発性酸(Non-volatile Acids)
非揮発性酸は、体内で生成され、呼吸によって排泄されることなく、主に腎臓を通じて排出される酸です。以下の特徴があります:
- 生成源:
- アミノ酸(amino acids)
- リン脂質(phospholipids)
- 核酸(nucleic acids)
- 特徴:
- 非揮発性酸は、生成後に解離した酸(H⁺)が体液に残り、解離し続けるため、体外に出ることなく体内に留まる。
- これらは、最終的には腎臓で排出され、体内の酸塩基バランスを調整します。
- 重要性:
- これらの酸は**体内で最も重要な固定酸(fixed acids)**です。
- 呼吸を通じて排出されないため、腎臓が重要な役割を果たします。
- 代表的な非揮発性酸:
- 硫酸(Sulfuric acid)
- リン酸(Phosphoric acid)
- 有機酸(Organic acids)(例:乳酸(lactic acid)、ケトン体(ketone bodies)、脂肪酸(fatty acids))

H⁺(水素イオン)の変動に対する防御機構
体内では水素イオン(H⁺)濃度が厳密に調整されており、その範囲は7.2 – 7.4(pH)、すなわち3〜5 x 10⁻⁸モル/Lです。この調整は、以下の三つの主要な防御機構によって行われます:
1. 体液の化学的緩衝剤(迅速だが一時的な対応)
化学的緩衝剤は、H⁺の変動を抑制するために迅速に働きますが、これだけでは長期的な調整はできません。主な緩衝剤は以下の通りです:
- 重炭酸塩(Bicarbonate, HCO₃⁻)
- 最も重要な緩衝剤で、体液中でpHの安定を保つ役割を果たします。
- アンモニア(Ammonia, NH₃)
- アンモニアは、体内で酸を中和するのに重要な役割を持つ緩衝剤です。
- タンパク質(Proteins)
- タンパク質には多くのアミノ酸が含まれており、これらがH⁺を受け入れることでpHを調整します。
- リン酸(Phosphate)
- リン酸も化学的な緩衝作用を持ち、細胞内で特に重要です。
2. 肺(迅速にCO₂を排出)
- 換気(Ventilation)
- 呼吸を通じて**二酸化炭素(CO₂)**を排出することで、血液中の酸性度を調整します。CO₂は水中でH⁺を放出するため、CO₂の排出が酸塩基バランスに影響を与えます。
- CO₂の排出
- 呼吸を通じてCO₂が失われることにより、血中のH⁺濃度が低下し、pHが上昇(アルカリ性)します。
3. 腎臓(遅いが強力な調整)
- H⁺の分泌
- 腎臓では、尿中にH⁺を分泌することで血液の酸性度を調整します。
- 重炭酸塩(HCO₃⁻)の再吸収
- 腎臓は重炭酸塩を再吸収し、これによりpHを調整します。
- 新しいHCO₃⁻の生成
- 腎臓は新たにHCO₃⁻を生成し、体内の酸塩基バランスを維持します。

★
体内の緩衝系(Buffer Systems)
体内にはpHを調整するためにいくつかの重要な緩衝系が存在します。これらの緩衝系は、酸(H⁺)や塩基(OH⁻)の変動を抑える役割を果たし、血液や細胞のpHを安定させます。主要な緩衝系を以下に示します:
1. 重炭酸塩緩衝系(Bicarbonate Buffer System)
- 最も重要なECF(細胞外液)の緩衝剤であり、体内で最も広く機能しています。
- 反応式: H2O+CO2⇌H2CO3⇌H++HCO3−
- 二酸化炭素(CO₂)と水(H₂O)が反応して炭酸(H₂CO₃)を形成し、その後H⁺(水素イオン)と重炭酸イオン(HCO₃⁻)に解離します。この緩衝系は、血液中のCO₂レベルに依存しており、呼吸によって調整されます。
2. リン酸緩衝系(Phosphate Buffer System)
- 腎臓の尿細管内で重要な緩衝剤として機能します。
- 反応式: HPO42−+H+⇌H2PO4−
- **リン酸イオン(HPO₄²⁻)**がH⁺を受け入れることにより、pHを調整します。特に腎臓で、尿を通じてH⁺を排泄する際に重要な役割を果たします。
3. アンモニア緩衝系(Ammonia Buffer System)
- 腎臓の尿細管内で重要な緩衝剤として働き、尿中の酸の排泄を助けます。
- アンモニア(NH₃)はH⁺を受け入れて**アンモニウムイオン(NH₄⁺)**に変換され、尿として排出されます。これにより、体内の酸性度を調整します。
4. タンパク質緩衝系(Protein Buffer System)
- 細胞内で最も重要な緩衝剤であり、体内で約60〜70%の緩衝作用を提供します。
- 反応式(例: ヘモグロビン): H++Hb⇌HHb
- ヘモグロビン(Hb)はH⁺と結びつき、酸性度の変動を抑えることができます。血液中のヘモグロビンは、酸素の運搬だけでなく、pHの調整にも重要です。
まとめ
体内の緩衝系はそれぞれ特定の場所で重要な役割を果たし、pHの調整を行っています。重炭酸塩緩衝系は血液のpH調整において主な役割を担い、リン酸やアンモニア緩衝系は主に腎臓で機能します。タンパク質緩衝系は細胞内での酸塩基平衡を保つために重要です。これらのシステムは連携して、体内のpHを一定の範囲内に維持します。


酸塩基バランスの障害(Disturbances of Acid-Base Balance)
酸塩基バランスの障害は、血液のpHが正常範囲から外れた場合に発生します。この異常は、代謝(Metabolic)または呼吸(Respiratory)の両方の原因によって引き起こされることがあります。具体的には、以下のように分類されます。
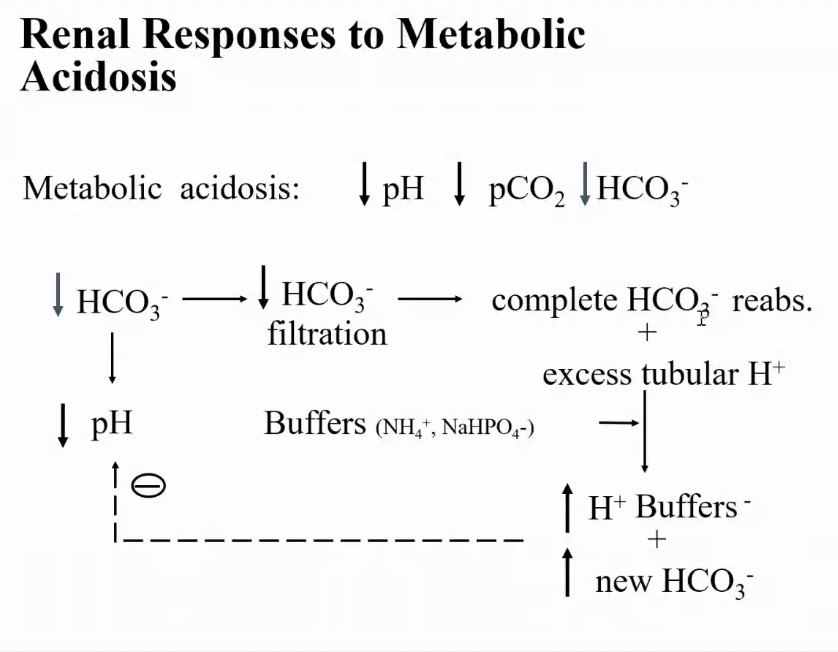
1. 代謝性酸塩基障害(Metabolic Acid-Base Disorders)
代謝性酸塩基障害は、主に**細胞外液(ECF)中の重炭酸イオン(HCO₃⁻)**の変化に起因します。具体的な病態は以下の通りです:
- 代謝性アシドーシス(Metabolic Acidosis):
- 原因: 重炭酸イオン(HCO₃⁻)の濃度が低下すること(例えば、乳酸アシドーシスや腎不全など)。
- 特徴: 血液中のHCO₃⁻が減少し、pHが下がります。
- 代謝性アルカローシス(Metabolic Alkalosis):
- 原因: 重炭酸イオン(HCO₃⁻)の濃度が増加すること(例えば、嘔吐や利尿薬の使用など)。
- 特徴: 血液中のHCO₃⁻が増加し、pHが上昇します。
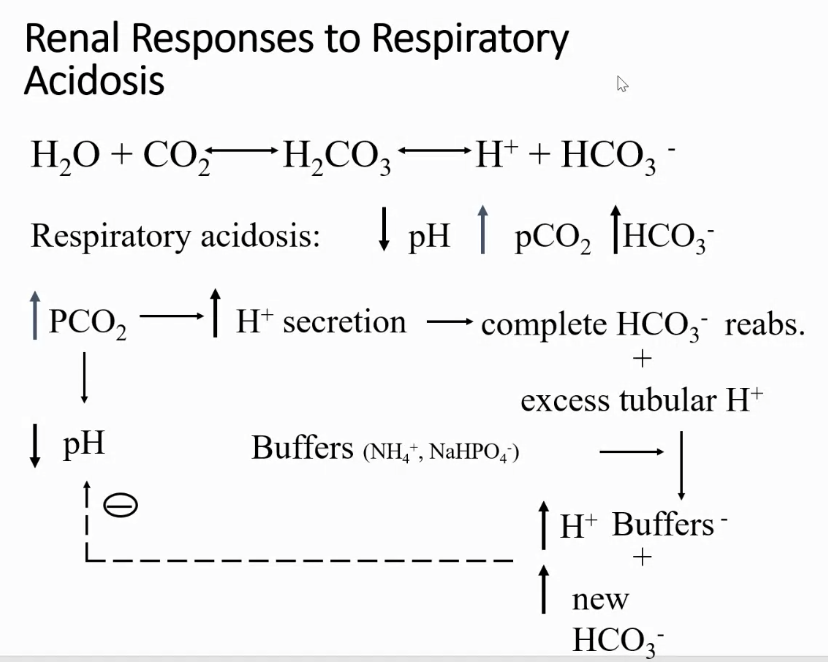
2. 呼吸性酸塩基障害(Respiratory Acid-Base Disorders)
呼吸性酸塩基障害は、**二酸化炭素(CO₂)**のレベルに関連する障害です。二酸化炭素は炭酸(H₂CO₃)に変換され、血液のpHに影響を与えます。
- 呼吸性アシドーシス(Respiratory Acidosis):
- 原因: Pco₂(血中の二酸化炭素分圧)の増加(例えば、呼吸不全や慢性肺疾患)。
- 特徴: CO₂が蓄積し、H₂CO₃が増加して血液が酸性になります。
- 呼吸性アルカローシス(Respiratory Alkalosis):
- 原因: Pco₂の減少(例えば、過換気や高山病)。
- 特徴: CO₂の排出が増え、H₂CO₃の濃度が減少し、血液がアルカリ性になります。
まとめ
酸塩基バランスの障害は、血液pHの異常を引き起こし、通常は次の2つの主要なメカニズムによって分類されます:
- 代謝性障害: 重炭酸イオン(HCO₃⁻)の変動に起因する。
- 代謝性アシドーシス: HCO₃⁻の減少。
- 代謝性アルカローシス: HCO₃⁻の増加。
- 呼吸性障害: 二酸化炭素(CO₂)の変動に起因する。
- 呼吸性アシドーシス: Pco₂の増加。
- 呼吸性アルカローシス: Pco₂の減少。
これらの障害は、体内の酸塩基バランスに重大な影響を与え、迅速な対応が必要です。
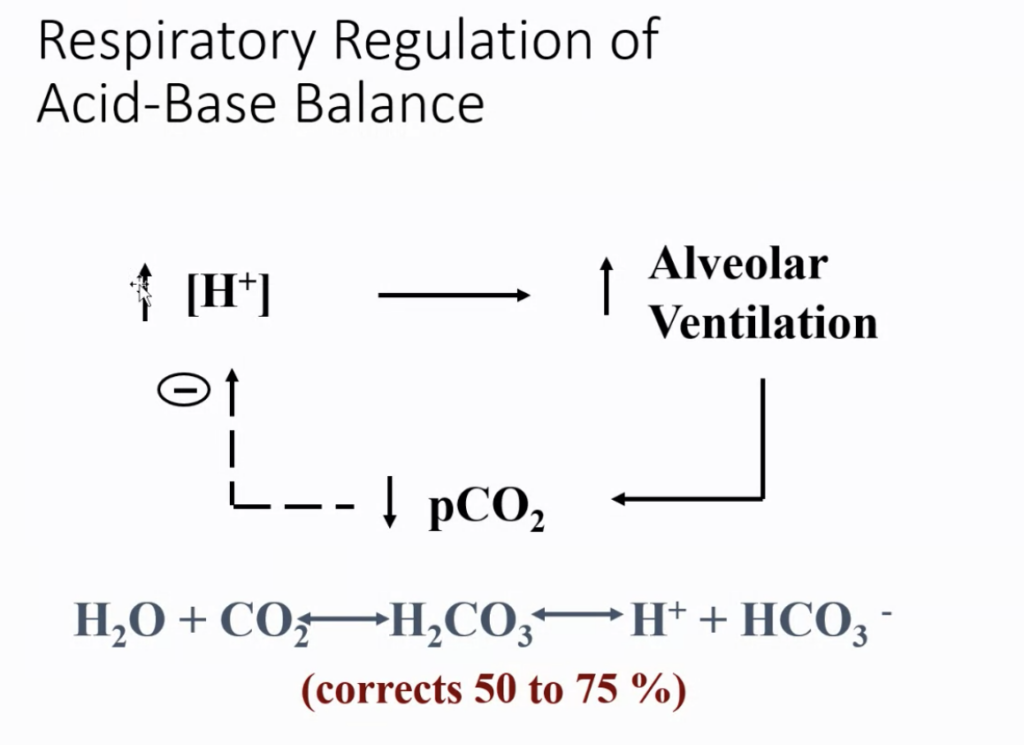
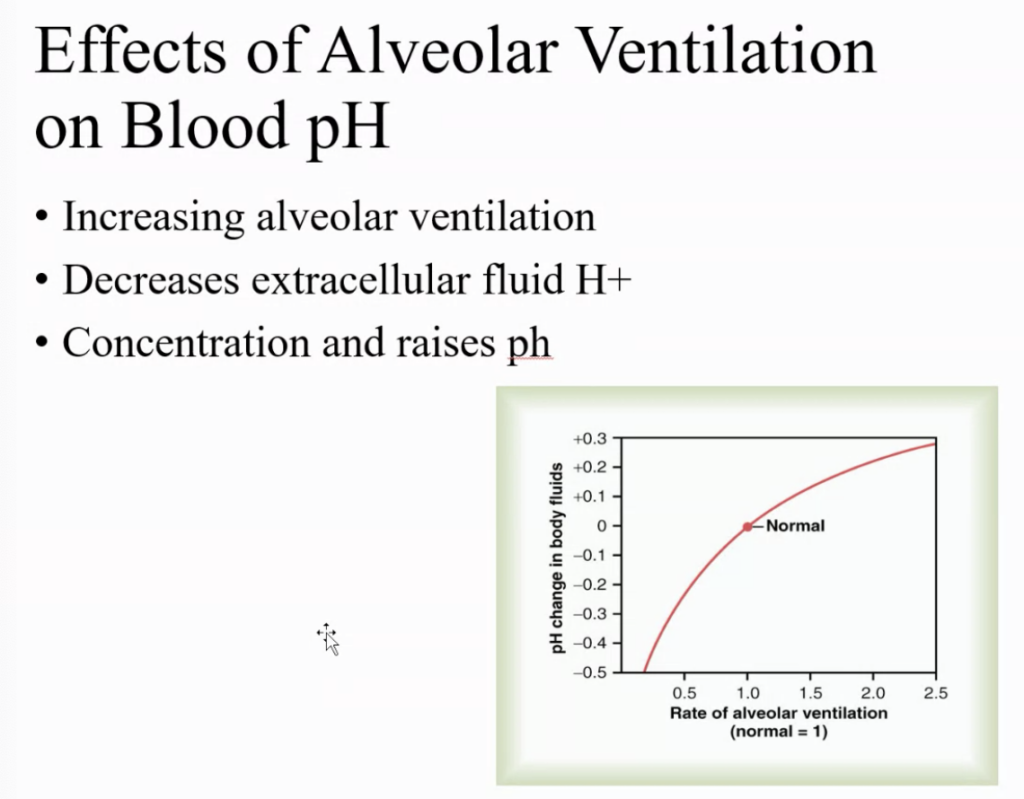
肺胞換気 (Alveolar Ventilation) が血液のpHに与える影響
肺胞換気を増加させると、血液中の二酸化炭素 (CO2) の排出が増えます。二酸化炭素は血液内で水と反応して炭酸 (H2CO3) を形成し、さらにこれが水素イオン (H+) を放出するため、血液のpHが低下します。つまり、二酸化炭素の濃度が高いと、血液が酸性に傾きます。
肺胞換気を増加させることによって、二酸化炭素の排出が促進されると、血液中の二酸化炭素濃度が減少します。この結果、炭酸が減少し、H+の濃度も低下します。これによって、血液のpHは上昇し、よりアルカリ性に近づきます。
要するに、肺胞換気が増えると、血液のH+濃度が減少し、pHが上昇します。
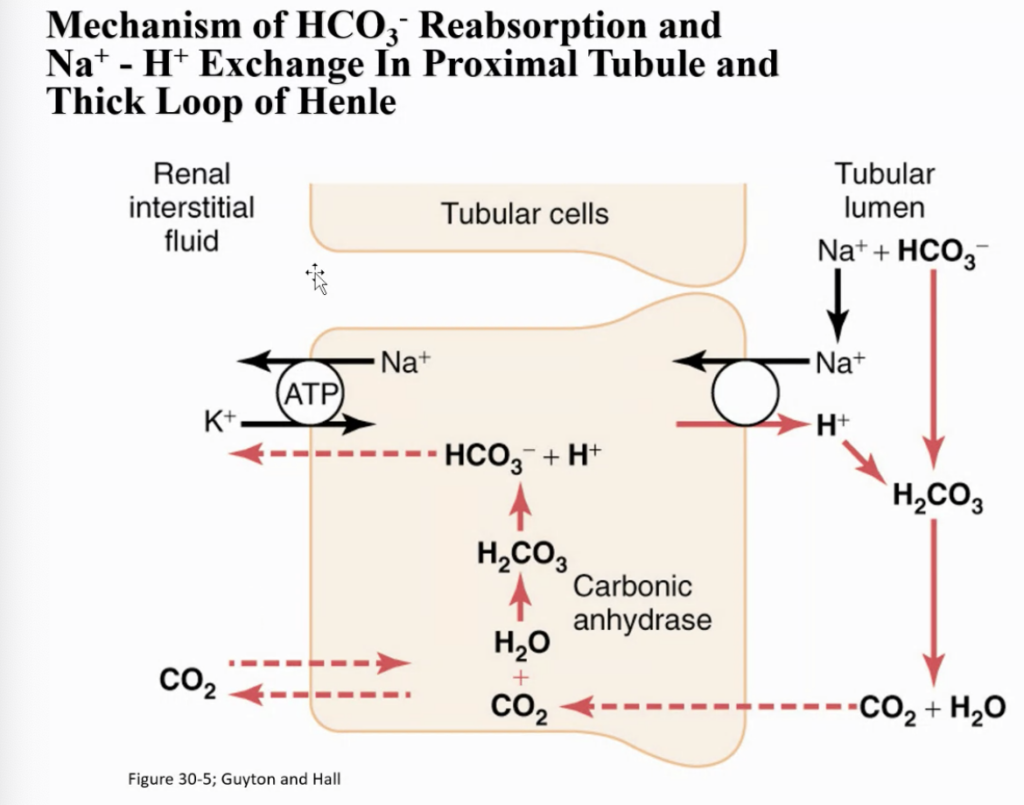
腎臓におけるH+分泌とHCO3−再吸収の細胞メカニズム
この図は、以下の3つのメカニズムを示しています。
- H+の能動的分泌
腎臓の尿細管でH+(水素イオン)が能動的に分泌されます。これは、体内の酸塩基バランスを調整するための重要なプロセスです。 - HCO3−(重炭酸イオン)の再吸収
尿細管内でH+とHCO3−が結びついてH2CO3(炭酸)を形成し、その後これがCO2(二酸化炭素)とH2O(水)に分解され、再吸収されます。これによって、体内に必要なHCO3−が戻され、血液のpHが調整されます。 - Na+(ナトリウム)の再吸収とH+の交換
Na+はH+と交換される形で再吸収されます。これにより、ナトリウムのバランスが保たれ、H+が分泌されることで酸塩基の調整が行われます。
これらのプロセスは、近位尿細管 (proximal tubule)、ヘンレの太い上行脚 (thick ascending segment of the loop of Henle)、および早期遠位尿細管 (early distal tubule) で行われます。これにより、体内の酸塩基のバランスが保たれるとともに、必要な物質が再吸収されます。
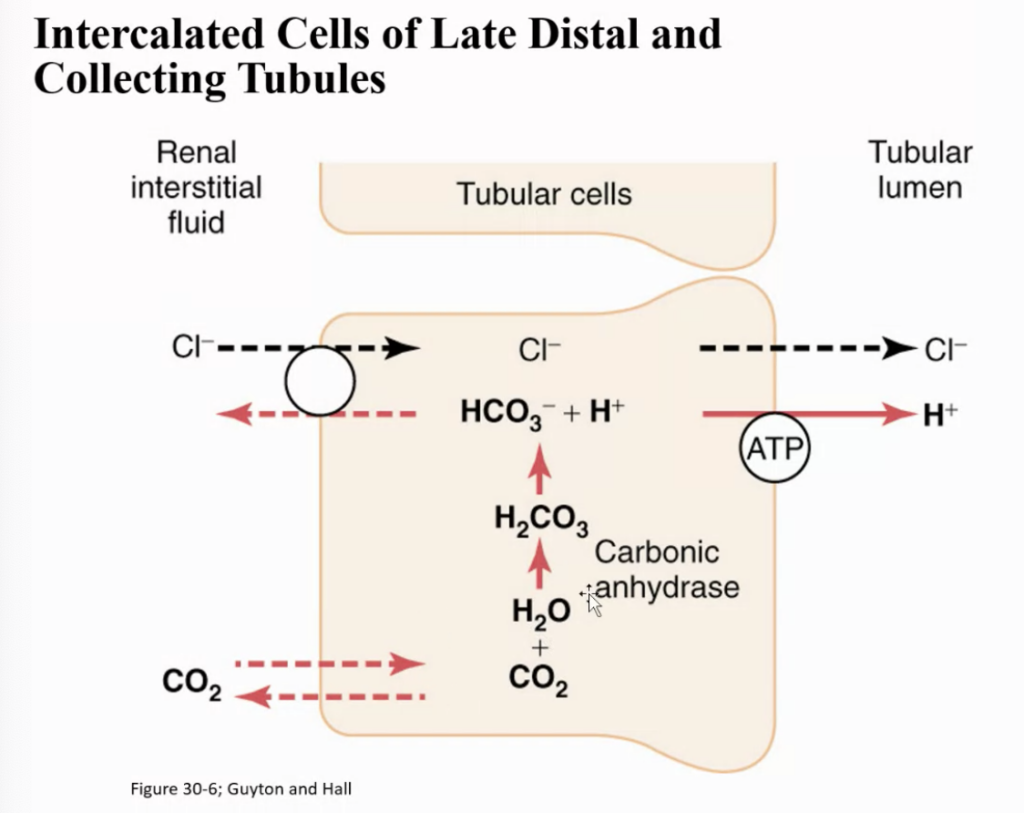
ここら辺、数枚ミス。
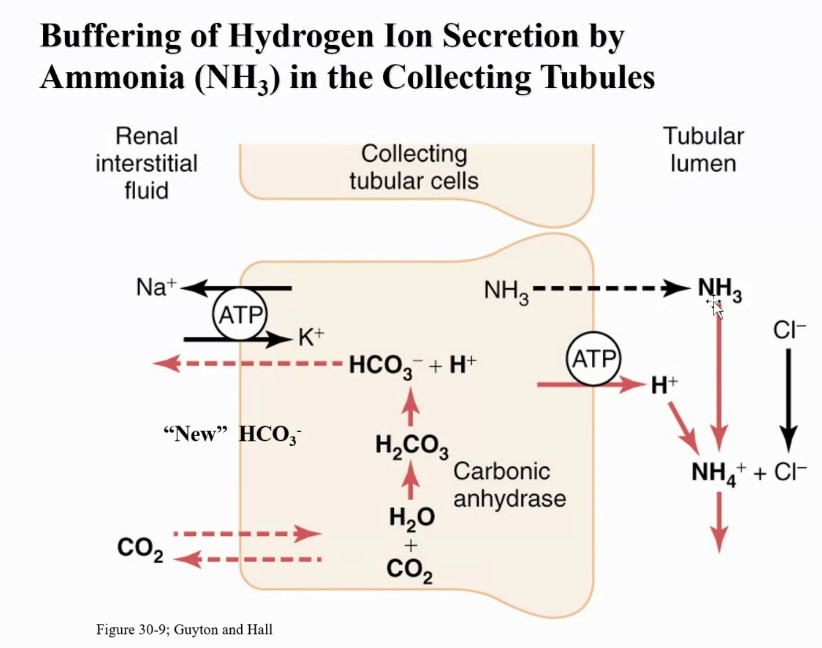
集合管におけるアンモニア (NH3) によるH+分泌の緩衝作用
この図は、集合管でのH+(水素イオン)分泌を緩衝するためのアンモニア (NH3) の働きを示しています。
- NH3の尿細管内への拡散
アンモニアは尿細管内腔に拡散し、そこで分泌されたH+と反応します。 - NH3とH+の結合
NH3はH+と結びついて、**NH4+(アンモニウムイオン)**を形成します。この反応により、H+が尿中に排泄される前に緩衝され、酸性度が調整されます。 - NH4+の排泄とHCO3−の再形成
NH4+はその後、尿中に排泄されます。そして、この過程で、尿細管細胞内で新たに**HCO3−(重炭酸イオン)**が生成され、血液に戻されます。これにより、体内の酸塩基平衡が保たれ、血液のpHが安定します。
このメカニズムは、H+の過剰を排出し、同時に**新しいHCO3−**を血液に供給することによって、体内の酸塩基の調整をサポートします。
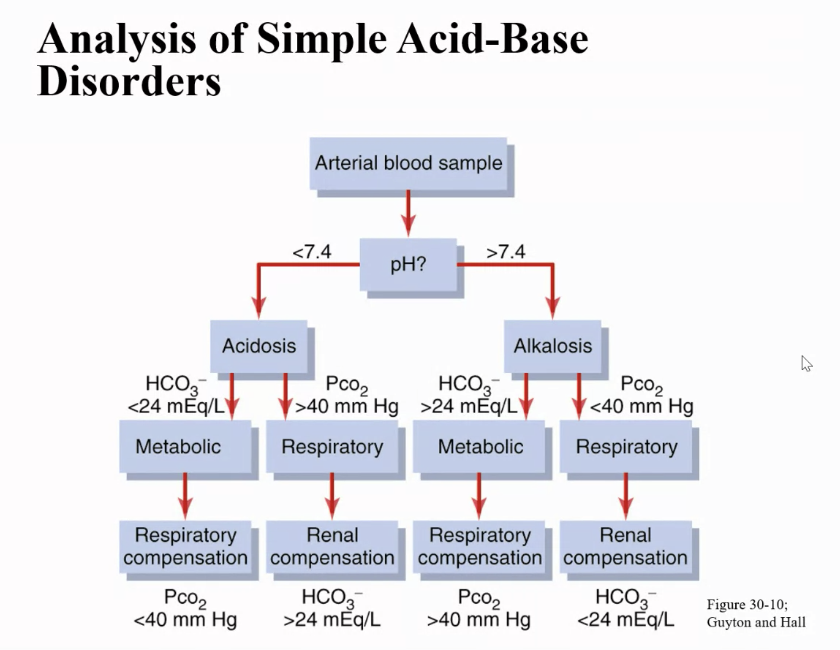
酸塩基異常の臨床的測定と分析
酸塩基異常の適切な治療には、正確な診断が必要です。前述の簡単な酸塩基異常は、動脈血サンプルからの3つの測定値(pH、血漿HCO3−濃度、Pco2)を分析することで診断できます。
酸塩基異常の診断にはいくつかのステップがあり、以下のように進めます。
- pHの確認
まず、pHを確認して、異常がアシドーシス (acidosis) かアルカローシス (alkalosis) かを判断します。pHが7.4未満ならアシドーシス、7.4を超えるとアルカローシスを示します。 - Pco2とHCO3−の確認
次に、血漿のPco2とHCO3−濃度を確認します。Pco2の正常値は約40 mm Hg、HCO3−の正常値は24 mEq/Lです。- 呼吸性アシドーシス (respiratory acidosis) の場合、pHが低く、Pco2が増加します。腎臓による部分的な補償後、HCO3−濃度は通常より高くなる傾向があります。したがって、呼吸性アシドーシスの予想値は、低いpH、増加したPco2、部分的な腎補償後に増加したHCO3−濃度です。
- 代謝性アシドーシス (metabolic acidosis) では、pHが低下し、HCO3−濃度が低下します。代謝性アシドーシスでは、呼吸による部分的な補償があり、Pco2が減少します。したがって、代謝性アシドーシスでは、低いpH、低いHCO3−濃度、そして減少したPco2が予想されます。
- アルカローシスの分類
アルカローシスの分類手順も基本的に同様のステップを踏みます。- 呼吸性アルカローシス (respiratory alkalosis) の場合、pHが上昇し、Pco2が減少します。また、呼吸性アルカローシスでは、HCO3−濃度が減少するのが特徴です。したがって、呼吸性アルカローシスでは、pHが上昇し、Pco2が減少し、HCO3−濃度が減少します。
- 代謝性アルカローシス (metabolic alkalosis) では、pHが上昇し、HCO3−濃度が増加します。代謝性アルカローシスでは、Pco2も増加する傾向があります。したがって、代謝性アルカローシスでは、pHが上昇し、HCO3−濃度が増加し、Pco2も増加します。

1. 酸性血症(Acidosis)の場合
酸性血症では、血液のpHを上昇させるために、腎臓は以下のメカニズムを活性化します。
- H⁺(水素イオン)の排出増加:
腎臓の尿細管でH⁺が積極的に分泌されます。この排出により、血液中の酸性度が低下します。 - HCO₃⁻(重炭酸イオン)の再吸収増加:
腎臓の尿細管で、HCO₃⁻が血液に再吸収され、血液のバッファー能力が向上します。 - 新しいHCO₃⁻の生成:
アンモニア(NH₃)やリン酸塩(HPO₄²⁻)を介して、新たなHCO₃⁻が作られ、血液に供給されます。
2. アルカリ血症(Alkalosis)の場合
アルカリ血症では、血液のpHを低下させるために、腎臓は以下のメカニズムを活性化します。
- H⁺(水素イオン)の排出減少:
腎臓のH⁺排出が抑制され、血液中のH⁺濃度が増加します。 - HCO₃⁻(重炭酸イオン)の再吸収減少:
腎臓でのHCO₃⁻再吸収が抑えられ、血液中のHCO₃⁻濃度が低下します。 - HCO₃⁻の尿中排泄:
HCO₃⁻が尿中に排泄されることで、血液のアルカリ性が緩和されます。
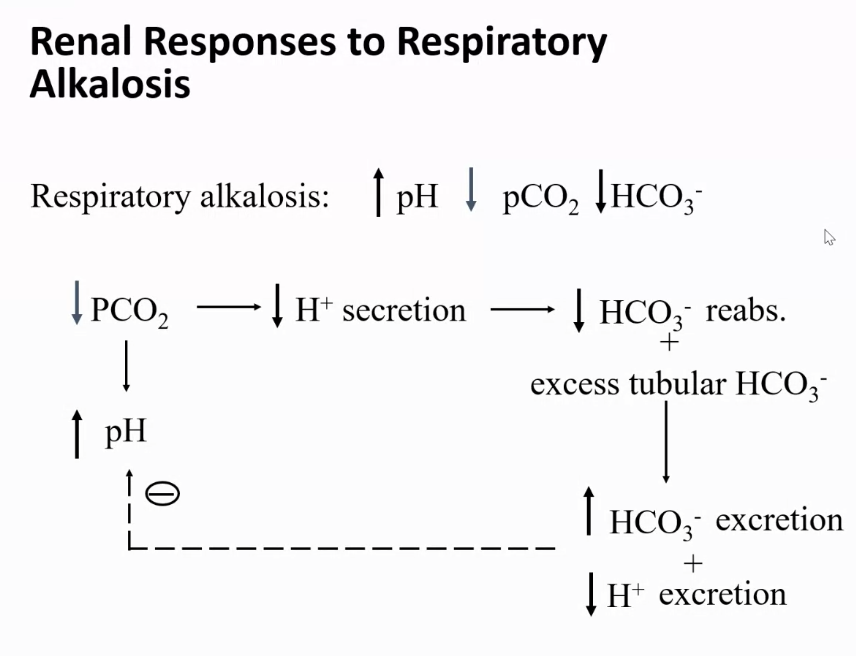
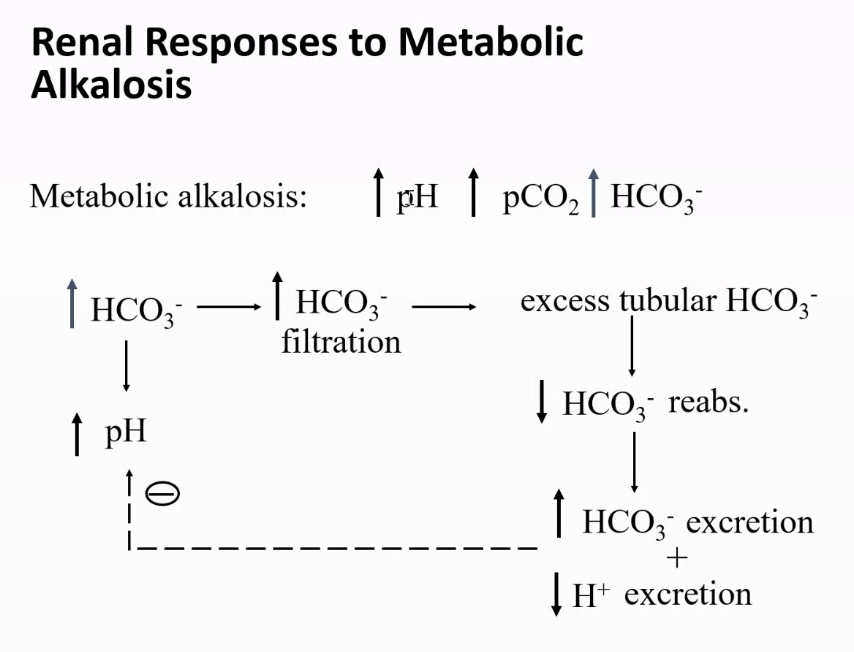


診断: 混合性アルカローシス(Mixed Alkalosis)
解釈
このケースでは、血液ガスデータと酸塩基バランスの指標が以下の通りです:
- pH = 7.60
正常範囲(7.35〜7.45)を超えており、アルカローシスを示しています。 - pCO₂ = 30 mmHg
正常範囲(35〜45 mmHg)より低下しており、呼吸性アルカローシスを示唆します。 - HCO₃⁻ = 29 mmol/L
正常範囲(22〜26 mmol/L)より増加しており、代謝性アルカローシスを示唆します。
診断: 混合性アルカローシス(Mixed Alkalosis)
このデータから、以下の2つのアルカローシスの原因が共存していることが分かります:
- 代謝性アルカローシス:
増加したHCO₃⁻が根拠となります。これは、例えば利尿薬の使用や嘔吐などによる重炭酸イオンの過剰蓄積が原因となり得ます。 - 呼吸性アルカローシス:
減少したpCO₂が根拠となります。これは、過換気(過呼吸)によって二酸化炭素の排出が過剰になったことが原因と考えられます。
ポイント
- pHが高い(アルカローシス)
酸塩基の異常がアルカローシスであることを示します。 - HCO₃⁻増加とpCO₂低下の両方が同時に存在
代謝性アルカローシスと呼吸性アルカローシスが混在していることを示しています。
臨床的意義
混合性酸塩基障害では、基礎疾患を特定し、それぞれの原因を同時に治療する必要があります。このケースでは、代謝性アルカローシス(例: 嘔吐)や呼吸性アルカローシス(例: 過換気症候群)の原因を探ることが重要です。


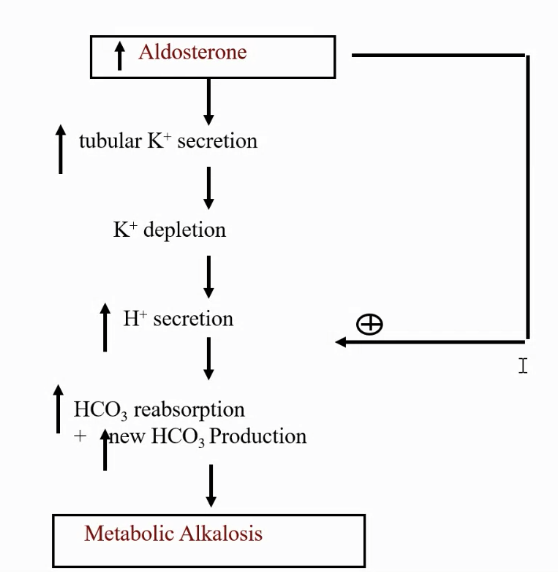
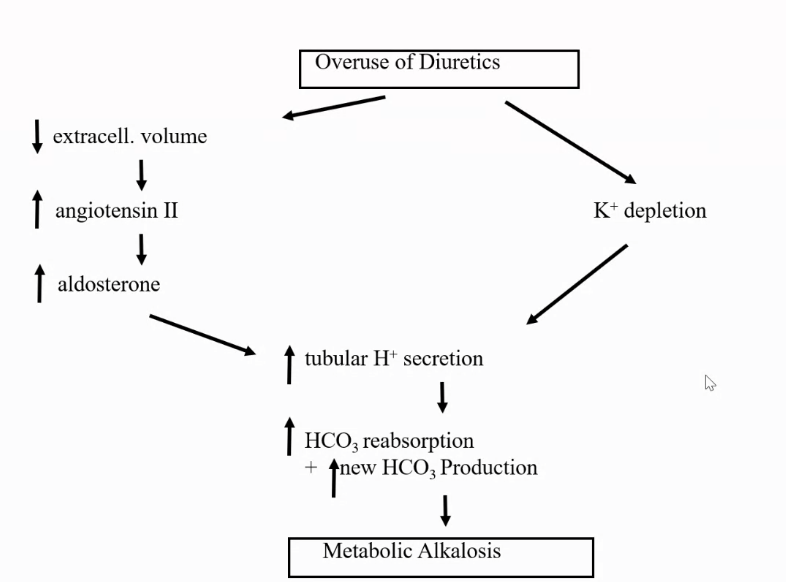


コメント