Contents
- 1 Ch 27:Biosynthesis of the Nutritionally Nonessential Amino Acids
- 1.1 OBJECTIVES
- 1.2 Q1: Biosynthesis of Nonessential Amino Acids
- 1.3 Q2: Nutritionally Nonessential Amino Acids
- 1.4 Q3: Disorders Related to Amino Acid Deficiency
- 1.5 Q4: Role of Glutamate in Amino Acid Metabolism
- 1.6 Q5: Enzyme Involvement in Amino Acid Synthesis
- 1.7 問題6: メンケス症候群とアミノ酸合成の関係
- 1.8 問題7: アミノ酸代謝とエーラーズ・ダンロス症候群
- 1.9 問題8: グルタミン酸脱水素酵素の役割
- 1.10 問題9: アミノ酸合成におけるアロステリック調節
- 1.11 問題10: 窒素代謝におけるトランスアミナーゼの役割
- 1.12 問題1: アミノ酸の必須性について
- 1.13 問題2: アミノ酸の解毒と役割
- 1.14 問題3: アミノ酸の酸性・塩基性
- 1.15 問題4: アミノ酸合成の役割
- 1.16 問題5: アミノ酸代謝の疾患に関連する遺伝子
- 2 Ch 28:Catabolism of Proteins & of Amino Acid Nitrogen
- 2.1 OBJECTIVES
- 2.2 SUMMARY
- 2.3 Q1:正の窒素バランスと負の窒素バランス
- 2.4 Q2:タンパク質代謝回転の速度
- 2.5 Q3:ATP非依存的なタンパク質分解
- 2.6 Q4:動物における窒素排出の形式
- 2.7 Q5:代謝におけるアラニンの役割
- 2.8 Q6:ATP依存的なタンパク質分解とユビキチン(Ubiquitin)の役割
- 2.9 Q7:ユビキチン関連遺伝疾患
- 2.10 Q8:筋肉と肝臓におけるアミノ酸交換
- 2.11 Q9:異なる動物の窒素代謝最終産物
- 2.12 Q10:尿素合成におけるアミノ基転移反応
- 2.13 Q11:グルタミン酸デヒドロゲナーゼの役割
- 2.14 Q12:カルバモイルリン酸合成酵素Iの役割
- 2.15 Q13:グルタミンシンテターゼの役割
- 2.16 Q14:アンモニア中毒の危険性
- 2.17 Q15:オルニチンカルバモイル転移酵素の役割
- 2.18 Q16:アルギニノコハク酸合成酵素の役割
- 2.19 Q17:尿素サイクル酵素の増加に影響を与える要因
- 2.20 Q18:酸塩基平衡におけるアンモニア排出の役割
- 2.21 Q19:遺伝性代謝疾患の一般的特徴
- 2.22 Q20:尿素サイクルにおける代謝障害
- 2.23 Q21:オルニチンカルバモイル転移酵素欠損症の特徴
- 2.24 Q22:N-アセチルグルタミン酸合成酵素欠損症
- 2.25 Q23:新生児の代謝スクリーニングにおけるタンデム質量分析
- 2.26 Q24:アルギニノコハク酸リアーゼ欠損症の特徴
- 2.27 Q25:尿素サイクル酵素欠損症における分子遺伝学的診断
- 2.28 Q26:タンデム質量分析における偽陽性の原因
- 3 Ch 29:Catabolism of the Carbon Skeletons of Amino Acids
- 3.1 OBJECTIVES
- 3.2 SUMMARY
- 3.3 Q1:代謝障害の早期発見の重要性
- 3.4 Q2:アミノ酸の炭素骨格の代謝
- 3.5 Q3:プロリンの代謝異常
- 3.6 Q4:アルギニンとオルニチンの代謝異常
- 3.7 Q5:非ケトン性高グリシン血症の原因
- 3.8 Q6:ヒスチジン代謝の代謝異常
- 3.9 Q7:システインおよびシスチン代謝に関連する疾患
- 3.10 Q8:ホモシスチン尿症とビタミンBの関係
- 3.11 Q9:遺伝子変異の影響
- 3.12 Q1:チロシン代謝の代謝異常
- 3.13 Q2:フェニルケトン尿症の原因酵素
- 3.14 Q3:トリプトファンの代謝経路に関連するビタミン
- 3.15 Q4:メープルシロップ尿症の原因
- 3.16 Q5:ハートナップ病に関連する代謝異常
- 3.17 Q6:タイプIチロシン血症の原因酵素
- 3.18 Q7:タイプIIチロシン血症の治療法
- 3.19 Q8:イソ吉草酸血症の特徴
- 4 Ch 30:Conversion of Amino Acids to Specialized Products
Ch 27:Biosynthesis of the Nutritionally Nonessential Amino Acids
OBJECTIVES
1. Why the absence of certain amino acids from the human diet typically is not deleterious to human health
- 解説:
- 人間の体は、ほとんどのアミノ酸を合成する能力を持っているため、必須アミノ酸(必須アミノ酸:食事から摂取する必要があるアミノ酸)を除いて、ほとんどのアミノ酸は食事に依存せずに合成されます。したがって、これらの非必須アミノ酸が不足しても健康に深刻な影響を与えることはほとんどありません。例えば、アラニンやグルタミン酸は体内で合成されるため、通常、これらが食事から欠如していても問題になりません。
2. Essential vs. nutritionally essential amino acids
- 解説:
- **Essential amino acids(必須アミノ酸)**は、人体が合成できないアミノ酸で、食事から摂取しなければならないものです。一方、**Nutritionally essential amino acids(栄養的に必須のアミノ酸)**は、体内で合成されるものの、特定の状況(成長期、病気中、ストレス時など)では食事から摂取しなければならない場合のあるアミノ酸です。例えば、アルギニンは通常は体内で合成可能ですが、成長期の子供には栄養的に必須です。
- 非必須アミノ酸(Nutritionally nonessential amino acids)としては、アラニン、グルタミン酸、アスパラギン酸、グリシンなどが挙げられます。
| 栄養学的必須アミノ酸 (Nutritionally Essential) | 栄養学的非必須アミノ酸 (Nutritionally Nonessential) |
|---|---|
| アルギニン (Arginine)* | アラニン (Alanine) |
| ヒスチジン (Histidine) | アスパラギン (Asparagine) |
| イソロイシン (Isoleucine) | アスパラギン酸 (Aspartate) |
| ロイシン (Leucine) | システイン (Cysteine) |
| リジン (Lysine) | グルタミン酸 (Glutamate) |
| メチオニン (Methionine) | グルタミン (Glutamine) |
| フェニルアラニン (Phenylalanine) | グリシン (Glycine) |
| スレオニン (Threonine) | ヒドロキシプロリン (Hydroxyproline)** |
| トリプトファン (Tryptophan) | ヒドロキシリジン (Hydroxylysine)** |
| バリン (Valine) | プロリン (Proline) |
| セリン (Serine) | |
| チロシン (Tyrosine) |
注釈:
- アルギニン (Arginine) は、通常は非必須アミノ酸ですが、特定の状況(例: 新生児や病気の際)では必須アミノ酸として扱われます。
- ヒドロキシプロリン (Hydroxyproline) と ヒドロキシリジン (Hydroxylysine) は、コラーゲンに関連したアミノ酸で、体内で合成されますが、通常は非必須とされています。
3. Intermediates of the citric acid cycle and glycolysis as precursors of amino acids
- 解説:
- アスパラギン酸とアスパラギンは、クエン酸回路の中間産物であるオキサロ酢酸から合成されます。
- グルタミン酸とグルタミンは、クエン酸回路の中間産物であるα-ケトグルタル酸から合成されます。
- グリシンとセリンは、グルコースから生成される3-ホスホグリセリン酸(3-phosphoglycerate)を基に合成されます。
4. Role of transaminases in amino acid metabolism
- 解説:
- トランスアミナーゼ(またはアミノ基転送酵素)は、アミノ酸のアミノ基を一つの化合物から別の化合物へ移す役割を担います。これにより、アミノ酸は互いに変換可能となり、例えばグルタミン酸とアラニンが相互に変換されます。この反応は、アミノ酸の合成や分解において重要な役割を果たします。
5. Formation of 4-hydroxyproline and 5-hydroxylysine in collagen
- 解説:
- コラーゲンの構造には4-ヒドロキシプロリン(4-hydroxyproline)と5-ヒドロキシリジン(5-hydroxylysine)が含まれています。これらは、プロリンとリジンがそれぞれヒドロキシル化(水酸基の添加)を受けることによって形成されます。この反応には、**ビタミンC(アスコルビン酸)**が必須で、ヒドロキシル化酵素の補因子として機能します。
6. Clinical presentation of scurvy and biochemical explanation
- 解説:
- 壊血病(scurvy)は、ビタミンC(アスコルビン酸)の不足により引き起こされ、症状としては、歯茎の出血、出血傾向、関節の痛み、皮膚のあざなどがあります。ビタミンCは、コラーゲン合成に必要なヒドロキシル化反応を助けるため、ビタミンCが不足すると、コラーゲンが適切に合成されず、結合組織が弱くなり、これらの症状が現れます。
7. Selenocysteine in mammalian proteins
- 解説:
- セレノシステインは、いくつかの哺乳動物のタンパク質の必須成分であり、セレン(selenium)が含まれています。セレノシステインは、システインの硫黄原子をセレン原子に置き換えたもので、酵素活性において重要な役割を果たします。しかし、セレン自体は毒性があるため、その取り扱いには注意が必要です。
8. Reaction catalyzed by a mixed-function oxidase
- 解説:
- ミクスド・ファンクション・オキシダーゼは、基質と酸素を使って酸化反応を行う酵素です。これらは、基質に酸素分子を導入し、酸素の一部を水として排出します。例としては、薬物代謝を行うシトクロムP450が挙げられます。
9. Role of tetrahydrobiopterin in tyrosine biosynthesis
- 解説:
- **テトラヒドロビオプテリン(BH₄)**は、チロシン合成において必須の補因子です。特に、フェニルアラニン水酸化酵素(phenylalanine hydroxylase)の反応において、フェニルアラニンをチロシンに変換するために必要です。この反応において、BH₄は電子供与体として作用します。
10. Role of modified tRNA in cotranslational insertion of selenocysteine
- 解説:
- セレノシステインは、特別な修飾tRNA(転写後修飾tRNA)を使用して、翻訳中に特定のタンパク質に挿入されます。この修飾tRNAは、セレノシステインのコドンであるUGAを認識し、セレノシステインをポリペプチド鎖に組み込みます。これにより、セレノシステインは正確にタンパク質に組み込まれ、機能的な酵素を形成します。
Q1: Biosynthesis of Nonessential Amino Acids
Question:
Which of the following enzymes plays a central role in the formation of glutamine from glutamate?
a. Glutamate dehydrogenase
b. Glutamine synthetase
c. Aspartate aminotransferase
d. Serine hydroxymethyltransferase
Answer:
b. Glutamine synthetase
解説:
グルタミン合成は、グルタミン酸(glutamate)からグルタミン(glutamine)を合成する過程で、グルタミン合成酵素(glutamine synthetase)が重要な役割を果たします。この反応は、ATPを使ってグルタミン酸をγ-グルタミルリン酸に変換し、その後アミン(NH₄⁺)が加わることでグルタミンが生成されます。他の選択肢は、グルタミン合成に直接関与しません。
- a. グルタミン酸デヒドロゲナーゼ(glutamate dehydrogenase)は、グルタミン酸の還元的アミド化を触媒しますが、グルタミン合成の反応ではない。
- c. アスパラギン酸アミノトランスフェラーゼ(aspartate aminotransferase)は、アスパラギン酸の代謝に関与します。
- d. セリンヒドロキシメチルトランスフェラーゼ(serine hydroxymethyltransferase)はセリンの代謝に関与する酵素です。
Q2: Nutritionally Nonessential Amino Acids
Question:
Which of the following amino acids is NOT nutritionally essential but plays a critical role in protein biosynthesis?
a. Tryptophan
b. Glutamate
c. Lysine
d. Histidine
Answer:
b. Glutamate
解説:
グルタミン酸(glutamate)は栄養学的に非必須のアミノ酸(nutritionally nonessential amino acid)ですが、タンパク質合成において非常に重要な役割を果たします。グルタミン酸は、アミノ酸の前駆体として多くの重要な反応に関与します。必須アミノ酸は、ヒスチジン(histidine)やリジン(lysine)など、体内で合成できないため、食事から摂取する必要があります。
- a. トリプトファン(tryptophan)は必須アミノ酸で、体内で合成できません。
- c. リジン(lysine)は必須アミノ酸であり、食事から摂取する必要があります。
- d. ヒスチジン(histidine)は必須アミノ酸で、特に成長期に必要です。
Q3: Disorders Related to Amino Acid Deficiency
Question:
Which condition is primarily associated with a deficiency in protein, leading to edema and fatty liver?
a. Marasmus
b. Scurvy
c. Kwashiorkor
d. Menkes syndrome
Answer:
c. Kwashiorkor
解説:
クワシオルコル(kwashiorkor)は、栄養失調によって引き起こされ、特にタンパク質の不足が原因で発生します。特徴的な症状は浮腫(edema)や脂肪肝(fatty liver)であり、これらは蛋白質不足によって引き起こされます。マラスムス(marasmus)は、カロリーと特定のアミノ酸が不足することによって引き起こされ、体重減少が主な症状です。
- a. マラスムス(marasmus)は、カロリー不足が主な原因です。
- b. 壊血病(scurvy)は、ビタミンC不足により引き起こされ、コラーゲンの形成障害が特徴です。
- d. メンケス症候群(Menkes syndrome)は、銅不足によりコラーゲン形成に必要な酵素が働かないことによる症候群です。
Q4: Role of Glutamate in Amino Acid Metabolism
Question:
Which of the following is the precursor for the synthesis of glutamate in human cells?
a. Oxaloacetate
b. α-Ketoglutarate
c. Pyruvate
d. Acetyl-CoA
Answer:
b. α-Ketoglutarate
解説:
グルタミン酸(glutamate)は、クエン酸回路(citric acid cycle)の中間生成物であるα-ケトグルタル酸(α-ketoglutarate)から還元的アミド化反応により合成されます。これにより、細胞内でグルタミン酸が合成され、アンモニウムイオン(NH₄⁺)の有害作用を低減させることができます。
- a. オキサロ酢酸(oxaloacetate)は、アスパラギン酸(aspartate)などの他のアミノ酸の前駆体です。
- c. ピルビン酸(pyruvate)は、アラニン(alanine)や他のアミノ酸の前駆体ですが、グルタミン酸の合成には関与しません。
- d. アセチル-CoA(acetyl-CoA)は、脂肪酸合成やクエン酸回路で使用されますが、グルタミン酸の合成には直接関与しません。
Q5: Enzyme Involvement in Amino Acid Synthesis
Question:
Which enzyme is responsible for the conversion of asparagine from aspartate?
a. Glutamine synthetase
b. Aspartate aminotransferase
c. Asparagine synthetase
d. Serine hydroxymethyltransferase
Answer:
c. Asparagine synthetase
解説:
アスパラギン合成酵素(asparagine synthetase)は、アスパラギン酸(aspartate)からアスパラギン(asparagine)を合成する反応を触媒します。この反応では、グルタミン(glutamine)が窒素源として提供されます。
- a. グルタミン合成酵素(glutamine synthetase)は、グルタミン酸からグルタミンを合成する酵素です。
- b. アスパラギン酸アミノトランスフェラーゼ(aspartate aminotransferase)は、アスパラギン酸の代謝に関与しますが、アスパラギン合成には関与しません。
- d. セリンヒドロキシメチルトランスフェラーゼ(serine hydroxymethyltransferase)はセリンの代謝に関与しますが、アスパラギン合成には関与しません。
問題6: メンケス症候群とアミノ酸合成の関係
Question:
Which of the following statements is true about Menkes syndrome and its effect on amino acid metabolism?
A. Menkes syndrome results from a defect in the synthesis of cysteine.
B. Menkes syndrome is caused by a defect in copper transport, affecting the function of copper-dependent enzymes in amino acid metabolism.
C. Menkes syndrome primarily disrupts the synthesis of glutamine.
D. Menkes syndrome has no effect on amino acid metabolism.
Answer:
B. Menkes syndrome is caused by a defect in copper transport, affecting the function of copper-dependent enzymes in amino acid metabolism.
解説:
メンケス症候群(Menkes syndrome)は、銅輸送に関わるATP7A遺伝子の変異によって引き起こされます。銅は多くの酵素の補因子として重要で、アミノ酸代謝にも関与します。特に、アミノ酸の合成に関わる酵素の機能不全を引き起こし、結果的にアミノ酸の代謝異常が生じます。
問題7: アミノ酸代謝とエーラーズ・ダンロス症候群
Question:
Which amino acid metabolism defect is associated with Ehlers-Danlos syndrome (EDS)?
A. Deficiency in proline hydroxylation
B. Deficiency in cysteine metabolism
C. Excessive phenylalanine levels
D. Impaired methionine synthesis
Answer:
A. Deficiency in proline hydroxylation
解説:
エーラーズ・ダンロス症候群(EDS)は、コラーゲンの合成異常を特徴とする疾患で、特にプロリン(proline)の水酸化反応が欠損していることが関与しています。この反応はコラーゲンの合成において重要であり、アミノ酸代謝異常がコラーゲンの異常を引き起こします。
問題8: グルタミン酸脱水素酵素の役割
Question:
What is the primary role of glutamate dehydrogenase (GDH) in amino acid metabolism?
A. It converts glutamine to glutamate.
B. It catalyzes the oxidative deamination of glutamate to α-ketoglutarate.
C. It converts alanine to pyruvate.
D. It synthesizes serine from glycine.
Answer:
B. It catalyzes the oxidative deamination of glutamate to α-ketoglutarate.
解説:
グルタミン酸脱水素酵素(GDH)は、グルタミン酸(glutamate)の酸化脱アミノ反応を触媒し、α-ケトグルタル酸(α-ketoglutarate)とアンモニアを生成します。この反応は、アミノ酸の代謝経路において重要な役割を果たしています。
問題9: アミノ酸合成におけるアロステリック調節
Question:
Which of the following amino acids serves as an allosteric regulator in the synthesis of urea from amino acids?
A. Glutamine
B. Arginine
C. Cysteine
D. Serine
Answer:
B. Arginine
解説:
アルギニン(arginine)は、尿素回路におけるアロステリック調節因子として作用し、カルバモイルリン酸合成酵素(CPS1)を活性化します。これにより、アミノ酸代謝における尿素合成が調節されます。
問題10: 窒素代謝におけるトランスアミナーゼの役割
Question:
Which of the following enzymes plays a central role in the nitrogen metabolism by transferring amino groups between amino acids and α-keto acids?
A. Glutamine synthetase
B. Alanine aminotransferase (ALT)
C. Glutamate dehydrogenase
D. Phenylalanine hydroxylase
Answer:
B. Alanine aminotransferase (ALT)
解説:
アラニンアミノトランスフェラーゼ(ALT)は、アミノ酸(例えばアラニン)とα-ケト酸(例えばピルビン酸)の間でアミノ基を転送する酵素です。これにより、窒素代謝が調整され、アミノ酸の合成や分解が円滑に行われます。
問題1: アミノ酸の必須性について
Question: Which of the following amino acids is classified as essential for humans?
A) Glutamine
B) Aspartate
C) Lysine
D) Glutamic acid
Answer: C) Lysine
Explanation:
アミノ酸は必須(essential)と非必須(non-essential)に分類されます。必須アミノ酸は体内で合成できないため、食事から摂取する必要があります。リジン(Lysine)は必須アミノ酸の一つです。一方、グルタミン(Glutamine)やアスパラギン酸(Aspartate)、グルタミン酸(Glutamic acid)は体内で合成可能であるため非必須アミノ酸です。
問題2: アミノ酸の解毒と役割
Question: What is the primary function of the amino acid cysteine in the detoxification process?
A) It forms a disulfide bond with methionine
B) It acts as a precursor for glutathione
C) It serves as an intermediate in the urea cycle
D) It converts to acetyl-CoA for energy production
Answer: B) It acts as a precursor for glutathione
Explanation:
システイン(Cysteine)はグルタチオン(Glutathione)という強力な抗酸化物質の前駆体です。グルタチオンは細胞内で解毒作用を持ち、有害物質を中和する役割を果たします。システインは、グルタチオン合成に必要不可欠な成分であり、解毒プロセスにおいて重要な役割を果たします。
問題3: アミノ酸の酸性・塩基性
Question: Which of the following amino acids is classified as acidic due to its side chain?
A) Phenylalanine
B) Glutamic acid
C) Tyrosine
D) Serine
Answer: B) Glutamic acid
Explanation:
アミノ酸はその側鎖(R基)の性質によって酸性、塩基性、または中性に分類されます。グルタミン酸(Glutamic acid)は酸性アミノ酸であり、側鎖にカルボキシル基(-COOH)を持ち、これが水溶液中で解離して負の電荷を持つため、酸性を示します。
問題4: アミノ酸合成の役割
Question: Which enzyme is primarily responsible for the synthesis of tyrosine from phenylalanine?
A) Tyrosine hydroxylase
B) Phenylalanine hydroxylase
C) Aspartate aminotransferase
D) Glutamate dehydrogenase
Answer: B) Phenylalanine hydroxylase
Explanation:
フェニルアラニン(Phenylalanine)からチロシン(Tyrosine)への合成は、フェニルアラニン水酸化酵素(Phenylalanine hydroxylase)によって触媒されます。この酵素はフェニルアラニンに水酸基(-OH)を添加してチロシンを合成します。この反応が正常に機能しない場合、フェニルケトン尿症(PKU)が発症します。
問題5: アミノ酸代謝の疾患に関連する遺伝子
Question: A genetic mutation in which enzyme causes maple syrup urine disease (MSUD)?
A) Branched-chain α-ketoacid dehydrogenase
B) Urease
C) Glutamine synthetase
D) Methionine synthase
Answer: A) Branched-chain α-ketoacid dehydrogenase
Explanation:
メープルシロップ尿症(MSUD)は分岐鎖α-ケト酸デヒドロゲナーゼ(Branched-chain α-ketoacid dehydrogenase)の欠損により発症します。この酵素は分岐鎖アミノ酸(バリン、ロイシン、イソロイシン)の代謝に関与しており、これが欠損するとこれらのアミノ酸やその代謝産物が体内に蓄積し、尿がメープルシロップのような匂いを発することからこの病名がついています。
Ch 28:Catabolism of Proteins & of Amino Acid Nitrogen
OBJECTIVES
タンパク質の代謝回転(Protein Turnover)
- タンパク質の代謝回転とは、体内のタンパク質が分解されて新しいものに置き換わるプロセスです。健康な成人では、代謝回転の平均速度は1〜2%/日です。しかし、例えば**調節酵素(regulatory enzymes)**のように代謝回転が非常に速いタンパク質も存在します。これらのタンパク質は代謝調節に重要な役割を果たしているため、速やかに分解されます。
ATP依存および非依存の経路によるタンパク質代謝回転の流れ
- タンパク質の分解には、ATP依存経路とATP非依存経路の2つの主要な経路があります。**ATP依存経路(ATP-dependent pathway)**では、**ユビキチン(ubiquitin)とプロテアソーム(proteasome)**が中心的役割を果たし、短寿命タンパク質や異常タンパク質を標的とします。ユビキチンは標的タンパク質に付加され、プロテアソームによって分解されます。対照的に、**ATP非依存経路(ATP-independent pathway)では、細胞膜受容体(cell surface receptors)や循環性アシアログリコプロテイン(circulating asialoglycoproteins)などが役割を果たし、長寿命タンパク質や膜関連タンパク質はリソソーム(lysosomes)**内で分解されます。
哺乳類、鳥類、魚類における窒素代謝の最終生成物の違い
- 哺乳類は窒素代謝の最終生成物として毒性の低い尿素(urea)を生成し、これを尿中に排出します。一方、魚類は毒性の高いアンモニア(ammonia)を水中に直接排出します。鳥類は水の節約が必要なため、窒素代謝の最終生成物として尿酸(uric acid)を生成し、これを半固体の形で排出します。
アミノ基転移酵素(Transaminases)、グルタミン酸デヒドロゲナーゼ(Glutamate Dehydrogenase)、およびグルタミナーゼ(Glutaminase)の中心的な役割
- アミノ基転移酵素(transaminase)はアミノ酸とケト酸の間でアミノ基を移し、窒素代謝において重要な役割を担います。グルタミン酸デヒドロゲナーゼ(glutamate dehydrogenase)は主にグルタミン酸の脱アミノ反応を触媒してアンモニアを生成し、グルタミナーゼ(glutaminase)はグルタミンからアンモニアを遊離させます。これにより、体内で効率的に窒素が代謝されます。
NH、CO、およびアスパラギン酸のアミド窒素を尿素に変換する反応の構造式と酵素の細胞内位置
- 尿素生成には、カルバモイルリン酸(carbamoyl phosphate)からシトルリン(citrulline)やアルギニン(arginine)などの中間体が形成され、最終的に尿素が生成される経路があります。この反応は主に肝細胞内のミトコンドリアおよび細胞質で進行し、各酵素が段階ごとに特定の位置に存在して機能します。
アロステリック調節およびアセチルグルタミン酸(Acetylglutamate)の尿素合成の初期段階における役割
- 尿素合成の初期段階で、カルバモイルリン酸合成酵素I(Carbamoyl Phosphate Synthetase I)はアロステリックに調節されており、アセチルグルタミン酸(acetylglutamate)が酵素活性を促進します。これにより、尿素サイクルが効率よく開始されます。
尿素合成の各酵素における代謝欠陥が分子的には異なるが類似の臨床症状を示す理由
- 尿素合成に関わる酵素の欠陥は分子的には異なる変異によって起こりますが、いずれも体内でのアンモニア蓄積に繋がるため、共通して神経系の異常や昏睡などの類似した症状を引き起こします。
新生児の遺伝性代謝疾患のスクリーニングにおける従来のアプローチとタンデム質量分析(Tandem Mass Spectrometry)の役割
- 従来のスクリーニングは、特定の化学反応を用いて代謝異常を検出するものでしたが、タンデム質量分析(tandem mass spectrometry)はより高精度で複数の代謝物を迅速に検出することができ、スクリーニングの精度と効率を向上させました。この技術により、新生児の代謝異常の早期発見と早期治療が可能になっています。
SUMMARY
- タンパク質の分解率
- 人は毎日全身のタンパク質の1〜2%を分解しますが、分解率はタンパク質の種類や生理的な状態によって大きく異なります。特に重要な調節酵素(regulatory enzymes)は、短い半減期を持つことが多いです。
- ATP依存と非依存のタンパク質分解経路
- タンパク質はATP依存およびATP非依存の両経路によって分解されます。**ユビキチン(ubiquitin)**は多くの細胞内タンパク質を分解の標的とし、**肝細胞の細胞膜受容体(liver cell surface receptors)**は循環するアシアログリコプロテイン(asialoglycoproteins)を結合し、リソソームでの分解に導きます。
- プロテアソームによる分解
- ポリユビキチン化されたタンパク質は**プロテアソーム(proteasome)**内部のプロテアーゼによって分解されます。プロテアソームへの入り口は、ドーナツ型のタンパク質孔で管理され、ポリユビキチン化されたタンパク質のみが通過できます。
- 異なる生物における窒素の排出方法
- 魚類は毒性の高いNH₃を直接排出し、鳥類はNH₃を尿酸(uric acid)に変換して排出します。一方、高等脊椎動物はNH₃を尿素(urea)に変換します。
- 窒素代謝におけるグルタミン酸とグルタミン
- トランスアミナーゼ反応(transamination)は、アミノ酸の窒素をグルタミン酸(glutamate)に移し、窒素代謝の中心的役割を果たします。**グルタミン合成酵素(glutamine synthetase)**はNH₃を無毒なグルタミン(glutamine)に変換し、**グルタミナーゼ(glutaminase)**はNH₃を遊離して尿素合成に使用します。
- 尿素合成の原料と場所
- NH₃、CO₂、アスパラギン酸(aspartate)のアミド窒素が尿素を構成する原子を提供します。肝臓での尿素合成は、一部はミトコンドリアマトリックス内で、一部は細胞質で行われます。また、酵素レベルの変化やカルバモイルリン酸合成酵素I(carbamoyl phosphate synthetase I)のアロステリック調節が尿素合成を制御します。
- 尿素サイクル酵素の欠損と代謝異常
- 尿素サイクルに関与する各酵素やオルニチンキャリア(ORC1)、NAGSの欠損に関連する代謝疾患が存在します。
- 代謝障害の一般原則
- 尿素合成の代謝障害は、すべての代謝障害に共通する6つの一般的な原則を示します。これには、異なる酵素の欠損が類似の臨床症状を引き起こすことが含まれます。
- 新生児スクリーニングにおけるタンデム質量分析
- 新生児の遺伝性代謝疾患のスクリーニングにおいては、タンデム質量分析(tandem mass spectrometry)が最も適した技術とされています。これは、迅速かつ正確に代謝異常を検出するためです。
Q1:正の窒素バランスと負の窒素バランス
問題文:Which of the following conditions is associated with a negative nitrogen balance?
a. Growth
b. Pregnancy
c. Surgery
d. Weightlifting
Answer: c. Surgery
解説:
負の窒素バランス(negative nitrogen balance)は、窒素の排出が摂取量を上回る状態を指します。手術(surgery)や進行がん、栄養失調症(kwashiorkorやmarasmus)で見られることが多く、これらの状態ではタンパク質が分解されます。**選択肢a(成長/Growth)とb(妊娠/Pregnancy)**はタンパク質が増加するため、正の窒素バランスを示します。**選択肢d(ウエイトリフティング/Weightlifting)**も通常は筋肉合成を促進するため、窒素バランスを増加させます。
生物医学的重要性についての解説
正常な成人では、摂取する窒素量(nitrogen intake)と排泄される窒素量(nitrogen excreted)は均衡しています。このバランスの崩れは以下のように分類されます。
1. 正の窒素バランス(Positive nitrogen balance)
摂取窒素量が排泄窒素量を上回る状態を指します。この状態は、**成長期(growth)や妊娠(pregnancy)**など、体が新しい組織を形成する際に見られます。
2. 負の窒素バランス(Negative nitrogen balance)
排泄窒素量が摂取窒素量を上回る状態で、以下の状況で観察されます:
- 手術後(surgery)
- 進行がん(advanced cancer)
- 栄養障害(nutritional disorders):特に**クワシオルコル(kwashiorkor)やマラスムス(marasmus)**が該当します。
3. 遺伝性疾患とユビキチン関連タンパク質分解経路
ユビキチン(ubiquitin)やユビキチンリガーゼ(ubiquitin ligases)、脱ユビキチン化酵素(deubiquitinating enzymes)の遺伝子に欠陥がある場合、以下のような疾患が発症します:
- アンジェルマン症候群(Angelman syndrome)
- 若年性パーキンソン病(juvenile Parkinson disease)
- フォンヒッペル・リンドウ症候群(von Hippel-Lindau syndrome)
- 先天性多血症(congenital polycythemia)
4. アンモニア代謝と尿素回路の役割
アンモニア(ammonia)は人体において、主にアミノ酸のα-アミノ窒素(α-amino nitrogen)から生成されます。しかし、アンモニアは高い毒性を持つため、以下のプロセスで無毒化されます:
- グルタミン(glutamine):組織内でアンモニアは無毒なアミノ酸グルタミンのアミド窒素(amide nitrogen)に変換されます。
- 脱アミド化(deamination):肝臓でグルタミンが脱アミド化されることでアンモニアが再放出されます。
- 尿素への変換(conversion to urea):肝臓ではアンモニアを効率的に尿素(urea)に変換します。尿素は毒性がなく、尿として排泄されます。
5. 肝機能障害と高アンモニア血症
**肝硬変(cirrhosis)や肝炎(hepatitis)**など肝機能が低下すると、血中アンモニア濃度が上昇し、**高アンモニア血症(hyperammonemia)**を引き起こします。これにより、臨床症状(clinical signs and symptoms)が現れます。
6. 尿素回路の酵素欠損
尿素回路(urea cycle)の各酵素に欠陥がある場合、代謝障害(metabolic defects)が発生し、生理学的影響を及ぼします。尿素回路は他のヒト代謝障害の分子モデルとしても有用です。
このように窒素代謝や尿素回路は、生体における窒素排泄や毒性の軽減、さらに遺伝性疾患との関連において重要な役割を果たします。
Q2:タンパク質代謝回転の速度
問題文:Which of the following statements about protein turnover is correct?
a. All proteins have similar half-lives.
b. Regulatory enzymes have shorter half-lives than housekeeping enzymes.
c. Housekeeping enzymes have half-lives of about 2 hours.
d. Proteins are never degraded unless they are misfolded.
Answer: b. Regulatory enzymes have shorter half-lives than housekeeping enzymes.
解説:
調節酵素(regulatory enzymes)は通常、細胞内の機能調整を迅速に行う必要があるため、短い半減期(half-life)を持ちます。選択肢aは誤りで、タンパク質の半減期はそれぞれ異なります。選択肢cも誤りで、ハウスキーピング酵素(housekeeping enzymes)の半減期は100時間以上と長いです。選択肢dは誤りで、全てのタンパク質が新陳代謝により分解と合成を繰り返しています。
調節酵素(regulatory enzymes)は、細胞内での特定の反応の速度や調整に関わる重要な役割を持ちます。そのため、細胞環境や代謝ニーズの変化に即座に応答する必要があります。これにより、これらの酵素は短い半減期(half-life)を持つ傾向があります。短い半減期により、調節酵素の濃度や活性が素早く変化し、細胞が急速に必要な調整を行うことが可能となります。
- 短い半減期が必要な理由
- 調節酵素は細胞内で迅速な調整を行うために、分解と再合成が頻繁に行われ、代謝活動に柔軟に応じることが求められます。
- 細胞のエネルギー供給や生理的な要求に応じて、酵素の活性を急速に変えることが可能となり、代謝調整に大きく寄与します。
- 例
- ホスホフルクトキナーゼ(PFK):解糖系の律速酵素として働き、エネルギー需要が増加すると、急速に反応速度が増加するため、短い半減期を持ちます。
- ホルモン依存性のキナーゼ:ホルモンのシグナルに反応して活性が変化する酵素は、刺激に素早く応答しやすい短い半減期を持ちます。
Q3:ATP非依存的なタンパク質分解
問題文:Which pathway is primarily responsible for the degradation of extracellular and membrane-associated proteins?
a. ATP-dependent proteasome pathway
b. Lysosomal pathway
c. Ubiquitin-mediated degradation
d. Mitochondrial pathway
Answer: b. Lysosomal pathway
解説:
細胞外や膜結合タンパク質(extracellular and membrane-associated proteins)は、主にリソソーム(lysosome)によってATP非依存的(ATP-independent)に分解されます。**選択肢a(ATP依存性プロテアソーム経路/ATP-dependent proteasome pathway)と選択肢c(ユビキチン依存的分解/Ubiquitin-mediated degradation)**は、主に短寿命や異常タンパク質の細胞質内分解に用いられます。**選択肢d(ミトコンドリア経路/Mitochondrial pathway)**はタンパク質分解の主要経路ではありません。
細胞外や膜結合タンパク質(extracellular and membrane-associated proteins)は、主にリソソーム(lysosome)によって分解されます。この分解経路はATP非依存的(ATP-independent)であるため、エネルギーを消費せずにタンパク質を分解できる特徴があります。
リソソームによるATP非依存的な分解の特徴
- リソソームの役割
- リソソームは、細胞内の不要な物質や異物、損傷したオルガネラ、さらには細胞外や膜結合タンパク質の分解を担います。
- 酸性環境下で働くさまざまな加水分解酵素(プロテアーゼ、リパーゼ、ヌクレアーゼなど)を含んでおり、タンパク質を効率的に分解します。
- 特に、リソソームはATPを使用せずに分解を行うため、エネルギー効率の良い方法です。
- ATP非依存的な分解の利点
- ATPの消費がないため、エネルギー節約が可能です。
- 長寿命で安定性の高いタンパク質を分解する場合や、細胞のエネルギー供給が低下している状況でも分解機能を維持できます。
対照的なATP依存的な分解経路
- ユビキチン-プロテアソーム系
- 細胞内の短命なタンパク質や異常タンパク質は、ATP依存的なユビキチン-プロテアソーム系で分解されます。この経路では、タンパク質がユビキチンで標識され、プロテアソームにより分解されるプロセスが含まれます。
- この系は細胞の品質管理に関与し、迅速にタンパク質を除去する必要がある場合に使われますが、ATPを消費する点でリソソーム分解と異なります。
Q4:動物における窒素排出の形式
問題文:What is the primary nitrogen excretion product in birds?
a. Urea
b. Ammonia
c. Uric acid
d. Glutamine
Answer: c. Uric acid
解説:
鳥類(birds)は窒素を主に「尿酸(uric acid)」として排出し、水の節約と低体重の維持に役立てています。**選択肢a(尿素/Urea)**はヒトや多くの陸生動物の主要な窒素排出産物であり、**選択肢b(アンモニア/Ammonia)**は魚類(特に淡水魚)が使用する排出形式です。**選択肢d(グルタミン/Glutamine)**は窒素輸送には重要ですが、排出物の主要成分ではありません。
鳥類が尿酸を排出する理由
- 水の節約
- 尿酸は、他の窒素排出物(アンモニアや尿素)と比べて水にほとんど溶けないため、固体の結晶として排出されます。このため、尿酸の生成には少量の水しか必要とせず、体内の水分を効率的に節約することができます。特に乾燥した環境に生息する鳥類にとって、水の節約は重要な適応です。
- 低体重の維持
- 鳥類は飛行を行うため、軽量化が必須です。尿酸は結晶の形で排出されるため、体内に余分な水分を保持せず、重量の増加を防ぎます。この特徴により、鳥類は効率的に飛行が可能な体重を保てるのです。
他の動物との比較
- 哺乳類: 哺乳類は主に尿素(urea)を窒素排出物として使用し、大量の水で排出されます。
- 魚類: 魚類は水中生活を行うため、毒性の高いアンモニア(ammonia)を直接排出します。
Q5:代謝におけるアラニンの役割
問題文:Which amino acid is considered a key gluconeogenic amino acid, especially significant in the liver?
a. Leucine
b. Glutamine
c. Alanine
d. Valine
Answer: c. Alanine
解説:
アラニン(Alanine)は糖新生(gluconeogenesis)において肝臓(liver)で重要な役割を果たします。**選択肢a(ロイシン/Leucine)**はケトジェニックアミノ酸であり、糖新生には寄与しません。**選択肢b(グルタミン/Glutamine)**は腎臓や腸で重要ですが、糖新生の主要基質ではありません。**選択肢d(バリン/Valine)**は主に筋肉や脳で使用され、直接糖新生に関わるものではありません。
糖新生(gluconeogenesis)は、非炭水化物からグルコースを生成する代謝経路であり、特に空腹時において肝臓(liver)で重要な役割を果たします。糖新生の主要な基質として働くアミノ酸の一つが**アラニン(Alanine)**です。筋肉で生成されたアラニンは血流を通して肝臓に運ばれ、そこでピルビン酸(pyruvate)に変換され、さらにグルコース合成に利用されます。このように、アラニンは筋肉と肝臓の間でアラニン-グルコースサイクル(Alanine-glucose cycle)を形成し、糖新生に重要な役割を果たします。
一方、他の選択肢については以下の理由で糖新生には直接関与していません:
- 選択肢a(ロイシン/Leucine)
ロイシンはケトジェニックアミノ酸であり、主にアセトアセチルCoAやアセチルCoAに代謝されます。これらの分子はクエン酸回路(TCA cycle)を通じてエネルギー生成には寄与しますが、グルコース合成には利用されません。そのため、ロイシンは糖新生には寄与しません。 - 選択肢b(グルタミン/Glutamine)
グルタミンは腎臓や腸でエネルギー源として利用され、アンモニアの産生にも関与しますが、糖新生の主要基質としては扱われていません。主にエネルギー代謝や窒素代謝に関与しています。 - 選択肢d(バリン/Valine)
バリンは分枝鎖アミノ酸(branched-chain amino acid, BCAA)の一つで、主に筋肉や脳で利用されます。糖新生への直接の寄与は少なく、アラニンのような主要基質ではありません。
Q6:ATP依存的なタンパク質分解とユビキチン(Ubiquitin)の役割
問題文:Which of the following statements about ubiquitin-dependent protein degradation is correct?
a. Ubiquitin targets only extracellular proteins for degradation.
b. Ubiquitin attaches to target proteins by forming bonds with lysine residues.
c. Ubiquitin-mediated degradation is an ATP-independent process.
d. The proteasome does not require ubiquitin to recognize proteins.
Answer: b. Ubiquitin attaches to target proteins by forming bonds with lysine residues.
解説:
ユビキチン(Ubiquitin)は、細胞内のタンパク質を選別して分解するために重要な役割を果たす小さなタンパク質です。ユビキチンは異常または短寿命のタンパク質に付加され、これによってプロテアソーム(proteasome)という複合体によって認識され、分解の標的となります。この過程にはエネルギーが必要で、ATP依存的(ATP-dependent)に進行します。ユビキチンは、標的タンパク質のリジン(lysine)残基に結合し、複数のユビキチン分子が連続して付加されることで「ユビキチン鎖」を形成します。プロテアソームは、このユビキチン鎖を認識し、ユビキチンが付加されたタンパク質を捕えて分解します。
選択肢の誤りについての詳細な解説:
選択肢dの誤り
プロテアソームはユビキチン鎖が付加されたタンパク質を特異的に認識して分解を開始します。このため、「ユビキチンを付加されていないタンパク質」をプロテアソームが分解するとする選択肢dも誤りです。
選択肢aの誤り
ユビキチンは細胞内の「異常」または「短寿命」のタンパク質に付加されて、不要または機能不全のタンパク質を効率よく分解する役割を担います。したがって、選択肢aで「ユビキチンが異常または短寿命のタンパク質に結合しない」とする記述は誤りです。
選択肢cの誤り
ユビキチン-プロテアソーム系はATP依存的(ATP-dependent)に進行します。ATPはユビキチンの付加や、プロテアソームによるタンパク質の分解プロセスに必要です。したがって、ATPを必要としないとする選択肢cの記述は誤りです。
Q7:ユビキチン関連遺伝疾患
問題文:Which genetic disorder is associated with defects in genes encoding ubiquitin or ubiquitin-related enzymes?
a. Cystic fibrosis
b. Angelman syndrome
c. Down syndrome
d. Turner syndrome
Answer: b. Angelman syndrome
解説:
アンジェルマン症候群(Angelman syndrome)は、主に発達遅延や運動失調、特徴的な笑顔などが見られる神経発達障害です。この疾患の原因には、ユビキチン(ubiquitin)関連の遺伝子、特にUBE3A遺伝子の異常が含まれます。このUBE3A遺伝子は、特定のタンパク質にユビキチンを付加する役割を持つ酵素(ユビキチンリガーゼ)をコードしています。このため、UBE3A遺伝子の欠損や異常によって、細胞内での不要なタンパク質の処理や分解がうまくいかなくなり、神経系に影響を与え、アンジェルマン症候群の症状が現れると考えられています。
他の選択肢との違いについての解説:
選択肢d(ターナー症候群/Turner syndrome)
ターナー症候群は、X染色体の欠失または部分的な欠損によって生じる疾患です。主に女性に見られ、成長や性発達に影響を与えます。ユビキチンやユビキチン関連酵素の遺伝子とは無関係です。
選択肢a(嚢胞性線維症/Cystic fibrosis)
嚢胞性線維症は、CFTR遺伝子における変異が原因であり、ユビキチンやユビキチン関連酵素の遺伝子とは関係ありません。CFTR遺伝子は塩化イオンの輸送に関与し、特に肺や消化器系の機能に影響を与える遺伝子です。
選択肢c(ダウン症/Down syndrome)
ダウン症は染色体異常に起因する疾患で、21番染色体が3本存在することで発症します。ユビキチンやユビキチン関連遺伝子の異常ではなく、染色体の数的異常が原因です。
Q8:筋肉と肝臓におけるアミノ酸交換
問題文:Which amino acid is primarily released by muscle into the bloodstream and taken up by the liver for gluconeogenesis?
a. Glutamine
b. Alanine
c. Serine
d. Valine
Answer: b. Alanine
解説:
アラニン(Alanine)は、糖新生(gluconeogenesis)において重要な役割を果たすアミノ酸です。空腹時や運動時に筋肉で分解され、血流を通じて肝臓に運ばれます。肝臓でアラニンはピルビン酸(pyruvate)に変換され、これがグルコース合成に利用されることで、体内のエネルギー源として供給されます。
選択肢a(グルタミン / Glutamine)
- 利用場所と役割
グルタミンは腸や腎臓、免疫細胞で重要なエネルギー源として利用され、細胞の成長や修復、免疫応答にも関与しています。また、窒素の運搬にも重要な役割を果たしており、血液を通して窒素を運び、他の組織へ窒素供給を行います。 - 糖新生との関係
グルタミンは腎臓で糖新生の基質として利用されることもありますが、肝臓での主な糖新生の基質にはなりません。肝臓では、アラニンのように直接ピルビン酸に変換されるアミノ酸が糖新生で利用されやすいため、グルタミンの役割は限定的です。
選択肢c(セリン / Serine)
- 利用場所と役割
セリンは主に腎臓で供給され、体内で多くの代謝経路に利用されます。例えば、ホスファチジルセリンの合成に関与して細胞膜の構築に役立ったり、神経系で神経伝達物質の合成にも関わっています。また、メチル基供与体であるS-アデノシルメチオニン(SAM)合成の前駆体としても利用され、DNAメチル化やタンパク質のメチル化などに寄与します。 - 糖新生との関係
セリンは糖新生の直接的な基質としては利用されにくく、むしろ他の代謝プロセスで消費されることが多いです。糖新生の基質としてはアラニンやグリシンの方が主要です。
選択肢d(バリン / Valine)
- 利用場所と役割
バリンは分枝鎖アミノ酸(BCAA)の一つで、主に筋肉で代謝され、筋肉や脳のエネルギー源として重要です。分枝鎖アミノ酸は、筋肉においてタンパク質合成を促進し、筋肉の損傷を修復するのに役立ちます。また、バリンは脳関門を通過できるため、脳でも取り込まれて利用されます。 - 糖新生との関係
バリンは主に筋肉や脳で消費され、肝臓での糖新生に利用されることはほとんどありません。アラニンのように糖新生で重要な役割を果たすわけではなく、体内での用途が異なっています。
Q9:異なる動物の窒素代謝最終産物
問題文:Which of the following is the primary nitrogen excretion product in aquatic animals such as fish?
a. Urea
b. Ammonia
c. Uric acid
d. Creatinine
Answer: b. Ammonia
解説:
水生動物(aquatic animals)は主にアンモニア(ammonia)として窒素を排出します。**選択肢a(尿素/Urea)**はヒトや多くの陸生動物の排出産物、**選択肢c(尿酸/Uric acid)**は鳥類など乾燥環境での水分保存が必要な動物に特徴的です。**選択肢d(クレアチニン/Creatinine)**は筋肉代謝の副産物で、窒素代謝の主要な排出形式ではありません。
Q10:尿素合成におけるアミノ基転移反応
問題文:Which enzyme is responsible for transferring amino groups to α-ketoglutarate during urea biosynthesis?
a. Glutaminase
b. Alanine-pyruvate aminotransferase
c. Carbamoyl phosphate synthetase I
d. Ornithine transcarbamoylase
Answer: b. Alanine-pyruvate aminotransferase
解説:
アラニン-ピルビン酸アミノトランスフェラーゼ(alanine-pyruvate aminotransferase)は、アラニンからα-ケトグルタル酸(α-ketoglutarate)にアミノ基を転移させる酵素です。この反応によってアラニンはピルビン酸(pyruvate)に変換され、ピルビン酸は糖新生(gluconeogenesis)に利用されることが多いです。α-ケトグルタル酸はアミノ基を受け取るとグルタミン酸(glutamate)となり、さらに他の代謝経路に関わることができます。
他の選択肢について
選択肢d(オルニチンカルバモイル転移酵素/Ornithine transcarbamoylase)
オルニチンカルバモイル転移酵素も尿素回路で働く酵素で、オルニチンとカルバモイルリン酸を反応させてシトルリン(citrulline)を生成します。この反応もアンモニアの処理と尿素生成に重要ですが、糖新生とは直接関係がありません。
選択肢a(グルタミナーゼ/Glutaminase)
グルタミナーゼは、グルタミン(glutamine)からアミド窒素を取り除き、グルタミン酸に変換する酵素です。この酵素は主に腎臓や肝臓で働き、体内での窒素排出に関与しています。糖新生ではなく、主に窒素代謝に関係しています。
選択肢c(カルバモイルリン酸合成酵素I/Carbamoyl phosphate synthetase I)
カルバモイルリン酸合成酵素Iは、尿素回路(urea cycle)の最初のステップで、アンモニアと炭酸からカルバモイルリン酸を生成する酵素です。この酵素の働きは、アンモニアを無毒化して尿素に変えるために重要で、特に肝臓でのアンモニア代謝に関わります。糖新生には関与していません。
Q11:グルタミン酸デヒドロゲナーゼの役割
問題文:Which enzyme plays a central role in releasing nitrogen as ammonia from glutamate?
a. Arginase
b. Glutamate dehydrogenase
c. Alanine aminotransferase
d. Glutaminase
Answer: b. Glutamate dehydrogenase
解説:
グルタミン酸デヒドロゲナーゼ(glutamate dehydrogenase)は、グルタミン酸からアンモニア(NH₃)を取り除く重要な酵素です。この酵素は、グルタミン酸を酸化してα-ケトグルタル酸(α-ketoglutarate)とアンモニアを生成する反応を促進します。この過程は「トランス脱アミン反応(transdeamination)」と呼ばれ、アミノ酸の代謝において中心的な役割を果たします。
他の選択肢について
選択肢d(グルタミナーゼ / Glutaminase)
グルタミナーゼは、グルタミンからアミド窒素を取り除いてグルタミン酸とアンモニアを生成します。この反応は腎臓で主に行われ、体内の酸塩基バランスの調整にも寄与しますが、グルタミン酸デヒドロゲナーゼのような直接的なトランス脱アミン反応ではありません。
選択肢a(アルギナーゼ / Arginase)
アルギナーゼは、尿素回路(urea cycle)で働く酵素で、アルギニンから尿素を生成します。この酵素は、アンモニアの排出に役立つ尿素を生成し、主に肝臓で機能しますが、トランス脱アミン反応には関与しません。
選択肢c(アラニンアミノトランスフェラーゼ / Alanine aminotransferase)
アラニンアミノトランスフェラーゼは、アラニンとα-ケトグルタル酸の間でアミノ基を転移し、ピルビン酸とグルタミン酸を生成する反応を触媒します。この反応はアミノ酸代謝の一環で、アンモニアの直接的な生成には関与しません。
Q12:カルバモイルリン酸合成酵素Iの役割
問題文:What molecule serves as an allosteric activator for carbamoyl phosphate synthetase I, the rate-limiting enzyme of the urea cycle?
a. ATP
b. ADP
c. N-acetylglutamate
d. Glutamine
Answer: c. N-acetylglutamate
解説:
カルバモイルリン酸合成酵素I(carbamoyl phosphate synthetase I)は尿素サイクル(urea cycle)の律速酵素であり、N-アセチルグルタミン酸(N-acetylglutamate)によってアロステリックに活性化されます。**選択肢a(ATP)とb(ADP)**はエネルギー分子ですが、直接的なアロステリック効果はありません。**選択肢d(グルタミン/Glutamine)**は窒素の運搬に重要ですが、活性化因子ではありません。
Q13:グルタミンシンテターゼの役割
問題文:Which enzyme catalyzes the formation of glutamine from glutamate and ammonia in the mitochondria?
a. Glutaminase
b. Glutamate dehydrogenase
c. Glutamine synthetase
d. Aspartate transaminase
Answer: c. Glutamine synthetase
解説:
グルタミンシンテターゼ(glutamine synthetase)はミトコンドリアでグルタミン酸(glutamate)とアンモニア(ammonia)からグルタミン(glutamine)を生成します。**選択肢a(グルタミナーゼ/Glutaminase)**は逆にグルタミンからアンモニアを放出します。**選択肢b(グルタミン酸デヒドロゲナーゼ/Glutamate dehydrogenase)と選択肢d(アスパラギン酸アミノトランスフェラーゼ/Aspartate transaminase)**は異なる機能を持ちます。
Q14:アンモニア中毒の危険性
問題文:Which of the following is a potentially life-threatening condition caused by high ammonia levels in the blood due to liver dysfunction?
a. Acidosis
b. Alkalosis
c. Ammonia intoxication
d. Ketoacidosis
Answer: c. Ammonia intoxication
解説:
肝機能障害により血中アンモニア(ammonia)濃度が上昇すると、アンモニア中毒(ammonia intoxication)と呼ばれる生命を脅かす状態に陥ることがあります。**選択肢a(アシドーシス/Acidosis)や選択肢b(アルカローシス/Alkalosis)**は酸塩基バランスの異常ですが、アンモニアに直接関係はありません。**選択肢d(ケトアシドーシス/Ketoacidosis)**は糖尿病などで見られる状態で、アンモニアとは異なる原因です。
アンモニア中毒(Ammonia Intoxication)の解説
1. アンモニアの代謝と通常の処理
- アンモニアの発生源:腸内細菌(enteric bacteria)による代謝活動や、組織から産生されるアンモニアは、門脈血(portal venous blood)を通じて肝臓に運ばれます。
- 肝臓の役割:肝臓はアンモニアを迅速に取り除き、尿素(urea)に変換します。このため、通常、末梢血(peripheral blood)にはごくわずかな量(10–20 g/dL)のアンモニアしか存在しません。
2. 中枢神経系への毒性
- 毒性の理由:アンモニアは中枢神経系(central nervous system, CNS)に対して毒性を持ちます。このため、血中アンモニア濃度が上昇すると深刻な症状を引き起こします。
3. アンモニア中毒が発生する状況
- 門脈血流の肝臓バイパス:肝硬変(cirrhosis)などで門脈(portal vein)と体循環(systemic circulation)との間に側副血行路(collateral links)が形成される場合、門脈血が肝臓を通らず直接体循環に流れ込みます。これにより、アンモニア濃度が毒性レベルに達する可能性があります。
- 肝機能の重度な低下:肝炎や肝硬変などにより、肝臓のアンモニア処理能力が低下することも原因となります。
4. アンモニア中毒の症状
以下の症状がみられます:
- 振戦(tremor)
- 不明瞭な言語(slurred speech)
- ぼやけた視覚(blurred vision)
- 昏睡(coma)
- 最終的には死(death)
5. アンモニアが神経に与える影響
- α-ケトグルタル酸(α-ketoglutarate)との反応:アンモニアはα-ケトグルタル酸と反応し、グルタミン酸(glutamate)を生成します。
- TCA回路(Tricarboxylic Acid Cycle)の障害:α-ケトグルタル酸の枯渇により、神経細胞内でTCA回路の働きが妨げられ、エネルギー産生が低下します。これが中枢神経障害の原因となると考えられています。
6. 生体における重要性
アンモニア中毒は生命を脅かす状態であり、肝臓の機能がこの毒性を防ぐうえで不可欠です。肝臓の適切なアンモニア代謝が維持されない場合、中枢神経系の機能障害が進行し、致命的な結果を招く可能性があります。
Q15:オルニチンカルバモイル転移酵素の役割
問題文:Which enzyme catalyzes the transfer of the carbamoyl group from carbamoyl phosphate to ornithine, forming citrulline in the mitochondria?
a. Arginase
b. Ornithine transcarbamoylase
c. Glutaminase
d. Aspartate transaminase
Answer: b. Ornithine transcarbamoylase
解説:
オルニチンカルバモイル転移酵素(ornithine transcarbamoylase)はカルバモイルリン酸(carbamoyl phosphate)からオルニチン(ornithine)へのカルバモイル基の転移を触媒し、ミトコンドリア内でシトルリン(citrulline)を生成します。**選択肢a(アルギナーゼ/Arginase)**はアルギニンから尿素を生成し、**選択肢c(グルタミナーゼ/Glutaminase)とd(アスパラギン酸アミノトランスフェラーゼ/Aspartate transaminase)**は異なる役割を持ちます。
オルニチンカルバモイルトランスフェラーゼ(Ornithine Transcarbamoylase)の解説
1. オルニチンカルバモイルトランスフェラーゼとは
オルニチンカルバモイルトランスフェラーゼ(Ornithine Transcarbamoylase, OTC)は、尿素回路(urea cycle)の重要な酵素です。この酵素は以下の反応を触媒します:
- **カルバモイルリン酸(carbamoyl phosphate)とオルニチン(ornithine)が反応してシトルリン(citrulline)**を生成します。
2. X染色体連鎖性欠損症「高アンモニア血症タイプ2」
- 病態:OTCの欠損により、尿素回路が正常に機能しなくなり、アンモニア(ammonia)が体内に蓄積します。これが**高アンモニア血症タイプ2(hyperammonemia type 2)**として知られる病態です。
- 遺伝形式:この疾患は**X染色体連鎖性(X-linked inheritance)**で遺伝します。そのため、男性で重症化することが多いですが、女性キャリア(carrier)の母親にも症状が現れる場合があります。
3. 症状と母親の影響
- 母親の症状:キャリアの母親は以下の症状を示すことがあります:
- 高アンモニア血症(hyperammonemia)
- 高タンパク食への嫌悪(aversion to high-protein foods):アンモニアの蓄積を避けるための体の反応と考えられます。
4. 血中および体液中のグルタミン濃度上昇
- グルタミン濃度上昇の理由:体内でアンモニア濃度が上昇すると、毒性を軽減するためにアンモニアは**グルタミン合成(glutamine synthesis)**の形で固定されます。これにより、血液、脳脊髄液(cerebrospinal fluid, CSF)、尿中のグルタミン濃度が上昇します。
5. 臨床的意義
- 早期診断と治療の重要性:OTC欠損症は、新生児や幼児期に重篤な高アンモニア血症を引き起こす可能性があるため、早期発見と治療が必要です。
- 治療アプローチ:タンパク質摂取量の制限やアンモニアを排泄する薬剤(例:ナトリウムフェニル酪酸、ナトリウムベンゾエート)が治療に用いられます。
Q16:アルギニノコハク酸合成酵素の役割
問題文:Which of the following enzymes links aspartate and citrulline to form argininosuccinate, an intermediate in the urea cycle?
a. Argininosuccinate synthetase
b. Glutaminase
c. Carbamoyl phosphate synthetase II
d. Glutamate dehydrogenase
Answer: a. Argininosuccinate synthetase
解説:
アルギニノコハク酸合成酵素(argininosuccinate synthetase)はアスパラギン酸(aspartate)とシトルリン(citrulline)を結合させ、尿素サイクルの中間体であるアルギニノコハク酸(argininosuccinate)を生成します。選択肢b(グルタミナーゼ/Glutaminase)、選択肢c(カルバモイルリン酸合成酵素II/Carbamoyl phosphate synthetase II)、および**選択肢d(グルタミン酸デヒドロゲナーゼ/Glutamate dehydrogenase)**は異なる反応を触媒します。
Q17:尿素サイクル酵素の増加に影響を与える要因
問題文:Which condition can lead to a 10- to 20-fold increase in the concentrations of urea cycle enzymes in the liver?
a. Protein-rich diet
b. High carbohydrate intake
c. Starvation
d. High fat intake
Answer: c. Starvation
解説:
飢餓(starvation)は尿素サイクル(urea cycle)酵素の濃度を10〜20倍に増加させる要因です。これは、タンパク質の分解が増加し、アンモニアの生成が促進されるためです。**選択肢a(高タンパク食/Protein-rich diet)**も酵素の増加を引き起こす可能性がありますが、飢餓ほどの大幅な増加は見られません。**選択肢b(高炭水化物食/High carbohydrate intake)およびd(高脂肪食/High fat intake)**は尿素サイクル酵素に大きな影響を与えません。
Q18:酸塩基平衡におけるアンモニア排出の役割
問題文:Which role does ammonia excretion by renal tubular cells play in the human body?
a. Enhances protein synthesis
b. Regulates acid-base balance
c. Increases urea synthesis
d. Promotes glucose metabolism
Answer: b. Regulates acid-base balance
解説:
腎臓の尿細管細胞によるアンモニアの排出は、酸塩基平衡(acid-base balance)の調節に重要な役割を果たします。**選択肢a(タンパク質合成の促進)および選択肢d(グルコース代謝の促進)**とは無関係であり、**選択肢c(尿素合成の増加)**もアンモニアの直接的な役割ではありません。
Q19:遺伝性代謝疾患の一般的特徴
問題文:Which of the following statements is a general principle of inherited metabolic disorders related to enzyme deficiencies?
a. All metabolic disorders show unique clinical signs unrelated to other disorders.
b. Definitive diagnosis requires a quantitative assay of enzyme activity suspected to be defective.
c. Gene mutations in metabolic disorders are consistent in severity across all patients.
d. Therapy does not consider the biochemical reactions in normal versus impaired individuals.
Answer: b. Definitive diagnosis requires a quantitative assay of enzyme activity suspected to be defective.
解説:
遺伝性代謝疾患の診断において、疑われる酵素活性の定量的測定が決定的な診断法です。選択肢aは誤りで、複数の酵素欠損によって類似の臨床症状が発生することがあります。選択肢cも誤りで、同じ酵素の欠損でも遺伝子変異により症状の重症度が異なります。選択肢dは、治療法は正常および障害された生化学反応の理解に基づいています。
代謝障害(Metabolic Disorders)の一般的特徴の解説
代謝障害(metabolic disorders)は稀ではありますが、医学的に重要な遺伝性疾患であり、特に尿素合成酵素に関連する障害は次のような遺伝性代謝疾患(inherited metabolic diseases)の一般原則を示しています。
1. 多様な遺伝的変異と類似の臨床症状
- ポイント: 特定の酵素をコードする遺伝子内の異なる変異、または同一の代謝経路内の連続的な反応を触媒する異なる酵素の異常が、類似または同一の臨床症状を引き起こすことがあります。
- 例: 尿素回路の酵素欠損症(例えば、オルニチンカルバモイルトランスフェラーゼ欠損症)では、いくつかの異なる酵素の異常が高アンモニア血症という共通の症状を呈します。
2. 治療は酵素反応の理解に基づく
- ポイント: 正常な代謝経路と障害された経路における生化学的酵素反応の理解が、効果的な治療法の基盤となります。
- 例: 高アンモニア血症では、アンモニア排泄を促進する薬剤(ナトリウムフェニル酪酸やナトリウムベンゾエート)や、低タンパク食が治療の基本です。
3. 代謝ブロック前の中間体や副生成物の蓄積
- ポイント: 代謝経路が障害された場合、そのブロックの手前で中間生成物や副生成物が蓄積します。この蓄積物の特定により、どの反応が障害されているかを推測できます。
- 例: 尿素回路障害では、シトルリン(citrulline)やアルギニン(arginine)の異常な蓄積が診断の手がかりとなります。
4. 確定診断には酵素活性の定量測定
- ポイント: 疑われる酵素の活性を測定することで、障害を確認します。
- 例: オルニチンカルバモイルトランスフェラーゼ(OTC)の活性を肝細胞や線維芽細胞で測定することが、確定診断に役立ちます。
5. 遺伝子配列の比較による特定の変異の同定
- ポイント: 疾患原因となる変異を特定するために、変異型(mutant)酵素をコードする遺伝子のDNA配列を野生型(wild-type)遺伝子と比較します。
- 例: 高アンモニア血症タイプ2では、OTC遺伝子の特定の変異が疾患の原因であることが明らかにされています。
6. DNAシーケンシングの進展と多様な変異
- ポイント: 人間の遺伝子のDNAシーケンシングの進歩により、特定の遺伝子の変異が**無害であるもの(benign)**や、疾患の重症度が異なるものを含む多様なタイプであることが分かってきました。
- 例: あるOTC遺伝子変異が軽度の症状を示す一方で、別の変異は重症の高アンモニア血症を引き起こします。
Q20:尿素サイクルにおける代謝障害
問題文:Which of the following symptoms is common to all urea cycle disorders?
a. Elevated blood glucose
b. Increased blood pressure
c. Respiratory alkalosis
d. Hyperlipidemia
Answer: c. Respiratory alkalosis
解説:
尿素サイクル障害では、呼吸性アルカローシス(respiratory alkalosis)が一般的な症状として見られます。これは、アンモニア濃度の上昇により体内で酸塩基バランスが乱れるためです。選択肢a(高血糖/Elevated blood glucose)、**b(高血圧/Increased blood pressure)およびd(高脂血症/Hyperlipidemia)**は尿素サイクル障害の特徴的な症状ではありません。
尿素サイクル障害における呼吸性アルカローシスの解説
尿素サイクル障害(urea cycle disorders, UCD)は、尿素回路の酵素に異常があり、アンモニア(ammonia)が体内に蓄積する疾患です。この障害により、**呼吸性アルカローシス(respiratory alkalosis)**が一般的に見られる理由を以下に解説します。
1. アンモニアの蓄積とその影響
- アンモニアの毒性:尿素サイクルの障害により、体内のアンモニア(NH₃)が適切に尿素(urea)へと変換されず、血中アンモニア濃度が上昇します(高アンモニア血症, hyperammonemia)。
- 中枢神経系(CNS)への影響:アンモニアは脳に直接作用し、神経機能を損ないます。この影響の一つとして、脳幹の呼吸中枢が刺激されることがあります。
2. 呼吸中枢の刺激による過換気(hyperventilation)
- 呼吸中枢の反応:アンモニア濃度の上昇は、呼吸中枢を過剰に刺激し、**過換気(hyperventilation)**を引き起こします。
- 過換気では、呼吸の回数と深さが増加します。
- これにより、体内から過剰な二酸化炭素(CO₂)が排出されます。
3. 二酸化炭素の排出とアルカローシス
- CO₂の役割:CO₂は体内で炭酸(H₂CO₃)として酸性の役割を果たします。過換気によりCO₂が過剰に排出されると、以下のような酸塩基バランスの変化が生じます:
- H₂CO₃の減少 → 血液のpHが上昇 → アルカローシス(alkalosis)
- 結果:呼吸性アルカローシスが引き起こされます。
4. 症状と影響
- 呼吸性アルカローシスの症状:
- めまい(dizziness)
- 筋肉のけいれん(muscle cramps)
- しびれ感(tingling sensations)
- 代償機構の限界:腎臓が酸塩基バランスを調整するため、重炭酸イオン(HCO₃⁻)の排出を増やす代償反応を試みますが、アンモニアの持続的な蓄積により、この代償が追いつかない場合があります。
5. 臨床的意義
- 診断の手がかり:呼吸性アルカローシスは、尿素サイクル障害の重要な症候であり、血液ガス分析(arterial blood gas analysis)で確認できます。
- 治療への応用:高アンモニア血症を抑える治療(低タンパク食、アンモニア排泄促進薬)とともに、酸塩基バランスの調整も重要です。
HCO₃⁻の排出は血液を酸性側に戻す効果があります。これを詳しく説明します。
重炭酸イオンと酸塩基バランスの関係
- HCO₃⁻の役割:重炭酸イオンは体内の「塩基(アルカリ性成分)」として働きます。
- 血液がアルカリ性に傾いているとき(アルカローシス)、HCO₃⁻が過剰に存在しているため、この過剰分を排出する必要があります。
HCO₃⁻排出の効果
- HCO₃⁻を尿中に排泄することで、血液中のHCO₃⁻濃度が低下します。
- これにより、体内の緩衝システム(炭酸-重炭酸緩衝系)が以下のように反応します:H++HCO3−⇌H2CO3⇌CO2+H2O
- HCO₃⁻が減少すると、H⁺(酸性成分)が血液中に残りやすくなり、pHが低下して酸性側に戻ります。
具体例:アルカローシスの補正
- 呼吸性アルカローシスの場合:
- 過換気によってCO₂が排出されすぎ、血液中の酸性成分(H₂CO₃)が減少し、血液がアルカリ性になります。
- 腎臓はこのアルカリ性を補正するため、HCO₃⁻を尿中に排泄します。
- 代謝性アルカローシスの場合:
- HCO₃⁻の過剰摂取や酸性成分(H⁺)の喪失(例:嘔吐)で血液がアルカリ性になった場合も、腎臓がHCO₃⁻を排泄してpHを下げます。
結論
体内がアルカリ性に傾いている場合、HCO₃⁻を排泄することで血液中の塩基(アルカリ性成分)が減少し、pHが酸性側に近づきます。
したがって、HCO₃⁻の排泄は体内の酸塩基バランスを正常化するための重要な補正機構です。
Q21:オルニチンカルバモイル転移酵素欠損症の特徴
問題文:What is a distinguishing feature of ornithine transcarbamoylase deficiency in terms of its genetic inheritance?
a. It is autosomal recessive.
b. It is autosomal dominant.
c. It is X-linked.
d. It is mitochondrial.
Answer: c. It is X-linked.
解説:
オルニチンカルバモイル転移酵素欠損症(ornithine transcarbamoylase deficiency)はX染色体連鎖(X-linked)で遺伝します。**選択肢a(常染色体劣性/Autosomal recessive)やb(常染色体優性/Autosomal dominant)**は正しくありません。また、**選択肢d(ミトコンドリア/Mitochondrial)**も誤りで、ミトコンドリア遺伝ではありません。
Q22:N-アセチルグルタミン酸合成酵素欠損症
問題文:Deficiency in N-acetylglutamate synthetase (NAGS) is characterized by symptoms similar to a deficiency in which of the following enzymes?
a. Carbamoyl phosphate synthetase I
b. Ornithine transcarbamoylase
c. Argininosuccinate synthetase
d. Glutaminase
Answer: a. Carbamoyl phosphate synthetase I
解説:
N-アセチルグルタミン酸合成酵素(N-acetylglutamate synthetase, NAGS)の欠損はカルバモイルリン酸合成酵素I(carbamoyl phosphate synthetase I)の欠損と類似の症状を引き起こします。これは、NAGSがカルバモイルリン酸合成酵素Iの活性化に必要なN-アセチルグルタミン酸を生成するためです。**選択肢b(オルニチンカルバモイル転移酵素/Ornithine transcarbamoylase)や選択肢c(アルギニノコハク酸合成酵素/Argininosuccinate synthetase)**は異なる役割を持ちます。
N-Acetylglutamate Synthetase(NAGS)欠損症についての解説
1. NAGSの役割
N-Acetylglutamate synthetase(NAGS, EC 2.3.1.1)は、以下の反応を触媒する酵素です:
L-glutamate + アセチルCoA
→N-acetyl-L-glutamate + CoASH
- N-アセチルグルタミン酸(NAG)は、**カルバモイルリン酸シンターゼI(CPS1, carbamoyl phosphate synthetase I)**の活性に必須のアロステリック活性化因子です。
- この酵素反応は尿素サイクル(urea cycle)の初期段階を調節する重要なステップです。
2. NAGS欠損症の影響
- NAGSが欠損すると、NAGが十分に合成されません。
- その結果、CPS1の活性が低下し、尿素サイクルが機能しなくなります。これにより、**高アンモニア血症(hyperammonemia)**が発生します。
- 臨床的および生化学的特徴は、CPS1欠損症と非常に類似しているため、鑑別が困難な場合があります。
3. 臨床症状と治療
- 臨床症状:NAGS欠損症の患者では、以下のような症状が現れることがあります:
- 神経症状(例:嗜眠、嘔吐、痙攣、意識障害)
- 高アンモニア血症に起因する中枢神経系(CNS)障害
- 治療:NAGS欠損症は、N-アセチルグルタミン酸(NAG)の補充によって改善する可能性があります。
- 補充療法によりCPS1が正常に活性化され、尿素サイクルが回復します。
4. 尿素サイクル障害との関係
NAGS欠損症は、他の尿素サイクル酵素欠損症(例:CPS1欠損症)と症状が似ていますが、NAGの補充療法が有効であるという点で重要な鑑別点があります。
Q23:新生児の代謝スクリーニングにおけるタンデム質量分析
問題文:What is an advantage of using tandem mass spectrometry (MS) in newborn screening for metabolic disorders?
a. It only detects genetic mutations.
b. It can quickly detect multiple analytes relevant to metabolic disorders.
c. It is only used to detect urea cycle disorders.
d. It provides dietary recommendations.
Answer: b. It can quickly detect multiple analytes relevant to metabolic disorders.
解説:
タンデム質量分析(tandem mass spectrometry, MS)は、複数の代謝障害に関連する多くの分析物を迅速に検出できる点で新生児スクリーニングにおいて有用です。選択肢aは誤りで、遺伝子変異ではなく代謝物の検出に特化しています。選択肢cは正しくなく、尿素サイクル障害に限らず、広範な代謝障害の検出に使用されます。選択肢dは、MSの目的ではありません。
Q24:アルギニノコハク酸リアーゼ欠損症の特徴
問題文:Which physical feature is characteristically associated with argininosuccinate lyase deficiency?
a. Enlarged liver
b. Hair that is brittle and tufted (trichorrhexis nodosa)
c. Increased body fat
d. Overgrowth of nails
Answer: b. Hair that is brittle and tufted (trichorrhexis nodosa)
解説:
アルギニノコハク酸リアーゼ欠損症(argininosuccinate lyase deficiency)は、脆く束状になった髪(trichorrhexis nodosa)を伴うことが特徴です。選択肢a(肝臓の肥大/Enlarged liver)やc(体脂肪の増加/Increased body fat)、**d(爪の過成長/Overgrowth of nails)**はこの欠損症の特有の症状ではありません。
Argininosuccinate Lyase(ASL)欠損症についての解説
1. ASLの役割
Argininosuccinate lyase(ASL)は、尿素サイクル(urea cycle)の第4段階で働く酵素です。この酵素は以下の反応を触媒します:Argininosuccinate→Arginine+Fumarate
- **アルギニン(arginine)**は尿素サイクルの最終段階で尿素を生成するために必要です。
- **フマル酸(fumarate)**はクエン酸回路(TCA cycle)に再利用されます。
2. ASL欠損症(アルギニノコハク酸尿症, argininosuccinic aciduria)
- ASL酵素の活性が低下または欠損することで、尿素サイクルが停止し、**高アンモニア血症(hyperammonemia)**が発生します。
- 血液、脳脊髄液(cerebrospinal fluid)、および尿中にアルギニノコハク酸(argininosuccinate)が蓄積します。
3. 臨床症状
- 典型的な症状として以下が挙げられます:
- 高アンモニア血症による神経学的障害(例:昏睡、痙攣、成長遅延)
- もろい房状の髪(trichorrhexis nodosa):髪が壊れやすくなる特異的な症状
- 消化器症状(嘔吐、食欲不振)
- 発症時期により、以下のように分類されます:
- 早発型(early-onset):新生児期に重篤な症状を呈する。
- 遅発型(late-onset):小児期や成人期に軽度の症状として発現することがある。
4. 診断方法
- 診断には、赤血球中のASL活性の測定が重要です。
- 臍帯血(umbilical cord blood)や羊水細胞(amniotic fluid cells)を用いて診断することも可能です。
- 血液・尿中のアルギニノコハク酸(argininosuccinate)濃度の測定も有用です。
5. 治療
- タンパク質制限食:アンモニア産生を抑えるために必須です。
- アルギニン補充療法:欠損した尿素サイクルを部分的にバイパスし、アンモニア除去を助けます。
- 窒素除去薬(例:ナトリウムフェニル酪酸やベンゾエート):体内の過剰な窒素を排泄するために使用されます。
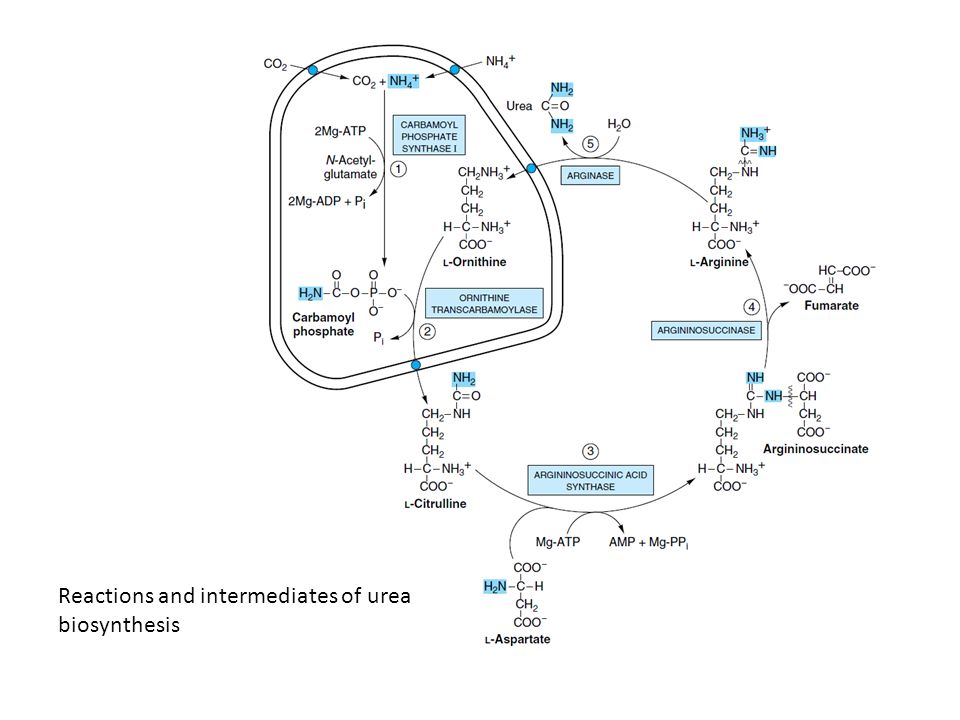
Q25:尿素サイクル酵素欠損症における分子遺伝学的診断
問題文:Which of the following is a common step in molecular genetic analysis for diagnosing a urea cycle enzyme deficiency?
a. Measuring ammonia levels only
b. Sequencing the DNA of the gene encoding the suspected enzyme
c. Identifying metabolites in urine
d. Conducting a liver biopsy
Answer: b. Sequencing the DNA of the gene encoding the suspected enzyme
解説:
尿素サイクル酵素欠損症の診断では、分子遺伝学的診断の一環として、疑われる酵素をコードする遺伝子のDNAシーケンス解析が行われます。**選択肢a(アンモニアレベルの測定/Measuring ammonia levels only)やc(尿中の代謝物の特定/Identifying metabolites in urine)**も有用ですが、直接的な遺伝子変異の確認にはDNAシーケンスが必要です。**選択肢d(肝生検/Liver biopsy)**は通常行われません。
Q26:タンデム質量分析における偽陽性の原因
問題文:Which of the following could contribute to false-positive results in tandem mass spectrometry (MS) when screening for metabolic disorders?
a. High protein intake
b. Genetic mutations unrelated to metabolic disease
c. Improper sample handling or contamination
d. Low blood sugar levels
Answer: c. Improper sample handling or contamination
解説:
タンデム質量分析(tandem mass spectrometry, MS)での偽陽性は、サンプルの不適切な取り扱いや汚染によって引き起こされる可能性があります。**選択肢a(高タンパク摂取/High protein intake)やb(代謝疾患に関連しない遺伝子変異/Genetic mutations unrelated to metabolic disease)**は直接的な偽陽性の原因ではありません。また、**選択肢d(低血糖/Low blood sugar levels)**も通常偽陽性には影響を与えません。
新生児血液分析とタンデム質量分析計(Tandem Mass Spectrometry, MS/MS)の役割
1. 背景
- 代謝酵素の欠如や機能障害による代謝疾患は、放置すると深刻な症状を引き起こします。
- しかし、**早期の食事療法(dietary intervention)**により、多くの場合、症状を緩和することが可能です。
- そのため、新生児期における代謝疾患の早期発見が重要です。
2. 新生児スクリーニングの歴史
- アメリカでは1960年代に新生児スクリーニングプログラムが開始され、現在では全ての州で実施されています。
- これにより、多くの代謝異常の早期診断と治療が可能になりました。
3. タンデム質量分析計(Tandem Mass Spectrometry, MS/MS)とは
- 高感度かつ迅速な技術で、数分以内に複数の分析対象物質(analytes)を同時に検出することができます。
- MS/MSは以下の特性を持っています:
- 多様な代謝物を同時に測定可能:40以上の代謝物を検出。
- 正確性:特定の代謝物の濃度異常を迅速に確認。
4. 対象となる疾患
MS/MSは、以下のような代謝疾患のスクリーニングに用いられます:
- 有機酸代謝異常(Organic acidemias)
- 例:メチルマロン酸血症(methylmalonic acidemia)
- アミノ酸代謝異常(Aminoacidemias)
- 例:フェニルケトン尿症(Phenylketonuria, PKU)
- 脂肪酸酸化異常(Fatty acid oxidation disorders)
- 例:中鎖アシルCoAデヒドロゲナーゼ欠損症(MCAD deficiency)
- 尿素サイクル酵素欠損症(Urea cycle enzyme defects)
- 例:カルバモイルリン酸シンターゼI欠損症(Carbamoyl phosphate synthetase I deficiency)
5. タンデム質量分析計の利点
- 迅速な処理:出生後数日で検査が可能。
- 非侵襲的なサンプル採取:主にドライスポット血液を使用。
- 幅広い疾患の検出:スクリーニングで診断可能な疾患数が多い。
6. 偽陽性の問題
- すべての検査で一定の割合で**偽陽性(false positives)**が発生する可能性があります。
- 例:一時的な代謝変化や母体からの影響による異常値。
- そのため、MS/MSの結果を確認するためには追加の診断検査が必要です。
7. 重要性と展望
- 早期治療の実現:代謝異常の早期発見により、神経学的損傷や死亡を防止できます。
- 包括的診断の可能性:MS/MSにより診断の範囲が拡大し、稀な疾患も見逃しにくくなりました。
Ch 29:Catabolism of the Carbon Skeletons of Amino Acids
OBJECTIVES
- タンパク質アミノ酸の炭素骨格からの主な代謝産物とその代謝経路
- タンパク質アミノ酸の炭素骨格は、主にピルビン酸(pyruvate)、アセチルCoA(acetyl-CoA)、オキサロ酢酸(oxaloacetate)、**フマル酸(fumarate)**などに代謝され、炭水化物や脂質の合成、エネルギー生成に利用されます。
- アミノトランスフェラーゼ(トランスアミナーゼ)の反応式と補酵素の役割
- アミノトランスフェラーゼ(aminotransferase, transaminase)反応の例として、以下の式が挙げられます: アラニン+α-ケトグルタル酸→ピルビン酸+グルタミン酸
補酵素として**ピリドキサールリン酸(PLP; pyridoxal phosphate)**が働き、アミノ基の受け渡しを仲介します。
- アミノトランスフェラーゼ(aminotransferase, transaminase)反応の例として、以下の式が挙げられます: アラニン+α-ケトグルタル酸→ピルビン酸+グルタミン酸
- タンパク質アミノ酸の代謝経路と臨床的に重要な代謝障害に関連する反応
- 各アミノ酸の代謝経路には、例えばフェニルケトン尿症(PKU; phenylketonuria)における**フェニルアラニン水酸化酵素(phenylalanine hydroxylase)の欠損や、アルカプトン尿症(alkaptonuria)におけるホモゲンチジン酸オキシダーゼ(homogentisate oxidase)**の欠損などが含まれます。
- 腎小管の再吸収の欠陥により生じるアミノ酸尿症(Aminoaciduria)とトリプトファン吸収障害の影響
- **シスチン尿症(cystinuria)**などは、腎小管での再吸収の欠陥により発生します。**ハートナップ病(Hartnup disease)**では、腸でのトリプトファン吸収が阻害され、ナイアシン(niacin)の生成不足によりペラグラ様症状が現れます。
- 同一アミノ酸の異なる代謝酵素欠損が類似の臨床症状を引き起こす理由
- 同じアミノ酸の代謝に関与する異なる酵素の欠損は、特定の代謝物の蓄積を引き起こすため、異なる分子レベルの異常でも共通した神経症状や発育障害が発生します。
- Δ’-ピロリン-5-カルボキシレートデヒドロゲナーゼの欠損がプロリンおよび4-ヒドロキシプロリン代謝に与える影響
- Δ’-ピロリン-5-カルボキシレートデヒドロゲナーゼ(Δ’-pyrroline-5-carboxylate dehydrogenase)の欠損により、プロリン(proline)および4-ヒドロキシプロリン(4-hydroxyproline)の代謝が阻害され、蓄積物による毒性が生じます。
- プロリンおよびリジンのα-アミノ窒素がトランスアミナーゼ以外の方法で除去される理由
- プロリン(proline)およびリジン(lysine)のα-アミノ窒素は、トランスアミナーゼ(transaminase)によらず、酸化的脱アミノ化などの反応を介して除去されます。
- 脂肪酸と分岐鎖アミノ酸の代謝経路の類似点
- 脂肪酸の代謝(特にβ酸化)と分岐鎖アミノ酸(branched-chain amino acids)の代謝には、アシルCoA(acyl-CoA)からの脱炭酸反応や酸化反応といった類似の反応が含まれます。
- 高バリン血症(Hypervalinemia)、メープルシロップ尿症(Maple Syrup Urine Disease)、間欠性分岐鎖ケトン尿症(Intermittent Branched-Chain Ketonuria)、イソ吉草酸血症(Isovaleric Acidemia)、およびメチルマロン酸尿症(Methylmalonic Aciduria)における特異的な代謝欠損
- 高バリン血症(hypervalinemia)はバリンの代謝酵素欠損、メープルシロップ尿症(MSUD)は**分岐鎖α-ケト酸デカルボキシラーゼ(branched-chain α-keto acid dehydrogenase)の欠損、イソ吉草酸血症(isovaleric acidemia)はイソバレリルCoAデヒドロゲナーゼ(isovaleryl-CoA dehydrogenase)の欠損、メチルマロン酸尿症(methylmalonic aciduria)はメチルマロニルCoAムターゼ(methylmalonyl-CoA mutase)**の欠損によって引き起こされます。
| 欠陥酵素 (Defective Enzyme) | 主要な症状と症候 (Major Signs and Symptoms) | 特記事項 (Key Notes) |
|---|---|---|
| S-アデノシルホモシステインヒドロラーゼ (S-Adenosylhomocysteine hydrolase) | 高メチオニン血症 (Hypermethioninemia) | メチオニン代謝の異常に関与。 |
| アルギナーゼ (Arginase) | アルギニン血症 (Argininemia) | アルギニン代謝に影響し、神経学的症状を引き起こす。 |
| シスタチオニン-β-シンターゼ (Cystathionine-B-synthase) | ホモシスチン尿症 (Homocystinuria) | ホモシステインが蓄積し、血管および骨に異常を引き起こす。 |
| フマルアセトアセテートヒドロラーゼ (Fumarvlacetoacetate hydrolase) | タイプIチロシン血症 (Type I tyrosinemia, tyrosinosis) | チロシン代謝に関与し、肝臓および腎臓に異常を引き起こす。 |
| ヒスチジンアモニアライアーゼ (Histidine ammonia lyase, histidase) | ヒスチジン血症およびウロカン酸血症 (Histidinemia & urocanic acidemia) | ヒスチジン代謝異常、ウロカン酸が尿中に排泄される。 |
| ホモゲンチシン酸酸化酵素 (Homogentisate oxidase) | アルカプトン尿症 (Alkaptonuria) | ホモゲンチシン酸が蓄積し、尿が黒くなる。 |
| p-ヒドロキシフェニルピルビン酸水酸化酵素 (p-Hydroxyphenylpyruvate hydroxylase) | 新生児型チロシン血症 (Neonatal tyrosinemia) | 新生児期から現れるチロシン代謝異常で、神経学的な問題を引き起こす。 |
| イソバレリル-CoAデヒドロゲナーゼ (Isovaleryl-CoA dehydrogenase) | イソバレリル酸血症 (Isovaleric acidemia) | イソバレリル-CoA代謝異常により代謝性アシドーシスが発生。 |
| 分岐鎖α-ケト酸デカルボキシラーゼ複合体 (Branched chain α-ketoacid decarboxylase complex) | 分岐鎖ケトン尿症 (MSUD, Branched-chain ketonuria) | 分岐鎖アミノ酸代謝異常による神経学的症状および発作。 |
| メチオニンアデノシルトランスフェラーゼ (Methionine adenosyltransferase) | 高メチオニン血症 (Hypermethioninemia) | メチオニン代謝に関与し、神経学的な症状を引き起こす。 |
| オルニチン-δ-アミノトランスフェラーゼ (Ornithine-δ-aminotransferase) | オルニチン血症、ギラート萎縮症 (Ornithinemia, gyrate atrophy) | オルニチン代謝異常、視力問題および網膜の退行が見られる。 |
| フェニルアラニン水酸化酵素 (Phenylalanine hydroxylase) | タイプI(クラシック)フェニルケトン尿症 (Type I classic phenylketonuria) | フェニルアラニン代謝異常で、発達遅延および知的障害を引き起こす。 |
| プロリンデヒドロゲナーゼ (Proline dehydrogenase) | タイプI高プロリン血症 (Type I hyperprolinemia) | プロリン代謝異常、肝臓および神経学的症状が現れる。 |
| A’-ピロリウリン-5-カルボキシレートデヒドロゲナーゼ (A’-Pyrroline-5-carboxylate dehydrogenase) | タイプII高プロリン血症および高4-ヒドロキシプロリン血症 (Type II hyperprolinemia & hyper 4-hydroxyprolinemia) | プロリン代謝異常、特に皮膚や骨に異常が見られる。 |
| サッカロピンデヒドロゲナーゼ (Saccharopine dehydrogenase) | サッカロピン尿症 (Saccharopinuria) | サッカロピンの蓄積により神経学的な症状が現れる。 |
| チロシンアミノトランスフェラーゼ (Tyrosine aminotransferase) | タイプIIチロシン血症 (Type II tyrosinemia) | チロシン代謝異常により、肝臓および腎臓に異常が現れる。 |
SUMMARY
- 過剰なアミノ酸の代謝
- 過剰なアミノ酸は**アミボリック中間体(amphibolic intermediates)に代謝され、エネルギー源として、または炭水化物(carbohydrates)や脂質(lipids)**の合成に利用されます。これらの中間体は、細胞内でエネルギー供給や様々な代謝経路に関与します。
- アミノ酸代謝におけるトランスアミネーションの役割
- アミノ酸代謝の初期段階として最も一般的なのはトランスアミネーション(transamination)反応です。これによりアミノ基が他の分子に転送され、その後の反応でさらに窒素(nitrogen)が除去され、炭素骨格はオキサロ酢酸(oxaloacetate)、α-ケトグルタル酸(α-ketoglutarate)、ピルビン酸(pyruvate)、**アセチルCoA(acetyl-CoA)**などに変換されます。
- グリシン代謝に関連する代謝疾患
- グリシン(glycine)の代謝に関連する疾患には、**グリシン尿症(glycinuria)や一次高オキサラート血症(primary hyperoxaluria)**があります。これらはグリシン代謝に関わる酵素の欠損に起因し、尿中に異常な物質が排泄されることが特徴です。
- システイン代謝経路と関連する代謝障害
- システイン(cysteine)は**ピルビン酸(pyruvate)に変換される2つの異なる経路を持ちます。システイン代謝に関連する代謝障害には、シスチン-リジン尿症(cystine-lysinuria)、シスチン貯蔵病(cystine storage disease)、およびホモシステイン尿症(homocystinurias)**があります。
- スレオニン代謝
- スレオニン(threonine)の代謝は、**スレオニンアルドラーゼ(threonine aldolase)によってスレオニンがグリシン(glycine)とアセトアルデヒド(acetaldehyde)**に分解され、その後グリシン代謝と統合されます。
- チロシン代謝と関連する代謝疾患
- チロシン(tyrosine)の代謝経路では、トランスアミネーション後にその炭素骨格が**フマル酸(fumarate)とアセトアセテート(acetoacetate)に分解されます。チロシン代謝に関連する疾患には、チロシノーシス(tyrosinosis)、リヒナー・ハンハルト症候群(Richner-Hanhart syndrome)、新生児チロシン血症(neonatal tyrosinemia)、およびアルカプトン尿症(alkaptonuria)**があります。
- フェニルアラニン代謝に関連する代謝障害
- フェニルアラニン(phenylalanine)の代謝に関連する疾患には、**フェニルケトン尿症(PKU; phenylketonuria)やいくつかの高フェニルアラニン血症(hyperphenylalaninemias)**があります。これらはフェニルアラニン水酸化酵素(phenylalanine hydroxylase)の欠損などによって引き起こされ、血中のフェニルアラニン濃度が上昇します。
- リジンの代謝
- リジン(lysine)のアミノ基はトランスアミネーション反応に参加しませんが、**サッカロピン(saccharopine)**という中間産物を経由して同様の最終的な効果を得ます。リジン代謝に関連する代謝障害には、**周期的および持続的高リジン血症-アンモニア血症(hyperlysinemia-ammonemia)**があります。
- 分岐鎖アミノ酸代謝と脂肪酸代謝の類似性
- ロイシン(leucine)、バリン(valine)、および**イソロイシン(isoleucine)の代謝は、脂肪酸の代謝と多くの類似点を持っています。分岐鎖アミノ酸代謝の障害には、高バリン血症(hypervalinemia)、メープルシロップ尿症(maple syrup urine disease)、間欠的分岐鎖ケトン尿症(intermittent branched-chain ketonuria)、イソバレリル酸血症(isovaleric acidemia)、およびメチルマロン酸尿症(methylmalonic aciduria)**があります。
Q1:代謝障害の早期発見の重要性
問題文:Why is early detection of metabolic disorders involving amino acid catabolism crucial?
a. It allows for delayed treatment options.
b. Early treatment can prevent irreversible brain damage.
c. Detection has minimal impact on outcomes.
d. Treatment is rarely effective for such disorders.
Answer: b. Early treatment can prevent irreversible brain damage.
解説:
アミノ酸代謝に関連する代謝障害の早期発見は、不可逆的な脳の損傷を防ぐために重要です。選択肢aとcは誤りで、早期発見と治療が症状の進行を防ぐために重要です。選択肢dも誤りで、適切な治療は効果的です。
Q2:アミノ酸の炭素骨格の代謝
問題文:The carbon skeletons of amino acids can be converted into which of the following?
a. Only carbohydrates
b. Only fats
c. Carbohydrates, fats, or both
d. Nucleic acids
Answer: c. Carbohydrates, fats, or both
解説:
アミノ酸の炭素骨格は、炭水化物、脂肪、またはその両方に変換可能です。**選択肢a(炭水化物のみ/Only carbohydrates)およびb(脂肪のみ/Only fats)**は不正確です。**選択肢d(核酸/Nucleic acids)**はアミノ酸の炭素骨格の代謝経路には含まれません。
Q3:プロリンの代謝異常
問題文:Which enzyme deficiency is associated with type II hyperprolinemia, impacting both proline and hydroxyproline metabolism?
a. Proline dehydrogenase
b. A’-pyrroline-5-carboxylate dehydrogenase
c. Glutaminase
d. Histidase
Answer: b. A’-pyrroline-5-carboxylate dehydrogenase
解説:
タイプII高プロリン血症(type II hyperprolinemia)は、A’-ピロリン-5-カルボキシレートデヒドロゲナーゼ(A’-pyrroline-5-carboxylate dehydrogenase)の欠損に関連しており、プロリンおよびヒドロキシプロリンの代謝にも影響します。**選択肢a(プロリンデヒドロゲナーゼ/Proline dehydrogenase)**はタイプI高プロリン血症に関連し、**選択肢c(グルタミナーゼ/Glutaminase)やd(ヒスタダーゼ/Histidase)**は他の代謝経路に関係します。
Q4:アルギニンとオルニチンの代謝異常
問題文:A deficiency in ornithine 8-aminotransferase is associated with which condition?
a. Nonketotic hyperglycinemia
b. Gyrate atrophy of the choroid and retina
c. Maple syrup urine disease
d. Alkaptonuria
Answer: b. Gyrate atrophy of the choroid and retina
解説:
オルニチン8-アミノトランスフェラーゼ(ornithine 8-aminotransferase)の欠損は、脈絡膜と網膜の萎縮(gyrate atrophy of the choroid and retina)と関連しています。選択肢a(非ケトン性高グリシン血症/Nonketotic hyperglycinemia)、選択肢c(メープルシロップ尿症/Maple syrup urine disease)、および**選択肢d(アルカプトン尿症/Alkaptonuria)**は他の代謝異常と関連しています。
Q5:非ケトン性高グリシン血症の原因
問題文:What is the primary cause of nonketotic hyperglycinemia?
a. Defect in glycine transaminase
b. Impaired glycine cleavage enzyme system
c. Increased glycine reabsorption
d. Deficiency in serine hydroxymethyltransferase
Answer: b. Impaired glycine cleavage enzyme system
解説:
非ケトン性高グリシン血症(nonketotic hyperglycinemia)は、グリシン分解酵素系(glycine cleavage enzyme system)の欠損が主な原因です。**選択肢a(グリシンアミノトランスフェラーゼの欠損/Defect in glycine transaminase)とd(セリンヒドロキシメチルトランスフェラーゼの欠乏/Deficiency in serine hydroxymethyltransferase)**は非ケトン性高グリシン血症の原因ではありません。また、**選択肢c(グリシンの再吸収の増加/Increased glycine reabsorption)**も誤りです。
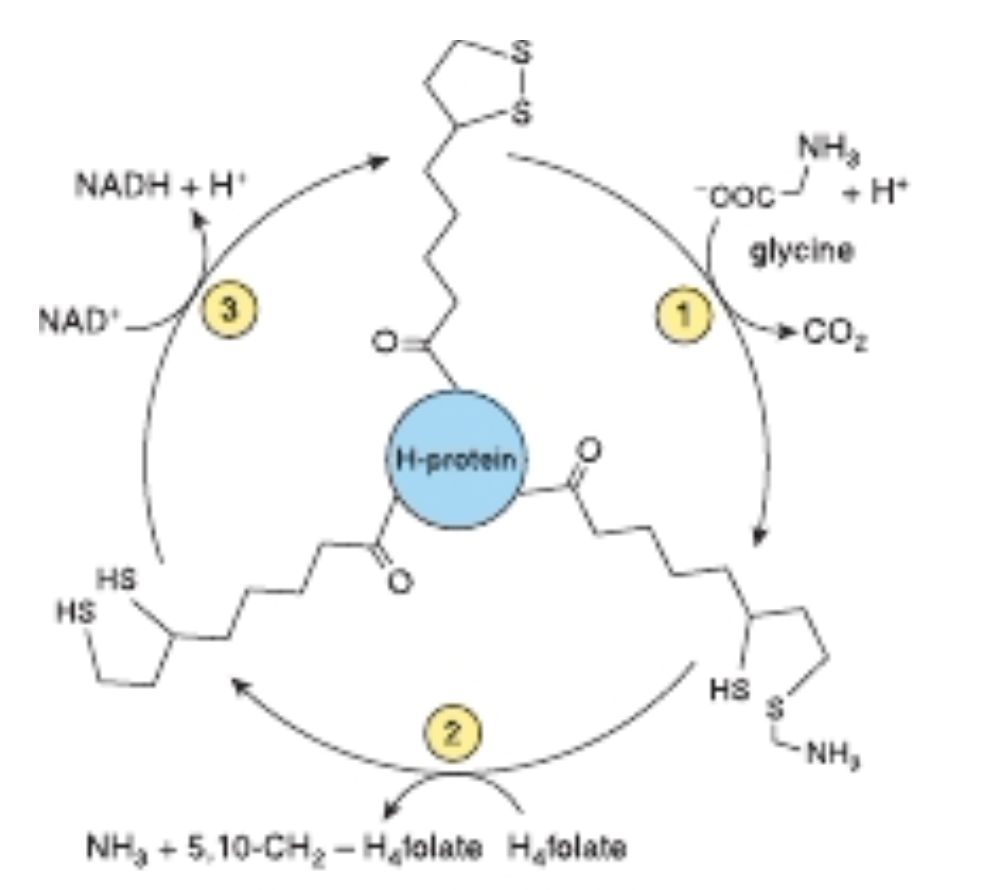
Glycine Cleavage System(グリシン分解系)は、肝臓ミトコンドリア内で行われる重要な代謝経路です。この系は、グリシン(glycine)というアミノ酸を分解するために3つの酵素と1つの「Hプロテイン」から構成されています。Hプロテインはジヒドロリポアミド(dihydrolipoate)を共有結合的に結びつけています。
この系での反応は以下の酵素によって触媒されます:
- Glycine dehydrogenase(グリシン脱水素酵素、脱炭酸反応を触媒):
- グリシンからCO₂(炭酸ガス)を脱離させ、グリシンの脱水素反応を行います。これにより、グリシンのカルボキシル基(COOH)が除去されます。
- Aminomethyltransferase(アミノメチル転送酵素、アンモニアを生成):
- グリシンのアミノメチル基(-CH₂NH₂)を転送する役割を持ち、この過程でアンモニア(NH₃)を生成します。
- Dihydrolipoamide dehydrogenase(ジヒドロリポアミドデヒドロゲナーゼ):
- これは、Hプロテインに関連する酵素で、ジヒドロリポアミドの酸化を行い、エネルギー供給のために重要な役割を果たします。
この反応系は、テトラヒドロ葉酸(H₄ folate)(テトラヒドロフォレート)を補因子として利用します。テトラヒドロ葉酸は、アミノ基転送の過程で重要な役割を果たし、グリシンからのアミノメチル基の転送を助けます。
Q6:ヒスチジン代謝の代謝異常
問題文:In cases of folic acid deficiency, which intermediate accumulates due to impaired histidine catabolism?
a. Urocanate
b. 4-Imidazolone-5-propionate
c. N-Formiminoglutamate (Figlu)
d. Pyruvate
Answer: c. N-Formiminoglutamate (Figlu)
解説:
葉酸欠乏症(folic acid deficiency)では、ヒスチジン代謝が阻害されるため、N-フォルミミノグルタミン酸(N-formiminoglutamate, Figlu)が蓄積します。**選択肢a(ウロカナート/Urocanate)とb(4-イミダゾロン-5-プロピオネート/4-Imidazolone-5-propionate)**はヒスチジン分解経路の中間体ですが、蓄積するのはFigluです。**選択肢d(ピルビン酸/Pyruvate)**はヒスチジン代謝とは直接関係ありません。
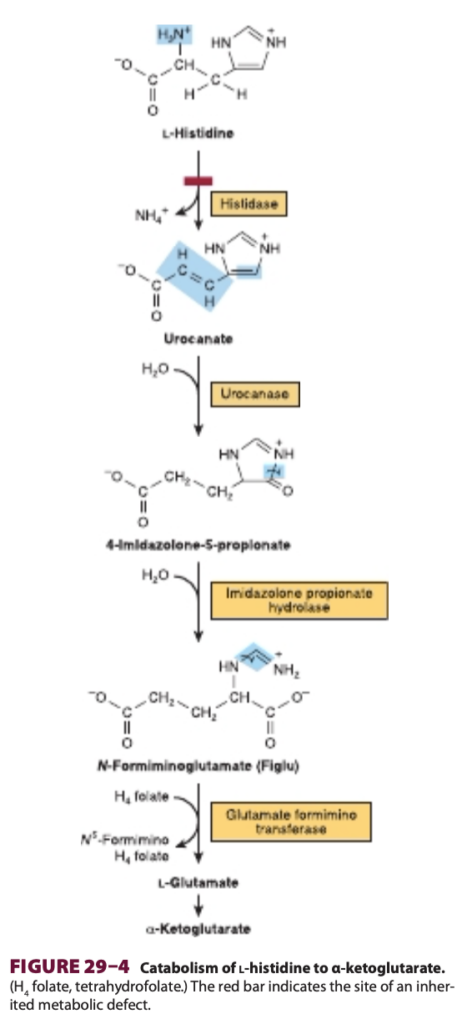
Q7:システインおよびシスチン代謝に関連する疾患
問題文:What is a common clinical feature of cystinuria, a metabolic disorder affecting cystine and lysine metabolism?
a. Neurological deficits
b. Cystine kidney stones
c. Elevated blood sugar
d. Skin rashes
Answer: b. Cystine kidney stones
解説:
シスチン尿症(cystinuria)では、シスチン(cystine)の腎臓での再吸収が妨げられ、シスチン結石(cystine kidney stones)が形成されやすくなります。選択肢a(神経障害/Neurological deficits)、c(血糖値の上昇/Elevated blood sugar)、および**d(皮膚発疹/Skin rashes)**はシスチン尿症に特有の症状ではありません。
Q8:ホモシスチン尿症とビタミンBの関係
問題文:Which vitamin deficiency can exacerbate homocystinuria by reducing the activity of cystathionine β-synthase?
a. Vitamin C
b. Vitamin B6
c. Vitamin E
d. Vitamin D
Answer: b. Vitamin B6
解説:
ホモシスチン尿症(homocystinuria)はシスタチオニンβ-シンターゼ(cystathionine β-synthase)の活性低下によって悪化し、ビタミンB6(ピリドキシン)が不足するとさらに進行します。選択肢a(ビタミンC/Vitamin C)、c(ビタミンE/Vitamin E)、および**d(ビタミンD/Vitamin D)**はホモシスチン尿症の直接的な影響に関与しません。
Q9:遺伝子変異の影響
問題文:Which of the following is a potential consequence of a mutation that impairs an enzyme’s ability to bind to an allosteric regulator?
a. Enhanced substrate binding
b. Increased catalytic efficiency
c. Disrupted regulation of enzyme activity
d. Improved response to dietary changes
Answer: c. Disrupted regulation of enzyme activity
解説:
アロステリック調節因子(allosteric regulator)への結合に影響を及ぼす変異は、酵素の調節(regulation of enzyme activity)を阻害する可能性があります。**選択肢a(基質結合の強化/Enhanced substrate binding)やb(触媒効率の向上/Increased catalytic efficiency)**は必ずしも期待できる結果ではありません。**選択肢d(食事の変化に対する応答の改善/Improved response to dietary changes)**も直接の影響ではありません。
Q1:チロシン代謝の代謝異常
問題文:A deficiency in which enzyme leads to alkaptonuria, causing urine to darken on exposure to air and pigmentation in connective tissue?
a. Tyrosine aminotransferase
b. p-Hydroxyphenylpyruvate hydroxylase
c. Homogentisate oxidase
d. Fumarylacetoacetate hydrolase
Answer: c. Homogentisate oxidase
解説:
アルカプトン尿症(alkaptonuria)は、ホモゲンチジン酸オキシダーゼ(homogentisate oxidase)の欠損により発生し、尿が空気に触れると暗くなる症状が見られます。また、ホモゲンチジン酸の酸化により結合組織の色素沈着(ochronosis)が起こります。選択肢a(チロシンアミノトランスフェラーゼ/Tyrosine aminotransferase)、b(p-ヒドロキシフェニルピルビン酸ヒドロキシラーゼ/p-Hydroxyphenylpyruvate hydroxylase)、および**d(フマリルアセトアセタートヒドロラーゼ/Fumarylacetoacetate hydrolase)**は異なる酵素です。
Q2:フェニルケトン尿症の原因酵素
問題文:Which enzyme deficiency causes classical phenylketonuria (PKU), leading to elevated levels of phenylalanine in blood?
a. Dihydrobiopterin reductase
b. Tyrosine aminotransferase
c. Phenylalanine hydroxylase
d. Homogentisate oxidase
Answer: c. Phenylalanine hydroxylase
解説:
古典的フェニルケトン尿症(classical phenylketonuria, PKU)は、フェニルアラニンヒドロキシラーゼ(phenylalanine hydroxylase)の欠損によって引き起こされ、血中フェニルアラニン濃度が上昇します。**選択肢a(ジヒドロビオプテリンレダクターゼ/Dihydrobiopterin reductase)**の欠損も高フェニルアラニン血症の原因になりますが、異なるタイプです。**選択肢b(チロシンアミノトランスフェラーゼ/Tyrosine aminotransferase)とd(ホモゲンチジン酸オキシダーゼ/Homogentisate oxidase)**はPKUに関与しません。
Q3:トリプトファンの代謝経路に関連するビタミン
問題文:Excretion of which intermediate after a tryptophan load indicates a vitamin B6 deficiency?
a. N-Formylkynurenine
b. Kynurenine
c. Xanthurenate
d. Anthranilate
Answer: c. Xanthurenate
解説:
トリプトファン負荷後にキサントゥレニン酸(xanthurenate)が排泄されることは、ビタミンB6欠乏症を示します。選択肢a(N-ホルミルキヌレニン/N-Formylkynurenine)、b(キヌレニン/Kynurenine)、**d(アントラニル酸/Anthranilate)**は、トリプトファン代謝の異なる中間体で、ビタミンB6欠乏症とは直接関連しません。
Q4:メープルシロップ尿症の原因
問題文:Maple syrup urine disease (MSUD) is caused by a defect in which of the following?
a. Phenylalanine hydroxylase
b. a-Ketoacid decarboxylase complex
c. Tryptophan 2,3-dioxygenase
d. Cystathionine β-synthase
Answer: b. a-Ketoacid decarboxylase complex
解説:
メープルシロップ尿症(MSUD)は、分岐鎖アミノ酸のα-ケト酸デカルボキシラーゼ複合体(a-ketoacid decarboxylase complex)の欠損により発生します。この病気では、尿にメープルシロップのような甘い匂いが生じます。選択肢a(フェニルアラニンヒドロキシラーゼ/Phenylalanine hydroxylase)、c(トリプトファン2,3-ジオキシゲナーゼ/Tryptophan 2,3-dioxygenase)、および**d(シスタチオニンβ-シンターゼ/Cystathionine β-synthase)**は他の代謝経路に関与しています。
Q5:ハートナップ病に関連する代謝異常
問題文:Which metabolic disorder is caused by impaired intestinal and renal transport of tryptophan?
a. Alkaptonuria
b. Hartnup disease
c. Phenylketonuria
d. Maple syrup urine disease
Answer: b. Hartnup disease
解説:
ハートナップ病(Hartnup disease)は、トリプトファン(tryptophan)の腸および腎臓での輸送障害によって引き起こされます。選択肢a(アルカプトン尿症/Alkaptonuria)、c(フェニルケトン尿症/Phenylketonuria)、および**d(メープルシロップ尿症/Maple syrup urine disease)**は他のアミノ酸代謝障害に関連しています。
Q6:タイプIチロシン血症の原因酵素
問題文:Type I tyrosinemia (tyrosinosis) results from a deficiency in which enzyme, leading to liver failure if left untreated?
a. Tyrosine aminotransferase
b. Fumarylacetoacetate hydrolase
c. Homogentisate oxidase
d. p-Hydroxyphenylpyruvate hydroxylase
Answer: b. Fumarylacetoacetate hydrolase
解説:
タイプIチロシン血症(tyrosinemia type I)は、フマリルアセトアセタートヒドロラーゼ(fumarylacetoacetate hydrolase)の欠損によって引き起こされ、治療が行われないと肝不全につながる可能性があります。**選択肢a(チロシンアミノトランスフェラーゼ/Tyrosine aminotransferase)とd(p-ヒドロキシフェニルピルビン酸ヒドロキシラーゼ/p-Hydroxyphenylpyruvate hydroxylase)**はそれぞれ異なるチロシン代謝異常(タイプIIチロシン血症および新生児チロシン血症)と関連しています。**選択肢c(ホモゲンチジン酸オキシダーゼ/Homogentisate oxidase)**はアルカプトン尿症に関係します。
Q7:タイプIIチロシン血症の治療法
問題文:Which dietary modification is typically recommended for managing type II tyrosinemia (Richner-Hanhart syndrome)?
a. Low-fat diet
b. Low-protein diet
c. High-carbohydrate diet
d. High-phenylalanine diet
Answer: b. Low-protein diet
解説:
タイプIIチロシン血症(type II tyrosinemia, Richner-Hanhart syndrome)の治療には低タンパク質食(low-protein diet)が推奨されます。**選択肢a(低脂肪食/Low-fat diet)やc(高炭水化物食/High-carbohydrate diet)**は特に効果的ではなく、**d(高フェニルアラニン食/High-phenylalanine diet)**は逆効果です。
Q8:イソ吉草酸血症の特徴
問題文:Which metabolic disorder is characterized by elevated levels of isovalerate following ingestion of protein-rich foods, often leading to vomiting and acidosis?
a. Type I tyrosinemia
b. Maple syrup urine disease
c. Isovaleric acidemia
d. Phenylketonuria
Answer: c. Isovaleric acidemia
解説:
イソ吉草酸血症(isovaleric acidemia)は、イソ吉草酸(isovalerate)の血中濃度が上昇し、タンパク質の多い食事を摂取した後に嘔吐やアシドーシスを引き起こすことが特徴です。選択肢a(タイプIチロシン血症/Type I tyrosinemia)、b(メープルシロップ尿症/Maple syrup urine disease)、および**d(フェニルケトン尿症/Phenylketonuria)**は異なる代謝障害で、イソ吉草酸の蓄積とは関係ありません。
Ch 30:Conversion of Amino Acids to Specialized Products
OBJECTIVES
- アミノ酸がタンパク質合成以外の生合成過程に関与する例
- アミノ酸は、タンパク質合成に加えて、さまざまな生体分子の合成に関与します。例えば、グリシン(glycine)は**ヘム(heme)やプリン(purines)**の合成に使われ、**メチオニン(methionine)はS-アデノシルメチオニン(S-adenosylmethionine)**を介してメチル基供与体として機能します。
- アルギニンが創成する化合物
- アルギニン(arginine)は、以下の化合物の合成に関与します:
- クレアチン(creatine):アルギニンは、グアニジノ基(guanidino group)を供給してクレアチンを合成します。
- 一酸化窒素(NO; nitric oxide):アルギニンは一酸化窒素合成酵素(nitric oxide synthase)によってNOに変換され、神経伝達物質や血管拡張因子として機能します。
- ポリアミン(putrescine、spermine、spermidine):アルギニンはこれらのポリアミンを合成する前駆物質として使われ、細胞増殖に重要な役割を果たします。
- アルギニン(arginine)は、以下の化合物の合成に関与します:
- システインおよびβ-アラニンのコエンザイムA(CoA)構造への貢献
- **システイン(cysteine)**は、**4-ホスホパンテノイルシステイン(4-phosphopantothenoylcysteine)**を経て、**コエンザイムA(CoA)**の合成に関与します。
- **β-アラニン(β-alanine)**もコエンザイムAの構造に必要な重要な部分を提供します。
- グリシンの薬物代謝および排泄における役割
- グリシン(glycine)は、薬物やその代謝物の**グリシン抱合(glycine conjugation)**を介して水溶性を増し、尿中への排泄を促進します。
- グリシンの生合成経路における役割
- グリシンは、以下の化合物の生合成に貢献します:
- ヘム(heme):グリシンは、ヘム合成においてピロール環(pyrrole ring)の形成に重要です。
- プリン(purines):グリシンはプリン基(purine base)合成において、アトム4、5、7を提供します。
- クレアチン(creatine):グリシンは、クレアチン合成にも貢献します。
- サルコシン(sarcosine):グリシンはサルコシンを合成し、これも一酸化炭素(CO)供与体として重要です。
- グリシンは、以下の化合物の生合成に貢献します:
- ヒスタミン合成の反応
- ヒスタミン(histamine)は、**ヒスチジン(histidine)からヒスチジンデカルボキシラーゼ(histidine decarboxylase)**によって生成されます。この反応は、アレルギー反応や胃酸分泌に重要です。
- S-アデノシルメチオニンの代謝における役割
- **S-アデノシルメチオニン(S-adenosylmethionine; SAMe)**は、メチル基供与体として、DNAメチル化やホルモン合成、神経伝達物質の合成に重要な役割を果たします。
- トリプトファン代謝産物の構造
- トリプトファン(tryptophan)は以下の代謝産物に変換されます:
- セロトニン(serotonin):気分の調整に関与する神経伝達物質。
- メラトニン(melatonin):サーカディアンリズム(circadian rhythm)の調節に関与します。
- トリプタミン(tryptamine):トリプトファンから生成される中間産物で、神経伝達物質として機能します。
- インドール-3-アセテート(indole-3-acetate):腸内フローラが生成する化合物で、ホルモン作用を持つことがあります。
- トリプトファン(tryptophan)は以下の代謝産物に変換されます:
- チロシンからのノルエピネフリンおよびエピネフリン合成
- **チロシン(tyrosine)**は、ドーパ(DOPA)を経て、**ノルエピネフリン(norepinephrine)およびエピネフリン(epinephrine)**に変換されます。これらは神経伝達物質として、また交感神経系の作用を調整します。
- 代謝調節および信号伝達経路におけるペプチジルセリン、スレオニン、チロシンの役割
- ペプチジルセリン(peptidyl serine)、スレオニン(threonine)、**チロシン(tyrosine)**は、酵素の活性を調節し、**シグナル伝達経路(signal transduction pathways)**において重要な役割を果たします。
- グリシン、アルギニン、およびS-アデノシルメチオニンがクレアチン合成に果たす役割
- グリシン(glycine)、アルギニン(arginine)、および**S-アデノシルメチオニン(S-adenosylmethionine)**は、クレアチン(creatine)合成の前駆体として、それぞれ重要な役割を担っています。
- クレアチンリン酸のエネルギー恒常性における役割
- **クレアチンリン酸(creatine phosphate)**は、短期間の高エネルギー需要においてATPを供給し、筋肉細胞のエネルギー恒常性を維持します。
- γ-アミノ酪酸(GABA)の生成とその代謝障害
- **γ-アミノ酪酸(GABA)**は、**グルタミン酸(glutamate)からグルタミン酸デカルボキシラーゼ(glutamate decarboxylase)**によって生成され、抑制性神経伝達物質として働きます。GABAの代謝障害としては、**スシニルセミアルデヒドデヒドロゲナーゼ(succinic semialdehyde dehydrogenase)の欠損による4-ヒドロキシ酪酸尿症(4-hydroxybutyric aciduria)**があります。
SUMMARY
- アミノ酸の構造的および機能的役割以外の生合成過程への関与
- **α-アミノ酸(α-amino acids)**は、タンパク質の構造や機能に加えて、他の多くの生合成過程に関与します。例えば、グリシン(glycine)はヘム(heme)やプリン(purines)、クレアチン(creatine)、サルコシン(sarcosine)の合成に使われます。
- アルギニンの役割
- **アルギニン(arginine)はクレアチン(creatine)のホルミジン基(formamidine group)および一酸化窒素(NO; nitric oxide)**の窒素源を提供します。また、オルニチン(ornithine)を介して、ポリアミン(polyamines)のプトレシン(putrescine)、スペルミン(spermine)、**スペルミジン(spermidine)**の骨格も供給します。
- システインの役割
- **システイン(cysteine)**は、**コエンザイムA(coenzyme A)**のチオエタノラミン部分(thioethanolamine portion)を提供します。さらに、システインはタウリン(taurine)に変換され、**胆汁酸(bile acid)**であるタウロコール酸(taurocholic acid)の一部となります。
- グリシンの役割
- グリシン(glycine)は、ヘム(heme)、プリン(purines)、クレアチン(creatine)、および**サルコシン(sarcosine)の合成に関与します。また、薬物やその代謝物のグリシン抱合(glycine conjugation)**を通じて水溶性を高め、尿中への排泄を促進します。
- ヒスチジンからヒスタミンへの変換
- **ヒスチジン(histidine)は脱炭酸化反応により、神経伝達物質であるヒスタミン(histamine)に変換されます。ヒスチジン由来の化合物には、エルゴチオネイン(ergothioneine)、カルノシン(carnosine)、およびアンセリン(anserine)**があり、これらは体内で重要な役割を果たします。
- S-アデノシルメチオニンの代謝における役割
- **S-アデノシルメチオニン(S-adenosylmethionine; SAMe)**は、メチル基供与体(methyl group donor)として、メチル化反応に関与し、**ポリアミン(polyamines)であるスペルミン(spermine)やスペルミジン(spermidine)**の合成にも重要です。
- スレオニンの役割
- **スレオニン(threonine)**は、**スフィンゴシン(sphingosine)やリン脂質(phospholipids)**の合成に加え、**プリン(purines)**の炭素原子2および8、**チミン(thymine)**のメチル基を供給します。
- トリプトファン代謝産物
- **トリプトファン(tryptophan)**から生成される主要な代謝産物には、**セロトニン(serotonin)やメラトニン(melatonin)があります。これらは神経伝達物質およびホルモンとして作用します。さらに、腎臓や肝臓、腸内細菌がトリプトファンをトリプタミン(tryptamine)に変換し、最終的にインドール-3-アセテート(indole-3-acetate)**として排泄されます。
- チロシンからノルエピネフリンおよびエピネフリンの合成
- **チロシン(tyrosine)**は、**ドーパ(DOPA)を経由してノルエピネフリン(norepinephrine)およびエピネフリン(epinephrine)**に変換され、これらは神経伝達物質として働き、交感神経系の調節に重要です。
- ペプチジルセリン、スレオニン、チロシンの役割
- ペプチジルセリン(peptidyl serine)、スレオニン(threonine)、**チロシン(tyrosine)のリン酸化および脱リン酸化反応は、代謝調節(metabolic regulation)やシグナル伝達経路(signal transduction pathways)**において重要な役割を果たします。
- クレアチン合成におけるグリシン、アルギニン、S-アデノシルメチオニンの役割
- グリシン(glycine)、アルギニン(arginine)、および**S-アデノシルメチオニン(S-adenosylmethionine)**は、クレアチン(creatine)の合成に関与し、クレアチンリン酸(creatine phosphate)として筋肉や脳のエネルギー貯蔵に重要です。
- クレアチンリン酸のエネルギー恒常性における役割
- **クレアチンリン酸(creatine phosphate)**は、高エネルギー需要時にATPを供給し、筋肉および脳細胞のエネルギー恒常性を維持します。
- β-アラニンおよびβ-アミノイソブチレートの代謝
- **β-アラニン(β-alanine)およびβ-アミノイソブチレート(β-aminoisobutyrate)は、各々がアセチルCoA(acetyl-CoA)またはスクシニルCoA(succinyl-CoA)**に変換される経路を持っています。これらの代謝異常には、**ジヒドロピリミジン脱水素酵素(dihydropyrimidine dehydrogenase)**の欠損が関与しています。
Q1:ヒスタミンの役割
問題文:Histamine, produced by the decarboxylation of histidine, plays an essential role in which of the following processes?
a. Muscle contraction
b. Gastric acid secretion and allergic reactions
c. Protein synthesis
d. Cell membrane stabilization
Answer: b. Gastric acid secretion and allergic reactions
解説:
ヒスタミン(histamine)はヒスチジン(histidine)から生成され、胃酸分泌(gastric acid secretion)やアレルギー反応(allergic reactions)に重要な役割を果たします。選択肢a(筋収縮/Muscle contraction)、c(タンパク質合成/Protein synthesis)、**d(細胞膜の安定化/Cell membrane stabilization)**はヒスタミンの主要な役割ではありません。
Q2:GABAの役割
問題文:Gamma-aminobutyric acid (GABA) primarily functions in the brain as:
a. A stimulant neurotransmitter
b. An inhibitory neurotransmitter
c. A muscle relaxant
d. A hormone
Answer: b. An inhibitory neurotransmitter
解説:
GABA(ガンマアミノ酪酸)は、脳内で抑制性の神経伝達物質(inhibitory neurotransmitter)として働き、神経細胞の興奮を抑えます。**選択肢a(興奮性神経伝達物質/Stimulant neurotransmitter)やd(ホルモン/Hormone)**ではありませんが、**c(筋弛緩剤/Muscle relaxant)**としての作用はGABAが持つ副次的な効果の一部です。
Q3:クレアチンの合成
問題文:Creatine synthesis involves which three amino acids as precursors?
a. Alanine, tryptophan, and methionine
b. Glycine, arginine, and methionine
c. Histidine, glutamine, and lysine
d. Phenylalanine, leucine, and isoleucine
Answer: b. Glycine, arginine, and methionine
解説:
クレアチン(creatine)の合成には、グリシン(glycine)、アルギニン(arginine)、およびメチオニン(methionine)が前駆体として関与しています。選択肢a、c、dはいずれも不正確です。
Q4:セロトニンの前駆体
問題文:Which amino acid is a precursor for serotonin, a neurotransmitter involved in mood regulation?
a. Tyrosine
b. Glycine
c. Tryptophan
d. Glutamate
Answer: c. Tryptophan
解説:
セロトニン(serotonin)はトリプトファン(tryptophan)から生成され、気分の調整に関与します。選択肢a(チロシン/Tyrosine)やb(グリシン/Glycine)、**d(グルタミン酸/Glutamate)**はセロトニンの前駆体ではありません。
Q5:アルギニンの代謝産物
問題文:Arginine is metabolized to produce nitric oxide, which has which of the following effects?
a. Increases blood clotting
b. Acts as a smooth muscle relaxant
c. Stimulates muscle growth
d. Reduces digestive enzyme activity
Answer: b. Acts as a smooth muscle relaxant
解説:
アルギニン(arginine)から生成される一酸化窒素(nitric oxide)は、平滑筋の弛緩(smooth muscle relaxation)を促し、血管拡張や神経伝達にも関与します。選択肢a(血液凝固の増加/Increases blood clotting)やc(筋肉成長の促進/Stimulates muscle growth)、**d(消化酵素活性の低下/Reduces digestive enzyme activity)**は一酸化窒素の作用ではありません。
Q6:タウリンの生成
問題文:Cysteine serves as a precursor for the synthesis of taurine, which is important for the formation of which compound?
a. Uric acid
b. Bile acid taurocholic acid
c. Urea
d. Melatonin
Answer: b. Bile acid taurocholic acid
解説:
システイン(cysteine)はタウリン(taurine)の前駆体であり、タウリンは胆汁酸であるタウロコール酸(taurocholic acid)の生成に重要です。選択肢a(尿酸/Uric acid)やc(尿素/Urea)、**d(メラトニン/Melatonin)**は関連していません。
Q7:メラトニンの前駆体
問題文:The hormone melatonin, which regulates circadian rhythms, is synthesized from which amino acid?
a. Tyrosine
b. Glutamine
c. Tryptophan
d. Methionine
Answer: c. Tryptophan
解説:
メラトニン(melatonin)は、サーカディアンリズム(circadian rhythms)の調節に関与し、トリプトファン(tryptophan)から生成されます。選択肢a(チロシン/Tyrosine)やb(グルタミン/Glutamine)、**d(メチオニン/Methionine)**はメラトニンの前駆体ではありません。
Q8:ポリアミンの生成
問題文:Methionine is converted into polyamines such as spermine and spermidine, which play a role in:
a. Protein digestion
b. DNA and RNA stabilization
c. Muscle contraction
d. Cholesterol metabolism
Answer: b. DNA and RNA stabilization
解説:
メチオニン(methionine)から生成されるポリアミン(polyamines)であるスペルミン(spermine)とスペルミジン(spermidine)は、DNAやRNAの安定化に寄与します。選択肢a(タンパク質消化/Protein digestion)、c(筋収縮/Muscle contraction)、および**d(コレステロール代謝/Cholesterol metabolism)**には直接関与していません。


コメント