Contents
- 1 SUMMARY
- 2 OBJECTIVES
- 3 教科書(図表解説)
- 4 自作アセス問題(教科書)
- 4.1 Question:双極性構造(dipolar structure)
- 4.2 Question:水素結合
- 4.3 Question:疎水性相互作用(Hydrophobic interaction)
- 4.4 Question:共有結合(Covalent bonds)
- 4.5 Question:誘電率(dielectric constant)
- 4.6 Question:視床下部
- 4.7 Question:腎性尿崩症
- 4.8 Question:アシドーシス
- 4.9 Question:疎水性効果とエントロピー
- 4.10 Question:バッファー
- 4.11 Question:誘電率(dielectric constant)
- 4.12 Question:二重螺旋構造と水分子
- 4.13 Question:疎水性相互作用
- 4.14 Question:疎水性効果とエントロピー
- 4.15 Question:van der Waals forces
- 4.16 Question:水素結合(リン酸基)
- 4.17 Question:Salts bridges
- 4.18 Question:双極性モーメント
- 4.19 Question:求核剤(nucleophile)
- 4.20 Question:加水分解反応(hydrolysis)
- 4.21 Question:phosphorolysis
- 4.22 Question:phの計算
- 4.23 Question:Henderson-Hasselbalch equation
- 4.24 Question:酵素の役割(反応速度)
- 4.25 Question:グループ転移反応
- 4.26 Question:水の解離(dissociation)
- 4.27 Question:amphipathic biomolecules
- 4.28 Question:Henderson-Hasselbalch式
- 4.29 Question:pKaの安定範囲
- 4.30 Question:水のイオン積(Kw)
- 4.31 Question:Hydrophobicの作用
- 4.32 Question:強酸とpKa
- 4.33 Question:アミド結合の加水分解
- 4.34 Question:ATP加水分解
- 4.35 Question:水の解離
- 4.36 Question:Nuclease
- 4.37 Question:Kwと温度
- 4.38 Question:pKaの目的
- 5 過去問(36)
- 5.1 Question 1
- 5.2 Question 2
- 5.3 Question 3
- 5.4 Question 4
- 5.5 Question 5
- 5.6 Question 6
- 5.7 Question 7
- 5.8 Question 8
- 5.9 Question 9
- 5.10 Question 10
- 5.11 Question 11
- 5.12 Question 12
- 5.13 Question 13
- 5.14 Question 14
- 5.15 Question 15
- 5.16 Question 16
- 5.17 Question 17
- 5.18 Question 18
- 5.19 Question 19
- 5.20 Question 20
- 5.21 Question 21
- 5.22 Question 22
- 5.23 Question 23
- 5.24 Question 24
- 5.25 Question 25
- 5.26 Question 26
- 5.27 Question 27
- 5.28 Question 28
- 5.29 Question 29
- 5.30 Question 30
- 5.31 Question 31
- 5.32 Question 32
- 5.33 Question 33
- 5.34 Question 34
- 5.35 Question 35
- 5.36 Question 36
SUMMARY
■ **水(Water)**は、自身や他のプロトン(陽子)供与体(proton donors)や受容体(acceptors)と水素結合を形成し、クラスター(clusters)を作ります。この広範囲にわたる水素結合ネットワークが、水の表面張力(surface tension)、粘性(viscosity)、室温での液体状態、そして溶媒としての高い能力に寄与しています。
■ **酸素(O)や窒素(N)**を含む化合物は、水素結合の供与体(hydrogen bond donors)または受容体(acceptors)として機能できます。
■ エントロピー(entropic forces)は、両親媒性(amphipathic)の高分子が水から遠ざかるように、非極性の領域を内部に隠す傾向をもたらします。
■ 塩橋(Salt bridges)、疎水性相互作用(hydrophobic interactions)、および**ファンデルワールス力(van der Waals forces)**が、生体分子の複合体(biomolecular complexes)の形成および分子の構造(conformation)の維持に関与します。
■ pHは、**[H+]**の負の対数(negative log)であり、低いpHは酸性(acidic)溶液を示し、高いpHは塩基性(basic)溶液を示します。
■ 弱酸(weak acids)の強さは、酸解離定数(acid dissociation constant)の負の対数であるpKaで表されます。強酸(strong acids)は低いpKa値を持ち、弱酸は高いpKa値を持ちます。
■ **緩衝液(Buffers)は、プロトン(H⁺)が生成または消費されたときにpHの変化を抑制します。最大の緩衝作用はpKaの前後1 pH単位以内で発生します。生理的な緩衝液には、重炭酸塩(bicarbonate)、オルトリン酸塩(orthophosphate)、およびタンパク質(proteins)**が含まれます。
OBJECTIVES
1. 水の特性とその効果
- 表面張力 (Surface Tension): 水は隣接する分子と水素結合 (hydrogen bonds) を形成する能力が高いため、表面で分子が強く結合し、表面張力が高くなります。
- 粘度 (Viscosity): 水の粘度は、水素結合により一時的に分子同士が結合することで生じます。これにより、他の多くの小さな分子に比べて粘度が高くなっています。
- 常温での液体状態 (Liquid State at Ambient Temperature): 水は水素結合により分子間に十分な引力が働き、分子が離れて気体になるのを防ぎ、常温で液体の状態を保ちます。
- 溶媒力 (Solvent Power): 水は極性分子であり、酸素原子に部分的な負電荷が、水素原子に部分的な正電荷が存在します。このため、多くの極性およびイオン性化合物を溶かすことができます。この極性により、水は溶液中でイオンや極性溶質と相互作用し、それらを安定化させることができます。
2. 水素結合の供与体または受容体として働く有機化合物の構造
- 水素結合供与体 (Hydrogen Bond Donors): O-H または N-H 基を持つ化合物、例えばアルコール (ethanol) やアミン (methylamine)、カルボン酸 (acetic acid) など。
- 水素結合受容体 (Hydrogen Bond Acceptors): 電子対を持つ電気陰性原子を含む化合物、例えばカルボニル基を含む化合物 (acetone)、エーテル (diethyl ether)、アミドなど。
3. 水中における疎水性分子と両親媒性分子の会合と配向におけるエントロピーの役割
- 疎水性分子 (Hydrophobic Molecules): 水中では、水分子が疎水性分子の周りに秩序立った構造を形成し、最大限の水素結合を維持しますが、これによりエントロピーが低下し、エネルギー的に不利になります。このため、疎水性分子は集まり、全体のエントロピーを高めます。
- 両親媒性分子 (Amphipathic Molecules): 親水性と疎水性の両方の領域を持つこれらの分子(例:リン脂質)は、疎水性部分が集まり、親水性部分が水と相互作用するように配向します。例えばミセル形成により、この配向がエントロピーを最大化します。
1. 疎水性分子 (Hydrophobic Molecules)
疎水性分子は「水をはじく」性質を持っています。たとえば油のように、水と混ざり合わない物質です。水の中に疎水性分子があると、水分子がその周りに秩序立った構造を作ります。なぜなら、水分子は互いに水素結合を作りたいので、疎水性分子の周りでできるだけ水分子同士がつながろうとします。しかし、この構造は分子が整然と配置されるため、分子の自由度が減り、エントロピー(無秩序さの度合い)が低下してしまいます。
このため、疎水性分子はお互いに引き寄せられて集まり、まとめて水の中に浮かぶことで、水が秩序立って配置される部分を減らし、エントロピーを上げることができます。この現象は、エネルギー的にも有利で、疎水性分子が集まることで水がより自由に動き回ることができるようになります。
2. 両親媒性分子 (Amphipathic Molecules)
両親媒性分子は、「親水性(=水を引き寄せる部分)」と「疎水性(=水をはじく部分)」の両方を持っている分子です。代表的な例は、リン脂質(phospholipids)です。リン脂質は、頭の部分が親水性で、水に引き寄せられやすく、尾の部分が疎水性で水を避けます。
水の中で、両親媒性分子は親水性の頭を水に向け、疎水性の尾を内側にして集まります。こうして「ミセル (micelle)」や「二重層 (bilayer)」と呼ばれる構造を作り、水との相互作用を最小限にすることでエントロピーを高めます。このように、両親媒性分子は自然に配置を変えて、水とのエネルギー的に最も安定な状態を作り出します。
4. 立体構造安定化における相互作用の定量的貢献
- 塩橋 (Salt Bridges): 正負の電荷を持つ側鎖間のイオン結合は、約 20-40 kcal/mol のエネルギーで特定の配向を安定化させます。
- 疎水性相互作用 (Hydrophobic Interactions): 各相互作用自体は弱い(約 1-2 kcal/mol)ですが、疎水性コア内に緊密に集まることで、3D構造を大きく安定化させます。
- ファンデルワールス力 (van der Waals Forces): 各相互作用のエネルギーは約 0.5-1 kcal/mol と弱いですが、分子が密集した際に多数の相互作用が集積されることで全体の安定性に寄与します。
5. pH と酸性、アルカリ性、および酸の強弱の関係
- pH は水素イオン濃度の負の対数であり、溶液の酸性やアルカリ性を表します。pHが低いほど酸性(H⁺濃度が高い)、pHが高いほどアルカリ性(H⁺濃度が低い)です。
- 弱酸と弱塩基 (Weak Acids and Bases) は部分的にしか解離せず、酸には特定の解離定数 Ka、塩基には Kbがあります。酸(または塩基)の強さはそのpKaまたはpKbと逆の関係にあります。
- 強酸と強塩基 (Strong Acids and Bases) は完全に解離するため、バッファ効果なしでpHに直接影響を与えます。
6. 緩衝溶液への酸や塩基の追加によるpHの変化の計算
- pH変化を計算するためには、以下を使用します:
- Henderson-Hasselbalchの方程式: pH=pKa+log([A−]/[HA])
- 酸または塩基を追加後の [A−]/[HA]の新しい比を求め、その比に基づいてpHを計算します。
- この方程式を使うことで、酸や塩基を加えた後のpHを計算することができます。具体的には、酸を追加すると [HA] が増え、pHが下がります。逆に塩基を追加すると [A⁻] が増え、pHが上がります。この比率によって新しいpHを求めることが可能です。
- pKaとは、酸の強さを表すための指標であり、**酸解離定数(Ka)**の負の常用対数を取ったものです。具体的には、以下のように定義されます:pKa=−log10Ka
- ここで、Kaは酸の解離定数であり、酸(HA)が水中でどの程度プロトン(H⁺)を放出して解離するかを示す値です。
- pKaの意味:
小さいpKa値:酸の解離定数 Kaが大きいことを示し、酸が強く、容易にプロトンを放出する(強酸)。
大きいpKa値:酸の解離定数 Kaが小さいことを示し、酸が弱く、プロトンを放出しにくい(弱酸)。
7. 緩衝液の役割、機能、および有効条件
- 緩衝液の機能 (Function of Buffers): 緩衝液はH⁺イオンを吸収または放出してpHの変化を防ぎ、安定したpH範囲を維持します。
- 働き方 (How They Work): 緩衝液は弱酸とその共役塩基(またはその逆)から成り、酸は追加された塩基を中和し、塩基は追加された酸を中和します。
- 有効条件 (Effective Conditions): 緩衝液はそのpKaの±1の範囲内で最も効果的に働き、この範囲では酸と共役塩基の濃度のバランスが取れています。
8. Henderson-Hasselbalchの方程式を使用したあるpHにおけるポリエレクトロライトの正味電荷の計算
- ポリエレクトロライト(例:複数のイオン化可能な基を持つタンパク質)について、pHと各イオン化可能な基のpKa値を考慮し、正味電荷を計算します。
- 指定されたpHにおける各基の帯電状態の割合を求めるためにHenderson-Hasselbalchの方程式を使用します。
- 各基の電荷を合計し、指定されたpHでの正味電荷を求めます。
教科書(図表解説)
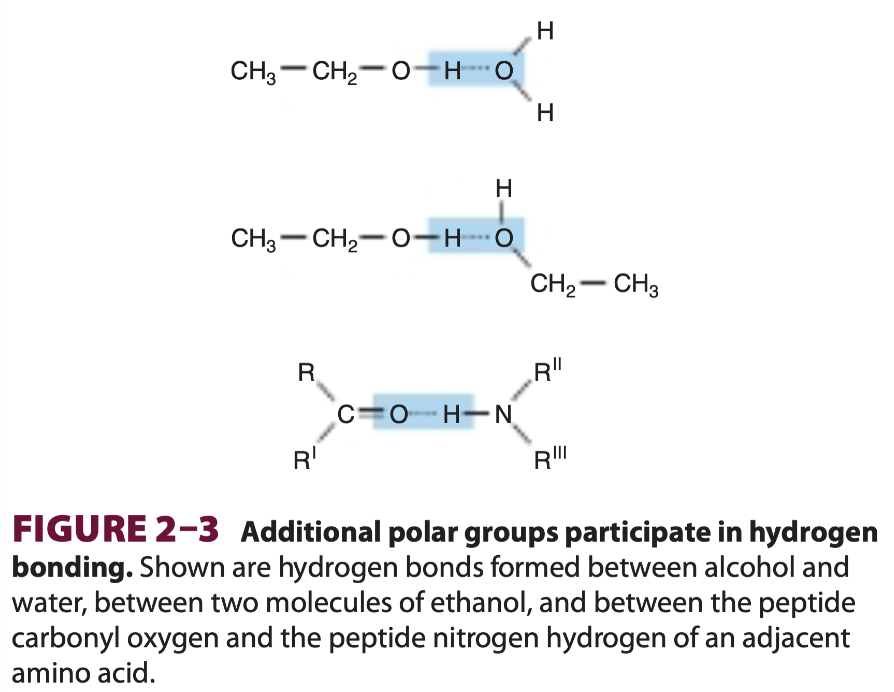
水素結合
この図は、水素結合がどのように形成されるかを示しており、特定の極性基が水素結合に関与する例を紹介しています。以下、図の各例について解説します。
1. アルコールと水の水素結合
- 図の上部は、エタノール分子(CH₃-CH₂-OH)と水(H₂O)が水素結合を形成している様子を示しています。
- エタノールのOH基の酸素が負の電荷を持ち、水分子の水素が正の電荷を帯びているため、酸素と水素の間で水素結合が形成されます。
- これは、アルコールと水の分子間で水素結合ができる一例です。
2. エタノール分子同士の水素結合
- 図の中央では、2つのエタノール分子(CH₃-CH₂-OH同士)が水素結合を形成しています。
- 同様に、エタノールの1つの分子の酸素が他の分子の水素と結びつき、水素結合ができています。
- このように、アルコール分子同士でも水素結合が可能であり、極性基が引き寄せ合うことで分子間の相互作用が生じます。
3. ペプチド結合間の水素結合
- 図の下部は、2つのアミノ酸間のペプチド結合における水素結合の形成を示しています。
- ペプチド結合は、C=O(カルボニル基)とNH(アミン基)を含み、カルボニル酸素と隣接するアミノ酸のアミド水素との間で水素結合が形成されます。
- この水素結合が、タンパク質の立体構造(例えば、αヘリックスやβシートなど)を安定させる役割を果たします。
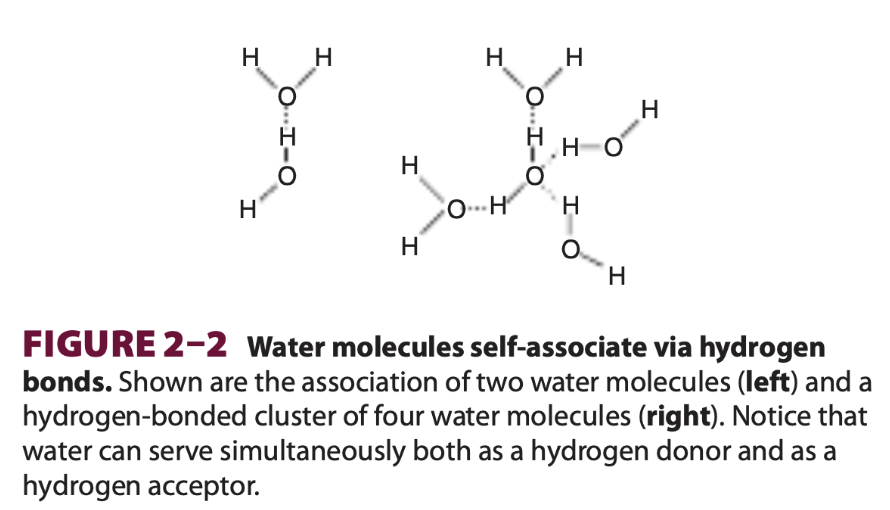
水分子の水素結合
この図は、水分子がどのように水素結合を通じて互いに結びつくかを示しています。図には、2つの水分子間の水素結合(左側)と、4つの水分子からなる水素結合のクラスター(右側)が描かれています。以下、詳しく解説します。
1. 水素結合のしくみ
- 水分子(H₂O)は、酸素原子(O)に2つの水素原子(H)が結合しています。
- 酸素は電気陰性度が高いため、酸素側に負の電荷が集中し、水素側に正の電荷が偏ります。これにより、水分子は双極子を持つ極性分子となります。
2. 水分子同士の結合
- 図の左側では、1つの水分子の酸素が、別の水分子の水素と引き合い、水素結合が形成されています。
- 水素結合は、共有結合(O-H結合)よりも弱いですが、数が多いと全体として分子間の結びつきが強くなり、水の特性に大きな影響を与えます。
3. 水分子のクラスター
- 図の右側では、4つの水分子が水素結合によってクラスター(集合体)を形成しています。
- 各水分子は、他の水分子に対して水素供与体(Hを提供する)にも受容体(Oで受け取る)にもなり、複数の水素結合が安定したクラスターを形成します。
- このようにして、水分子同士がネットワークを作り、液体の水で見られる高い表面張力や特有の粘性が生じます。
4. 水の特性への影響
- 水が他の分子と比べて高い沸点や融点を持つ理由の1つは、この水素結合によるクラスターの形成です。
- また、水分子が水素結合を通じて相互作用することで、液体の状態での安定した構造が保たれます。
生物学的に重要な原子間の結合エネルギー
この表は、生物学的に重要な原子間の結合エネルギーを示しています。結合エネルギーは、特定の結合を切断するために必要なエネルギー量(kcal/mol)で表されます。値が高いほど、結合が強く切断が難しいことを意味します。
1. 単結合と二重結合
- 表の左半分には単結合(O-O、S-S、C-Nなど)が記載されており、右半分には二重結合(O=O、C=O、C=Cなど)が記載されています。
- 一般的に、二重結合の方が単結合よりもエネルギーが高く、強固です。例えば、O=O(二重結合)のエネルギーは96 kcal/molで、O-O(単結合)の34 kcal/molよりもはるかに高いです。
2. 結合エネルギーの比較
- S-S結合(51 kcal/mol)は比較的低エネルギーで切断しやすい結合であり、タンパク質の構造内でのジスルフィド結合(S-S)は切れたり再結合したりしやすい特徴を持っています。
- N-H結合(94 kcal/mol)やO-H結合(110 kcal/mol)は比較的強く、水やアミノ酸の結合に関わるため、生体内での安定性に寄与しています。
- 特に強い結合として、C=O(164 kcal/mol)やC≡N(147 kcal/mol)が挙げられます。これらは構造の安定化に大きな役割を果たします。
3. 生物学的意義
- 弱い結合(低エネルギー)は、細胞内での反応や代謝過程で切断や再結合が容易であるため、調整可能な構造の維持や変化に役立ちます。
- 強い結合(高エネルギー)は、生体分子の骨格を安定させ、長期間にわたりその構造が変化しにくく、機能を維持するのに重要です。
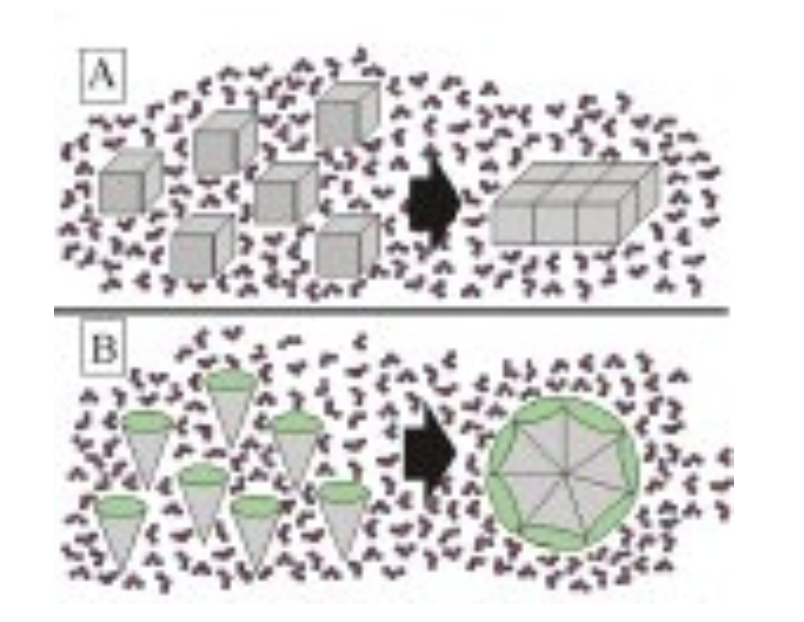
疎水性相互作用
この図は、疎水性相互作用について説明しています。疎水性相互作用とは、疎水性(非極性)の分子や分子部分が水と接触を避けて集まる現象です。この相互作用は、水分子の働きによって引き起こされます。図には、疎水性の表面と親水性の表面を持つ分子が、水分子とどのように相互作用するかが示されています。
図A:疎水性分子が水中で分散している場合と集まった場合
- 左側(分散):疎水性の立方体(灰色)が水中に分散している状態です。各立方体の表面には水分子が接触しており、36の表面すべてが水分子と不利な相互作用をしています。
- 水分子は疎水性表面に対して秩序を持った配置を取るため、エントロピーが低下し、エネルギー的に不利な状態になります。
- 右側(集合):疎水性の立方体が集まって1つの塊を形成した状態です。この場合、立方体の表面が重なり合うため、水分子と接触する表面は22に減少します。
- 水分子が接触する面が少なくなるため、エントロピーが増加し、エネルギー的により安定した状態になります。このため、疎水性分子は互いに集まる傾向があります。
図B:両親媒性分子の集合体
- 図Bは、疎水性部分(灰色)と親水性部分(緑色)を持つ両親媒性分子が集まって構造を形成する様子を示しています。
- このような分子は、水中で疎水性部分を内側に、親水性部分を外側に配置して集まり、ミセルや二重層といった安定した構造を作ります。
- これにより、水分子との不利な相互作用が減り、安定した構造が維持されます。
まとめ
この図は、疎水性相互作用が水分子の配置を最適化するために引き起こされることを示しています。疎水性分子が水中で集まると、周囲の水分子がより自由に動けるようになり、エントロピーが増加し、エネルギー的に安定します。この性質により、疎水性相互作用は分子集合体の形成や、細胞膜のような生体構造の安定に重要な役割を果たしています。
ファンデルワールス相互作用
この図は、ファンデルワールス相互作用の強さが、相互作用する分子や原子間の距離(R)によってどのように変化するかを示しています。ファンデルワールス力は非常に弱い引力ですが、多くの原子が集まることで分子間に重要な影響を与えます。以下に詳しく説明します。
1. ファンデルワールス相互作用の特徴
- ファンデルワールス力は、分子や原子間の距離がある一定範囲にあるときに生じる引力です。
- この力は非常に弱く、個々の相互作用のエネルギーは小さいですが、多くの原子が密集する大きな分子(例えばDNAやタンパク質)では、その累積効果が分子全体の安定性に寄与します。
2. 距離による相互作用の変化
- 図の横軸(R)は2つの原子や分子間の距離(オングストローム単位)、縦軸は相互作用エネルギー(kcal/mol)を表しています。
- Rが小さくなる(つまり、原子や分子が近づく)と、ファンデルワールス引力が増しますが、ある距離(図の矢印Aで示された距離)に達すると、エネルギーが最も低くなり、引力が最大になります。
- この距離がファンデルワールス接触距離と呼ばれ、分子間の安定した距離です。
3. さらに近づいたときの反発力
- 接触距離よりもさらに近づくと、各原子や分子の電子雲が重なり合うため、強い反発力が生じます。このため、相互作用エネルギーは急激に増加(プラス方向)し、分子が強く反発し合います。
- これにより、分子間には一定の距離が保たれることになり、無秩序に近づきすぎることが防がれます。
4. 生体分子におけるファンデルワールス力の重要性
- 個々のファンデルワールス相互作用は小さな力ですが、DNAやタンパク質のように多くの原子が存在する大きな分子では、これらの相互作用の累積効果が分子全体の安定性に大きく影響します。
- このような相互作用により、分子は安定した構造を取り、適切な機能を果たすことができます。
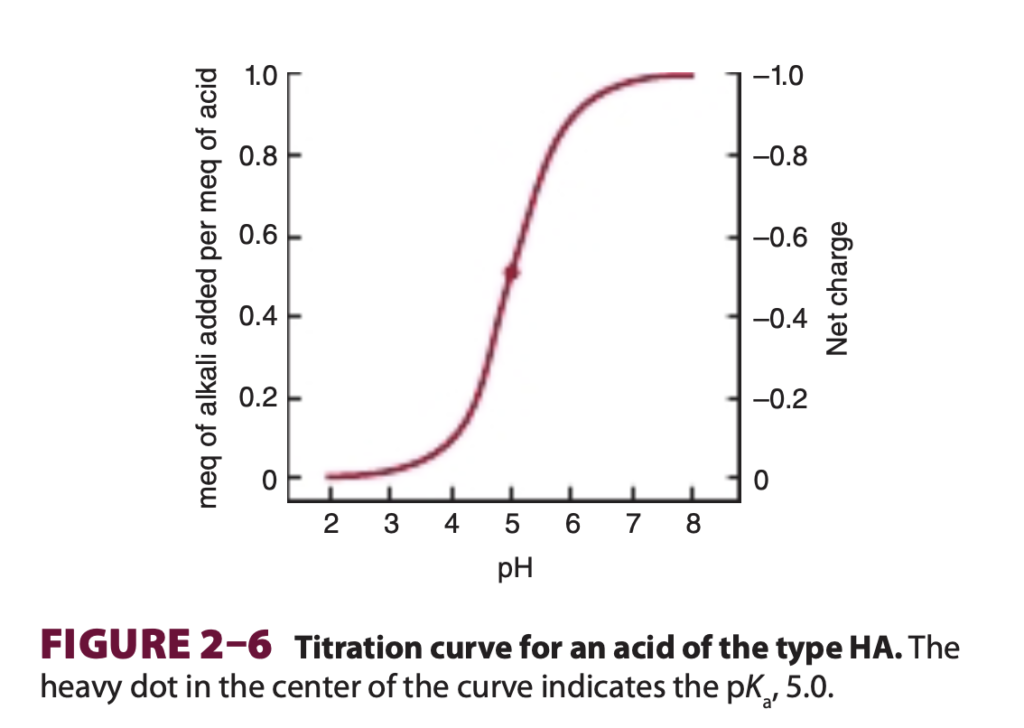
弱酸(HA)の滴定曲線
この図は、弱酸(HA)の滴定曲線を示しています。この曲線は、酸に塩基を少しずつ加えていくときのpHの変化を表し、酸のpKa(解離定数)を見つけるために利用されます。
1. 横軸と縦軸の意味
- 横軸(pH)は溶液の酸性度を示します。低いpHは酸性、高いpHは塩基性を表します。
- 左の縦軸(meq of alkali added per meq of acid)は、酸に対して加えた塩基の量を示しています。
- 右の縦軸(Net charge)は、酸分子の総電荷を示しています。酸がプロトン(H⁺)を失うにつれて電荷が変化します。
2. 曲線の形状とpKaのポイント
- この曲線はS字型をしており、中央部分で急激にpHが上昇しています。
- 中心の太い点で示されている部分は、pKa 5.0を表しており、このpHにおいて酸(HA)の50%が解離し、50%が非解離の状態になります。
- pKaは酸とその共役塩基の比が1:1になるpHで、このポイントが緩衝作用(pHの変動に対する抵抗力)を最大化するところです。
3. 滴定曲線の解釈
- 曲線の低いpH領域(左側)では、ほとんどの酸分子が非解離型(HA)として存在します。
- 塩基が加えられると、HAはH⁺を放出して解離し、pHが徐々に上昇します。
- pHがpKaに近づくと、酸と塩基の比が1:1になり、pHの変動に対する抵抗力が高まります。この範囲が緩衝領域です。
- pKaを超えるとほとんどの酸が完全に解離し、共役塩基(A⁻)として存在します。これにより、さらに塩基を加えてもpHの変化が緩やかになります。
4. 生物学的意義
- pKaの値を知ることで、酸や緩衝液が特定のpH範囲でどのように機能するかを理解できます。
- このような滴定曲線は、生体内でpHを一定に保つための緩衝液の設計や、酵素活性に適したpH範囲を調べる際に重要です。
自作アセス問題(教科書)
Question:双極性構造(dipolar structure)
問題文: What is the primary reason water has a high dielectric constant?
- a. Its ability to dissolve hydrophobic compounds
- b. Its hydrogen bonding capacity
- c. Its low molecular weight
- d. Its dipolar structure
Answer: d. Its dipolar structure
解説: 水の高い誘電率の主な原因は、分子が双極性構造 (dipolar structure) を持っていることです。双極性は水分子が正負の電荷を部分的に分けて持つことで、他の電荷を持つ物質との相互作用を強めます。他の選択肢が誤りである理由として、水分子の双極性は誘電率の高さに直接的に寄与しており、分子量や疎水性物質の溶解能力はこの特性に関係ありません。
High dielectric constant(高い誘電率)とは、ある物質が電場中で電気的にどれだけ絶縁できるか、または電荷を分離して保持できるかを示す値のことです。誘電率は物質の絶縁性能や電荷分離能力を表し、数値が高いほどその物質が持つ電気的な特性が強いことを意味します。
誘電率が高い場合の特徴:
- 電場の減衰:高誘電率の物質(例:水)は、電場中で電荷をうまく分離・保持できるため、電場の強度を減衰させる性質を持ちます。
- 分子間の引力の減少:誘電率が高い物質中では、電荷を持つ分子(イオンなど)同士の引力が弱まるため、これらの分子がより自由に動けます。
- 溶媒としての性能向上:誘電率が高い物質、特に水のような溶媒は、電荷を帯びた物質(塩や酸、塩基など)を効率的に溶かすことができます。これにより、溶液中での反応が進みやすくなります。
水の高い誘電率の例:
- **水(H₂O)は誘電率が非常に高く、約78.5(25°Cでの値)です。これは、水分子が強い双極子モーメント(dipole moment)**を持っているためであり、分子内で酸素が負の電荷、2つの水素が正の電荷を帯びた不均一な電荷分布が生じています。
- 電荷分離の効果:この高い誘電率のため、水はイオン(例えば塩のNa⁺やCl⁻)を安定的に溶かし、イオン同士が結びつく力を弱めることができます。これにより、水は**極性溶媒(polar solvent)**として、さまざまな物質を溶かす溶媒力を発揮します。
まとめ: 高い誘電率は、水などの極性溶媒において、イオンや極性分子の溶解・分離を可能にし、化学反応や生体内のプロセスにおいて重要な役割を果たしています。この特性があるため、誘電率の高い水は「生体内での理想的な溶媒」として機能しています。

Question:水素結合
問題文: Which of the following bonds is primarily responsible for stabilizing the three-dimensional structure of macromolecules like proteins and DNA?
- a. Covalent bonds
- b. Hydrogen bonds
- c. Ionic bonds
- d. Hydrophobic interactions
Answer: b. Hydrogen bonds
解説: 水素結合 (Hydrogen bonds) は、タンパク質やDNAの三次元構造を安定化させる主要な結合であり、分子内および分子間の安定性を提供します。共有結合は分子自体を構成する力ですが、三次構造の安定には関与しません。イオン結合や疎水性相互作用も影響を与えますが、水素結合が特に重要です。
Question:疎水性相互作用(Hydrophobic interaction)
問題文: What phenomenon explains the tendency of nonpolar molecules to form clusters in an aqueous environment?
- a. Hydrogen bonding
- b. Dipole-dipole interaction
- c. Hydrophobic interaction
- d. van der Waals forces
Answer: c. Hydrophobic interaction
解説: 疎水性相互作用 (Hydrophobic interaction) は、非極性分子が水中でクラスターを形成する傾向を説明します。水分子の自由度を最大限に保つため、非極性分子が互いに集まることで水との接触面を最小化します。他の選択肢が誤りである理由として、水素結合や双極子-双極子相互作用は極性分子に関連し、van der Waals力は短距離で働く弱い力です。
疎水性相互作用(Hydrophobic Interaction)
水と馴染みにくい(疎水性の)分子や部分が水中で集まり、互いにくっつき合う現象。
疎水性相互作用の意義
- タンパク質の構造形成: タンパク質内では、疎水性アミノ酸がタンパク質の内部に集まり、親水性アミノ酸が外部に配置されることで安定した立体構造を形成します。
- 生体膜の形成: 脂質二重層の膜は、疎水性の脂肪酸が内側に集まり、親水性の部分が外側に並ぶことで水に馴染む構造を作り、細胞膜のバリア機能を果たします。
Question:共有結合(Covalent bonds)
問題文: Which type of bond requires the most energy to break, thereby providing the strongest force holding biomolecules together?
- a. Ionic bonds
- b. van der Waals forces
- c. Covalent bonds
- d. Hydrogen bonds
Answer: c. Covalent bonds
解説: 共有結合 (Covalent bonds) は、バイオ分子を構成する中で最も強力で、壊すのに多くのエネルギーが必要です。イオン結合や水素結合も分子の安定に貢献しますが、共有結合に比べて弱いです。van der Waals力は最も弱い力であり、距離が近い場合にのみ作用します。
Question:誘電率(dielectric constant)
問題文: What allows water to dissolve large amounts of charged compounds like salts?
- a. Its low viscosity
- b. Its tetrahedral structure
- c. Its high boiling point
- d. Its high dielectric constant
Answer: d. Its high dielectric constant
解説: 水の高い誘電率 (high dielectric constant) により、塩のような荷電化合物を大量に溶解することが可能です。この誘電率の高さは水分子の双極性構造に由来し、他の荷電粒子間の引力を弱めます。他の選択肢が誤りである理由として、粘度や構造は誘電率に直接関係しません。
水が塩(NaClなど)のような荷電化合物をよく溶かすことができるのは、水の「高い誘電率」によるものです。この誘電率の高さは、水分子が持つ特別な「双極性構造」によって生まれています。
1. 水分子の双極性構造
- 水分子(H₂O)は酸素原子と水素原子でできており、酸素側が少し負の電荷、水素側が少し正の電荷を持っています。
- これにより、水分子は「双極子」と呼ばれる、+と-の極を持つ分子構造になります。この構造が水を「極性溶媒」にしています。
2. 誘電率とは?
- 誘電率は、ある物質が電荷の引き合う力(クーロン力)をどれくらい弱めるかを示す値です。
- 誘電率が高いほど、物質中で電荷同士が引き合う力が弱まります。
3. 水の高い誘電率の働き
- 水は非常に高い誘電率を持っているため、塩(NaCl)のような荷電化合物を水中に入れると、Na⁺とCl⁻の間の引力が弱まります。
- これは、水分子が双極子の形でNa⁺とCl⁻の周りに集まり、引力を遮るためです。水の負の酸素側がNa⁺に、正の水素側がCl⁻に引き寄せられ、イオンが水中で安定します。
4. 塩が水に溶ける理由
- Na⁺とCl⁻が水分子に囲まれると、お互いへの引力が弱まってバラバラになり、塩は水に溶けていきます。
- そのため、他の多くの荷電化合物も水中で簡単に溶けやすくなります。
Question:視床下部
Which of the following is primarily responsible for regulating the body’s water balance?
a. Adrenal glands
b. Hypothalamus
c. Liver
d. Pancreas
Answer: b. Hypothalamus
解説:
視床下部は体内の水バランスを調整する重要な役割を果たしています。視床下部は、体液の浸透圧を感知し、体が水を必要としている場合には喉の渇きを促進します。選択肢aの副腎はホルモン分泌に関与し、cの肝臓やdの膵臓はそれぞれ代謝や血糖調節に関わっていますが、水バランス調整の主要な役割は持っていません。
Question:腎性尿崩症
What condition results from the kidneys’ inability to respond to antidiuretic hormone (ADH), leading to excessive water excretion?
a. Diabetes mellitus
b. Nephrogenic diabetes insipidus
c. Acidosis
d. Hypokalemia
Answer: b. Nephrogenic diabetes insipidus
解説:
腎性尿崩症(ネフロジェニック尿崩症)は、腎臓の遠位尿細管がADHに反応できないために、体液の希釈ができず、大量の水分が排泄される状態です。選択肢aの糖尿病は血糖値の調整不良、cのアシドーシスは血液が酸性になる症状、dの低カリウム血症は血中カリウム濃度の低下に関する状態です。
Question:アシドーシス
Which of the following pH levels indicates acidosis in the human body?
a. 7.50
b. 7.40
c. 7.20
d. 7.45
Answer: c. 7.20
解説:
正常な血液pHは7.35から7.45の範囲です。pHが7.35を下回るとアシドーシスとみなされ、体が酸性状態にあることを示します。選択肢aとdは正常またはアルカローシスの範囲にあり、選択肢bの7.40は正常な血液pHです。
Question:疎水性効果とエントロピー
Which of the following best explains why nonpolar molecules cluster together in an aqueous environment?
a. Formation of covalent bonds
b. Maximization of enthalpy
c. Increase in entropy of surrounding water
d. Creation of hydrogen bonds
Answer: c. Increase in entropy of surrounding water
解説:
非極性分子が水中で集まる理由は、周囲の水分子が水素結合を最大限に形成し、エントロピーが増加するためです。これは、疎水性効果と呼ばれる現象で、エネルギー的に有利な状態を作り出します。選択肢aの共有結合やdの水素結合は非極性分子の集団化には直接関与せず、bのエンタルピーの最大化も主な要因ではありません。
非極性分子が水中で集まる理由は、「周りの水分子が水素結合を最大限に保とうとするため」であり、結果として「全体のエントロピーが増加」してエネルギー的に安定する状態が作られます。この現象を「疎水性効果」と呼びます。
1. 非極性分子と水の関係
- 非極性分子(油のような水に溶けにくい分子)は、水分子と水素結合を作ることができません。
- そのため、非極性分子が水中にあると、その周囲の水分子は自由に動きにくくなり、構造が固定化されてエントロピー(無秩序の度合い)が低下します。
2. エントロピー増加のために非極性分子が集まる
- 非極性分子がバラバラに水中に存在するよりも、集まって一か所に固まった方が、周囲の水分子が水素結合を維持しやすくなります。
- 非極性分子が集まることで、水分子の自由度が増し、エントロピーが増加します。これにより、エネルギー的に有利な状態が生まれるのです。
3. 疎水性効果としてのエネルギー安定化
- 非極性分子が集まることで周囲の水分子が自由に動けるようになり、エネルギー的に安定した状態が形成されます。
- このため、非極性分子は水中で自然に集まり、水から離れる配置を取ります。
まとめ
非極性分子が水中で集まるのは、周囲の水分子が水素結合を保ちやすくなり、エントロピーが増加してエネルギー的に有利な状態が生まれるためです。この現象が「疎水性効果」として知られています。
Question:バッファー
What role do buffers, such as bicarbonate, play in maintaining physiological pH in the body?
a. They prevent all pH changes in the blood.
b. They adjust blood pH to be exactly neutral.
c. They neutralize minor pH fluctuations.
d. They increase blood acidity.
Answer: c. They neutralize minor pH fluctuations.
解説:
体内のバッファー(緩衝剤)は、血液や体液のpHがわずかに変動するのを防ぎ、正常範囲内に保つ役割を果たします。重炭酸イオン(HCO₃⁻)はこの役割を担う重要な成分であり、酸性や塩基性の物質が血液中に入ると、それを緩衝して血液pHを安定させます。選択肢aの「すべてのpH変化を防ぐ」やbの「中性に保つ」は誤りであり、dの血液酸性度を増加させることはバッファーの役割には該当しません。
Question:誘電率(dielectric constant)
Which property of water enables it to decrease the force of attraction between charged species when dissolved?
a. High viscosity
b. Low boiling point
c. High dielectric constant
d. Low surface tension
Answer: c. High dielectric constant
Explanation:
水の高い誘電率は、帯電した粒子間の引力を減少させ、電解質や他の帯電種を水中で溶解しやすくする要因です。帯電種の間に働くクーロンの法則による力が、誘電率の高い環境(例:水)で弱まるためです。
- a. 高粘性は液体が流れる抵抗を示す特性であり、引力を減らす要因ではありません。
- b. 低沸点は物質の沸騰温度を示しますが、電荷間の引力には関与しません。
- d. 低表面張力は液体の表面が収縮しようとする力であり、引力の減少には影響しません。
Question:二重螺旋構造と水分子
What type of bond is primarily responsible for stabilizing the double-helix structure of DNA by interacting with water?
a. Ionic bonds
b. Covalent bonds
c. Hydrogen bonds
d. Disulfide bonds
Answer: c. Hydrogen bonds
Explanation:
DNAの二重らせん構造は、塩基対間の水素結合によって安定しています。また、DNAのリン酸基と水分子の間の相互作用が、DNAの溶液中での構造安定性に寄与しています。
- a. イオン結合は主に塩などのイオン性化合物で見られ、DNAの構造には直接関与しません。
- b. 共有結合はDNA鎖を構成する糖とリン酸の間にありますが、二重らせんの安定化には関与しません。
- d. ジスルフィド結合は主にタンパク質で見られる結合で、DNAには存在しません。
DNAの二重らせん構造は、二本のDNA鎖が絡み合ってらせん状になった形をしています。この構造が安定している理由は、主に以下の2つの相互作用によるものです。
1. 塩基対の水素結合
- DNAを構成する「塩基」には、アデニン(A)、チミン(T)、グアニン(G)、シトシン(C)の4種類があります。
- AとTは2本の水素結合で、GとCは3本の水素結合で結びつき、「塩基対」を作ります。
- 水素結合は強くない結合ですが、二重らせん構造の中で多数の塩基対が並ぶことで、全体として強い安定性が生まれます。
- これによって、DNAの二重らせんがしっかりと結びつき、構造が保たれるのです。
2. リン酸基と水分子の相互作用
- DNAの鎖の外側には「リン酸基」があり、これが水に対して親和性のある「親水性」の部分になります。
- DNAが水の中に存在すると、リン酸基と水分子が相互に引き寄せ合い、安定した関係ができます。
- 水分子はリン酸基と相互作用することで、DNAの周りに「水のシールド」を形成し、構造を保護します。
- この相互作用により、DNAが溶液中でも安定して二重らせん構造を保てるようになります。
Question:疎水性相互作用
In an aqueous environment, which type of interaction is primarily responsible for the formation of lipid bilayers?
a. Ionic interactions
b. Covalent bonding
c. Hydrophobic interactions
d. Van der Waals forces
Answer: c. Hydrophobic interactions
Explanation:
脂質二重層は疎水性相互作用によって形成されます。疎水性部分が水から遠ざかり、親水性部分が水と接触することで、安定した構造を作ります。
- a. イオン相互作用は、イオンが結合する際に見られるもので、疎水性の脂質分子間では発生しません。
- b. 共有結合は脂質分子内で存在しますが、二重層の形成には直接関与しません。
- d. ファンデルワールス力も関与しますが、疎水性相互作用の方が二重層の形成には重要です。
Question:疎水性効果とエントロピー
What is the primary reason for the decrease in entropy when nonpolar molecules are in contact with water?
a. Increased viscosity of water
b. Restricted orientation of water molecules
c. Increased hydrogen bonding among water molecules
d. Decreased dielectric constant of water
Answer: b. Restricted orientation of water molecules
Explanation:
非極性分子が水と接触すると、水分子の動きが制限され、エントロピーが低下します。水分子は非極性分子の周りで特定の方向に並ぶため、自由度が減少します。
- a. 水の粘性の増加は、分子の動きには影響を与えますが、エントロピーの低下には直接関与しません。
- c. 水分子間の水素結合の増加は、水の液体構造を安定させるためのものですが、エントロピー減少の主因ではありません。
- d. 水の誘電率の低下は電荷間の相互作用に影響しますが、疎水性効果とは関係ありません。
非極性分子(油などの水に溶けにくい分子)が水に入ると、周囲の水分子の動きが制限されるため、エントロピー(無秩序の度合い)が低下します。これを順を追って説明します。
1. 水分子の動きとエントロピー
- 水分子はお互いに水素結合でつながっており、絶えず動き回っています。この動きによって水分子の配置や位置が変わり、エントロピー(無秩序の度合い)が高い状態を保っています。
2. 非極性分子が水と混ざるときの影響
- 非極性分子は水と相性が悪いため、水分子はその周りに集まり、できるだけ非極性分子と接触する表面積を小さくしようとします。
- これにより、水分子が非極性分子の周囲を特定の構造で囲むようになり、水分子が自由に動けなくなります。
3. 動きが制限されるとエントロピーが低下
- 水分子が非極性分子の周りに固定されるような形になると、水分子の動きが制限され、配置が一定になってしまいます。
- これにより、もともと自由に動いていた水分子のエントロピーが低下します。つまり、無秩序な状態が減り、規則的で秩序がある状態が増えるということです。
4. エントロピーが低下する理由まとめ
- 非極性分子が水中にあると、水分子はその周囲で自由に動きづらくなり、固定された構造になりがちです。
- このため、水分子の動きが制限され、エントロピーが低下します。
Question:van der Waals forces
What force primarily facilitates the close association of DNA strands in a double helix?
a. Hydrophobic interactions
b. Hydrogen bonding
c. Ionic bonding
d. van der Waals forces
Answer: d. van der Waals forces
Explanation:
DNAの二重らせん構造において、塩基対の積層効果は主にファンデルワールス力によって安定化されます。これにより塩基が互いに引き寄せられ、らせんが形成されます。
- a. 疎水性相互作用は脂質やタンパク質の構造において重要ですが、DNAの積層効果には直接関係しません。
- b. 水素結合は塩基対間の結合に寄与しますが、積層の安定化にはファンデルワールス力が重要です。
- c. イオン結合はDNA構造には直接関与していません。
DNAの二重らせん構造は、塩基対同士が積み重なる「積層効果」によっても安定化されます。この積層効果は、主に「ファンデルワールス力」という弱い引力によって支えられています。
1. 塩基対の積層とは?
- DNAの二重らせんの内部では、A-T(アデニン-チミン)やG-C(グアニン-シトシン)の塩基対が並んでいます。
- 塩基対は、縦方向にぴったりと重なり合い、積み重なったような構造を取ります。この重なり合いが「積層」です。
2. ファンデルワールス力とは?
- ファンデルワールス力は、分子間で発生する非常に弱い引力です。
- 分子の表面にある電子の分布が瞬間的に偏ることで、隣の分子に小さな引力が生まれ、互いに引き寄せ合う力が発生します。
3. 積層効果による安定化
- 塩基対が積み重なることで、ファンデルワールス力が働き、塩基対同士が引き寄せられて安定します。
- この積層効果により、DNAの二重らせんが内側から安定し、らせん構造が崩れにくくなります。
4. 積層効果の役割
- 積層効果は、二重らせん構造の全体の安定性を支える重要な要素です。
- 塩基間の水素結合と合わせて、積層効果による安定化がDNAの構造を強固にしています。
Question:水素結合(リン酸基)
Which type of interaction helps stabilize the structure of the DNA double helix by minimizing repulsion between phosphate groups?
a) Covalent bonds
b) Ionic bonds
c) Hydrogen bonds
d) Hydrophobic interactions
Answer: c) Hydrogen bonds
解説:
DNAの二重らせんは、塩基間の水素結合や塩基の積層によるファンデルワールス力によって安定しています。特に、リン酸基の間の反発を最小限にするため、外部には親水性部分が露出し、内部には疎水性の塩基が埋め込まれています。他の選択肢である共有結合や疎水性相互作用は、DNAの二重らせん構造の安定化には直接的には関与していません。
Question:Salts bridges
問題文:How do salt bridges contribute to the stability of biomolecular structures like proteins and DNA?
a) By creating hydrophobic regions within the molecule.
b) By forming electrostatic interactions between oppositely charged groups.
c) By linking covalent bonds within the molecule.
d) By increasing the overall entropy of the molecule.
Answer: b) By forming electrostatic interactions between oppositely charged groups.
解説:
塩橋は、分子内や分子間の異なる電荷を持つ部分間の静電的な結合により、構造の安定性を高めます。例えば、タンパク質の内部ではアミノ酸側鎖間で塩橋が形成され、分子の形状や機能を保つ役割を果たします。他の選択肢は、塩橋の役割や特性を反映していません。
1. 塩橋のしくみ
- 塩橋は、正の電荷を持つ部分(例えば、アルギニンやリシンのアミノ酸側鎖)と、負の電荷を持つ部分(例えば、アスパラギン酸やグルタミン酸のアミノ酸側鎖)が互いに引き寄せられることで形成されます。
- この引き合う力は「静電的な引力(クーロン力)」と呼ばれ、電荷の違いによって強く結びつきます。
2. 塩橋が構造を安定させる理由
- タンパク質の内部や、タンパク質と他の分子の間で塩橋が形成されると、分子内の部分同士が強く引き合い、分子全体が安定します。
- 塩橋は分子の形を固定する役割を果たし、タンパク質が適切な形を保つことで、その機能を発揮できるようにします。
3. 塩橋の例
- 例えば、タンパク質の内部でアミノ酸の側鎖が電荷を帯びた状態で並んでいると、正電荷と負電荷のアミノ酸が塩橋を形成します。
- この塩橋により、タンパク質の特定の形が安定化され、その構造が維持されます。
4. 塩橋の重要性
- 塩橋は、水素結合やファンデルワールス力と並んで、タンパク質や他の生体分子の構造を安定化するための重要な要素です。
- 特に、特定の形状が必要な酵素や受容体などのタンパク質にとって、塩橋は形を維持し、正確な働きをするために不可欠です。
Question:双極性モーメント
問題文:Why is the 105° bond angle in a water molecule significant for its physical properties?
a) It creates a linear molecule, maximizing hydrogen bonding.
b) It allows for a tetrahedral arrangement, increasing surface tension.
c) It results in a dipole moment, increasing solubility of polar molecules.
d) It aligns the molecule for optimal van der Waals interactions.
Answer: c) It results in a dipole moment, increasing solubility of polar molecules.
解説:
水分子の105°の結合角度は、分子に強い双極子モーメントを与え、水が極性分子を溶解しやすくする特性に寄与しています。この双極子モーメントは、静電定数の高さと関連し、水が多くの化合物の溶媒として機能できる理由です。他の選択肢は水分子の特性を正確に表していません。
水分子(H₂O)は、その105°の結合角度と独特な形により、他の分子を溶かすのに非常に優れた性質を持っています。この性質を理解するために、以下の点で説明します。
1. 水分子の形と結合角度
- 水分子は酸素原子に2つの水素原子が結びついており、V字型の構造をしています。
- 水素原子が酸素原子と作る結合の角度は105°で、この角度が水分子の「双極子モーメント」を生み出す原因になっています。
2. 双極子モーメントとは?
- 水分子の酸素側は電子を引き寄せやすく「負の電荷」を帯びやすく、一方、水素側は「正の電荷」を帯びています。
- これにより、水分子には「+と-」の極が生まれ、電気的な「双極子」を持つことになります。
- この双極子の強さを表すのが「双極子モーメント」で、水は非常に強い双極子モーメントを持っています。
3. 双極子モーメントが水の溶媒特性に与える影響
- 水分子はこの双極子モーメントによって、他の極性分子やイオンに強く引き寄せられます。
- 極性のある物質(例えば塩のNa⁺やCl⁻イオン)は水の電荷に引き寄せられ、周囲を水分子が囲むことで溶けやすくなります。
4. 静電定数の高さと水の溶解性
- 水は「静電定数(誘電率)」が高く、これは電荷間の引力を弱める働きをします。
- 高い静電定数により、イオンや極性分子の間の引力が弱まるので、水分子がイオンや極性分子の間に入り込み、分子をばらばらにして溶かしやすくなります。
Question:求核剤(nucleophile)
What property of water makes it an excellent nucleophile in metabolic reactions?
a. Its high boiling point
b. Its large molecular size
c. Its two lone pairs of sp3 electrons
d. Its weak hydrogen bonding
Answer: c. Its two lone pairs of sp3 electrons
Explanation:
水が優れた求核剤(nucleophile)として機能する理由は、分子中の酸素原子にある2つの孤立電子対(sp3軌道)が負の部分電荷を帯びているためです。これにより、水は電子に乏しい分子(electrophiles)に攻撃を加えることができ、代謝反応で重要な役割を果たします。他の選択肢について説明すると、a(高い沸点)は求核性には直接関係なく、b(大きな分子サイズ)は水に当てはまらない特性であり、d(弱い水素結合)は水の結合性には関連しても、求核性を高める要因ではありません。
水(H₂O)は、酸素原子が「求核剤」として働くため、化学反応で非常に重要な役割を果たします。ここではその理由を、簡単に分かりやすく説明します。
1. 水分子の構造と孤立電子対
- 水分子は、酸素原子と2つの水素原子でできています。
- 酸素原子には4つの余分な電子(「孤立電子対」)があり、これらは酸素原子の周りに集まって「負の部分電荷」を持っています。
- この負の電荷により、酸素は「電子に乏しい分子(electrophile)」に引き寄せられ、反応しやすくなります。
2. 求核剤としての働き
- 「求核剤」とは、電子の多い部分(負の電荷を持つ部分)を使って、電子の少ない分子(正の電荷を持つ部分)に引き寄せられ、結合を形成できる分子のことです。
- 水の酸素原子は負の電荷を帯びているため、電子不足の分子に攻撃して結合する「求核剤」として働きます。
3. 求核攻撃のしくみ
- 例えば、代謝反応で水が電子に乏しい分子(例えばカルボニル基やリン酸基)に対して攻撃し、化学結合を切断したり新しい結合を作ったりします。
- この「求核攻撃」によって、代謝に必要な化学変化が引き起こされます。
4. 水が求核剤として重要な理由
- 水が求核剤として反応できることで、私たちの体内で多くの代謝反応が進み、エネルギーの生成や物質の分解・合成がスムーズに行われます。
- 酸素の孤立電子対が水を強力な求核剤にしているため、水は様々な反応に関与し、重要な役割を果たします。
Question:加水分解反応(hydrolysis)
Which of the following best describes hydrolysis reactions in cells?
a. They are exergonic but occur slowly without enzymes
b. They are endergonic and require ATP to proceed
c. They are exergonic and occur rapidly without any catalyst
d. They are endergonic and do not require ATP
Answer: a. They are exergonic but occur slowly without enzymes
Explanation:
加水分解反応(hydrolysis)は熱力学的にはエネルギー放出型(exergonic)であるものの、酵素なしでは進行速度が非常に遅いのが特徴です。細胞内では、プロテアーゼやヌクレアーゼなどの酵素がこの反応を加速させるために使われます。他の選択肢では、bとdは反応がエネルギーを必要とすることを示しており誤りであり、cは触媒なしで反応が迅速に進行することを示唆しているため正しくありません。
Question:phosphorolysis
Which process describes the cleavage of glycogen by adding a phosphate group?
a. Hydrolysis
b. Condensation
c. Phosphorolysis
d. Oxidation
Answer: c. Phosphorolysis
Explanation:
グリコーゲンの切断反応で、リン酸基が付加されてグルコースが遊離する反応を「リン酸分解」(phosphorolysis)と呼びます。aの加水分解(hydrolysis)は水が加わる反応、bの縮合(condensation)は水が生成される反応、dの酸化(oxidation)は電子の喪失を伴う反応であり、いずれもリン酸基を加えるプロセスではありません。
「リン酸分解(phosphorolysis)」は、グリコーゲンからグルコースが遊離する際にリン酸基が関与する反応のことです。この反応は、エネルギーを効率よく得るために重要です。
1. グリコーゲンとは?
- グリコーゲンは、体内にエネルギーを蓄えるための糖の貯蔵物質で、多くのグルコース分子が鎖状につながっています。
- 特に肝臓や筋肉に多く含まれ、必要に応じて分解され、エネルギーとして利用されます。
2. リン酸分解のしくみ
- グリコーゲンが分解されるときには、「リン酸分解」という反応が行われます。
- この反応では、グリコーゲンの中の1つのグルコース分子が、リン酸基(HPO₄²⁻)と反応し、「グルコース1-リン酸」という形で遊離します。
- このようにして切り離されたグルコースは、さらに変換されてエネルギー源として利用されます。
3. リン酸分解が重要な理由
- リン酸分解により遊離したグルコースには、最初からリン酸基が付いているため、エネルギーを使わずにそのまま代謝に組み込むことができます。
- これにより、エネルギーを節約しながらグルコースを効率よく利用できるという利点があります。
4. リン酸分解と加水分解の違い
- 通常の分解反応では水が使われる「加水分解」が多いですが、リン酸分解では水ではなくリン酸基が使われます。
- これにより、エネルギー効率の良いグルコースの遊離が可能になっています。
Question:phの計算
What is the pH of a solution with a hydrogen ion concentration of 3.2×(10の-1乗)mol/L?
a. 1.2
b. 3.5
c. 7.0
d. 10.5
Answer: b. 3.5
Explanation:
pHは水素イオン濃度の負の対数として定義されます。この場合、pHは次のように計算されます:

Question:Henderson-Hasselbalch equation
Which of the following is true regarding the Henderson-Hasselbalch equation?
a. It describes the relation between pKa and pH for strong acids
b. It calculates the dissociation constant (Ka) for strong acids
c. It is used to estimate the pH of a buffer solution
d. It only applies to completely dissociated acids and bases
Answer: c. It is used to estimate the pH of a buffer solution
Explanation:
ヘンダーソン-ハッセルバルヒの式は弱酸または弱塩基のpHを計算するためのものであり、特に緩衝液のpH変化を予測する際に用いられます。この式は強酸や完全解離する酸に対しては適用されません。他の選択肢a、b、dは式の適用範囲や使用目的に関して誤りを含んでいます。
Question:酵素の役割(反応速度)
What is the primary function of enzymes like proteases and nucleases in hydrolytic reactions within the cell?
a. To act as reactants in the reaction
b. To accelerate the rate of hydrolysis
c. To prevent the hydrolysis reaction from occurring
d. To stabilize the products of hydrolysis
Answer: b. To accelerate the rate of hydrolysis
Explanation:
細胞内で、プロテアーゼやヌクレアーゼのような酵素は、加水分解反応の速度を大幅に加速する役割を果たしています。このため、特定の条件下でバイオポリマーが適切に分解されることが可能になります。他の選択肢のa(反応物として作用する)やd(生成物の安定化)は酵素の本来の役割とは異なりますし、c(反応を防ぐ)は逆の役割で誤りです。
Question:グループ転移反応
Which of the following statements accurately describes a group transfer reaction in metabolic processes?
a. It always releases energy
b. It involves the transfer of a functional group between molecules
c. It does not require an enzyme
d. It always results in the synthesis of ATP
Answer: b. It involves the transfer of a functional group between molecules
Explanation:
グループ転移反応(group transfer reaction)は、ドナー分子からアクセプタ分子への化学基(例:グルコースのグルコシル基)の転移を伴います。多くの代謝プロセスで重要な役割を果たしており、しばしばATPの加水分解などのエネルギー供給反応と結合して進行します。他の選択肢aやdは常にエネルギーの放出やATPの合成を伴うわけではなく、cの酵素の不使用は誤りです。
**グループ転移反応(group transfer reaction)**は、ある分子(ドナー分子)から別の分子(アクセプタ分子)に化学基が移動する反応です。この反応は、体内の多くの代謝プロセスで重要な役割を果たしています。以下のポイントで詳しく説明します。
1. グループ転移反応のしくみ
- グループ転移反応では、「グルコシル基」などの化学基(特定の原子や分子の集まり)が、ある分子(ドナー分子)から他の分子(アクセプタ分子)に移されます。
- 例えば、グルコースがグルコシル基を移す際にグループ転移反応が起こります。
2. エネルギー供給と結合した反応
- 多くのグループ転移反応はエネルギーが必要ですが、体内ではATP(アデノシン三リン酸)がエネルギーの供給源として利用されます。
- ATPが加水分解(分解してエネルギーを放出すること)されることで、グループ転移に必要なエネルギーが得られ、反応がスムーズに進行します。
3. 代謝での重要性
- 例えば、グルコースがエネルギー源として利用される際、まずATPを使ってグルコースにリン酸基(phosphate group)が付加される反応が起こります。これは典型的なグループ転移反応で、エネルギーを消費しながら進行します。
- グループ転移反応がなければ、多くの代謝反応が進行せず、細胞はエネルギーを得ることができません。
Question:水の解離(dissociation)
What is the relationship between water dissociation and the concentration of hydronium ions (H3O+H_3O^+H3O+) in pure water?
a. It increases as temperature decreases
b. It is constant regardless of temperature
c. It results in a hydronium ion concentration of 1.0×10−71.0 \times 10^{-7}1.0×10−7 mol/L at 25°C
d. It creates a highly acidic solution
Answer: c. It results in a hydronium ion concentration of 1.0×10^(−7) mol/L at 25°C
Explanation:
水の解離は非常にわずかですが、25°Cの純水中では水素イオン(またはヒドロニウムイオン)の濃度は約 1.0×10−7mol/L になります。これにより中性のpH(7.0)を保つことができます。他の選択肢a(温度が下がると増加する)やd(酸性が高まる)は不正確で、bの温度に関係ないというのも誤りです。
水は通常、H₂Oの形で存在していますが、少量の水分子が自然にわずかに解離して「水素イオン(H^+)」と「水酸化物イオン(OH^-)」に分かれます。この解離は非常に小さいため、25°Cの純水中での水素イオン濃度は約 1.0 × 10^-7 mol/L という非常に低い値になります。
1. 水の解離とは
- 水分子(H₂O)は、わずかに「H^+」と「OH^-」に分かれる性質があります。
- ただし、この解離はほんの少しだけなので、大部分の水分子はH₂Oの形で存在します。
2. 25°Cの純水での水素イオン濃度
- 25°Cの純水中では、H^+ と OH^- の濃度はそれぞれ約 1.0 × 10^-7 mol/L です。
- つまり、1リットルの水の中に約 1.0 × 10^-7 モルの H^+ が存在します。
3. pHに関連する水素イオン濃度
- 水素イオン濃度 [H^+] = 1.0 × 10^-7 mol/L は、pH 7 に相当します。
- 純水の pH が中性(7)であるのは、この水素イオン濃度によるものです。
Question:amphipathic biomolecules
Which of the following describes the behavior of amphipathic biomolecules in an aqueous environment?
a. They form a uniform mixture with water
b. They separate entirely from water
c. Hydrophobic groups are buried, while hydrophilic groups interact with water
d. They dissolve completely in water without forming any structures
Answer: c. Hydrophobic groups are buried, while hydrophilic groups interact with water
Explanation:
両親媒性分子(amphipathic biomolecules)は、疎水性の部分を内部に向けて配置し、親水性の部分を水と相互作用させることで安定した構造を形成します。これにより、水とのエネルギー的に有利な相互作用が最大化され、疎水性部分が露出することによる不利なエネルギーが最小化されます。他の選択肢は、両親媒性分子の水中での挙動を正確に反映していません。
Question:Henderson-Hasselbalch式
問題文: What is the significance of the Henderson-Hasselbalch equation in understanding pH balance in biological systems?
a. It describes the relationship between enzyme activity and temperature
b. It explains the buffering capacity of weak acids and bases
c. It shows how water acts as a nucleophile in metabolic reactions
d. It measures the strength of hydrogen bonding in biomolecules
Answer: b
解説: Henderson-Hasselbalch式は、弱酸とその共役塩基(または弱塩基とその共役酸)が、どのようにしてpHを安定させる緩衝作用を発揮するかを示す式です。酸とその共役塩基の比が1:1になるとき、pHはその酸のpKaに等しくなり、最も効果的にpH変動を抑えることができます。他の選択肢(a, c, d)はそれぞれ温度と酵素活性、核酸と水の関係、または水素結合の強度に関連する内容であり、緩衝作用とは関係がありません。
Henderson-Hasselbalch式は、酸と塩基がpHを安定させる緩衝作用(buffering effect)を説明するための式です。この式を使うと、特定の酸とその共役塩基の割合に基づいて、溶液のpHを予測できます。以下でわかりやすく解説します。
1. Henderson-Hasselbalch式の形
- 式は次のように表されます:
pH=pKa+log[共役塩基]/[酸] - ここで、
- pH は溶液の酸性度を示す値です。
- pKa は酸の強さを示す値で、その酸がどれくらい解離しやすいかを表します。
- [共役塩基] / [酸] は、それぞれ共役塩基と酸の濃度です。
2. 酸と共役塩基の比率によるpHの安定化
- 弱酸とその共役塩基が混ざっていると、溶液はpHの変動に対して安定性を持ちます。これが「緩衝作用」です。
- 特に、酸とその共役塩基の濃度が1:1(つまり同じ量)になると、式は以下のようになります: pH=pKa+log1=pKa
- この状態では、pHが酸のpKaに等しくなり、最も強力な緩衝作用を発揮します。
3. 緩衝作用が最も効果的な理由
- 酸と共役塩基の濃度が等しいと、外部から酸や塩基が加えられた際に、すぐにその変化を相殺することができます。
- 例えば、酸(H^+)が加えられても共役塩基がそれを中和し、逆に塩基(OH^-)が加えられても酸が中和することで、pHの変動が抑えられます。
Question:pKaの安定範囲
問題文: Why is the pKa value of a weak acid important in the selection of buffers for biochemical reactions?
a. It determines the solubility of the buffer in organic solvents
b. It indicates the optimal temperature for buffer stability
c. It helps select a buffer that maintains pH close to the desired value
d. It measures the buffer’s ability to donate hydrogen ions at high pH
Answer: c
解説: 弱酸のpKaは、緩衝液が最も効果的に機能するpH範囲を決定するために重要です。通常、pKaが目標のpHに近い場合、その緩衝液はそのpH付近で最も安定してpHを維持します。他の選択肢(a, b, d)は、緩衝液の選択とは直接関係がない点が誤りです。緩衝液の目的は、実験や生理学的条件において、pHが大きく変動しないようにすることです。
緩衝液が最も効果的なpH範囲
- 緩衝液が最大の効果を発揮するのは、pKaの前後1 pH単位の範囲です。たとえば、pKaが4.5の酸であれば、pH 3.5から5.5の間で緩衝作用が最も安定しています。
- そのため、pHを安定させたい範囲に合わせてpKaの近い酸を選ぶことが重要です。
Question:水のイオン積(Kw)
問題文: In the ionization of water, what does the ion product constant (Kw) represent at 25°C?
a. The ratio of hydroxide ions to hydrogen ions in water
b. The product of the concentrations of hydrogen ions and hydroxide ions in water
c. The amount of energy needed to ionize water molecules
d. The pH level at which water ionizes completely
Answer: b
解説: 水のイオン生成において、KwK(水のイオン積)は水中の水素イオン(H⁺)と水酸化物イオン(OH⁻)のモル濃度の積を表します。25°Cではこの値が10^-14 mol²/L²となります。選択肢(a)は濃度の比を示していますが、実際には生成するイオンの濃度の積であるため不正解です。また、(c)はエネルギーに関する誤りがあり、(d)は水が完全に解離する条件を示すものではありません。
水のイオン生成では、水が少しだけ分解して水素イオン(H⁺)と水酸化物イオン(OH⁻)を生じます。この2つのイオンの濃度の積を「水のイオン積(Kw)」と呼びます。
1. 水のイオン積(Kw)とは?
- 水(H₂O)は一部が自然に分解し、わずかに H⁺ と OH⁻ に分かれます。
- このとき、水中で H⁺ と OH⁻ の濃度の積が一定値を保ちます。この値が「水のイオン積(Kw)」です。
2. 25°CでのKwの値
- 25°Cの純水中では、Kwの値は次のようになります: Kw=[H+]×[OH−]=10^(−14) mol^2/L^2
- つまり、水中の H⁺ の濃度と OH⁻ の濃度を掛け合わせると、25°Cでは常に 10^-14 mol²/L² という値になります。
3. Kwの意味
- Kw = 10^-14 という値は、水の中で H⁺ と OH⁻ の濃度のバランスが常に保たれていることを示しています。
- 例えば、H⁺ の濃度が増えると OH⁻ の濃度は減少し、逆に OH⁻ が増えると H⁺ が減少して、常に H⁺ と OH⁻ の積が 10^-14 になるように保たれます。
4. pHとpOHの関係
- Kwの値から、pH([H⁺]の濃度を基にした指標)と pOH([OH⁻]の濃度を基にした指標)の関係も導けます。純水の場合、pH + pOH = 14 となります。
- これにより、水の酸性度や塩基性の状態を簡単に知ることができます。
Question:Hydrophobicの作用
問題文: How does the structure of a biomolecule influence its interaction with water molecules?
a. Polar regions tend to be buried inside the molecule to avoid water
b. Hydrophobic regions interact strongly with water through hydrogen bonding
c. Hydrophilic regions are more likely to interact with water on the molecule’s surface
d. Nonpolar groups form covalent bonds with water molecules
Answer: c
解説: 生体分子の構造において、疎水性(非極性)の部分は水との接触を最小限にするために分子の内側に配置され、親水性(極性)部分は水と相互作用するために分子の表面に位置する傾向があります。この配置は、エネルギー的に有利であり、水分子との水素結合や双極子相互作用を最適化します。他の選択肢(a, b, d)はそれぞれ誤りがあり、特に(b, d)は水と疎水性の相互作用について誤解を招く内容です。
疎水性部分が分子の内側に集まり、親水性部分が外側に配置されることで、エネルギー的に安定した状態が保たれる理由は、「エントロピーの増加」と「水分子との相互作用の最適化」にあります。以下の理由で、この配置がエネルギー的に有利になります。
1. エントロピーの増加
- 疎水性部分(非極性部分)は水と馴染まず、水分子と結合しない性質を持っています。疎水性部分が水中に分散すると、水分子は疎水性部分の周りを囲むように秩序を持った配置を取らなければなりません。
- これにより、水分子の自由度が制限され、エントロピー(無秩序の度合い)が低下し、エネルギー的に不利な状態が生じます。
- 一方、疎水性部分が内側に集まって水との接触を避けると、水分子は自由に動けるようになるため、エントロピーが増加し、エネルギー的に有利な状態が保たれます。
2. 水分子との相互作用の最適化
- 親水性部分(極性部分)は水と馴染む性質があり、水分子と水素結合や双極子相互作用を形成しやすいです。
- 親水性部分が分子の外側に配置されると、水と効率よく相互作用でき、強い水素結合が形成されます。この相互作用により、分子全体が安定し、エネルギーが低い状態になります。
3. エネルギー的に安定な状態が生まれる理由
- 疎水性部分が内側に隠れることで、水分子のエントロピーが増加し、親水性部分が外側に配置されることで水との結合が強化されます。
- これにより、生体分子全体のエネルギーが低く抑えられ、安定した状態が生まれます。
まとめ
疎水性部分が内側に集まり、親水性部分が外側に配置されることは、水との相互作用を最適化し、エントロピーを増加させるため、エネルギー的に非常に有利です。この配置がタンパク質や細胞膜の構造を安定させ、適切な機能を果たせる理由です。
Question:強酸とpKa
問題文: Why do strong acids like HCl fully dissociate in water while weak acids only partially dissociate?
a. Strong acids have larger molecular weights
b. Strong acids have higher pKa values than weak acids
c. Strong acids completely dissociate due to their low pKa values
d. Strong acids interact with water through hydrogen bonding
Answer: c
解説: 強酸はpKa値が低く、完全に解離する傾向があります。これは、溶液中でプロトンを放出する能力が高いためです。弱酸は高いpKaを持ち、溶液中で部分的にしか解離しません。他の選択肢(a, b, d)は、酸の解離とpKaの関係を誤っており、酸が水中で完全に解離する理由を正確に説明していません。
強酸と弱酸の違いは、主にそれぞれのpKa値とプロトン(H⁺)を放出する能力にあります。以下に、その理由をわかりやすく説明します。
1. pKa値と酸の強さの関係
- pKaは、酸がどれくらい解離しやすいか、つまりどれだけH⁺を放出するかを表す指標です。
- pKa値が低いほど、酸がH⁺を放出しやすく、強い酸であることを意味します。
- 逆に、pKa値が高いと、H⁺を放出しにくく、弱い酸であることを示します。
2. 強酸はpKaが低く、完全に解離する理由
- 強酸は、溶液中で非常に簡単にH⁺を放出できるため、ほとんどの分子が解離してH⁺を放出し、「完全に解離する」傾向があります。
- 強酸は、解離後の分子(例えば、Cl⁻など)が安定しており、H⁺を放出した後でも分子自体が不安定になりにくい性質があります。このため、H⁺を放出してもエネルギー的に安定な状態を保ちやすく、解離が進みやすくなります。
3. 弱酸はpKaが高く、部分的にしか解離しない理由
- 弱酸は、H⁺を放出する能力が低く、溶液中で一部の分子しか解離しません。つまり、「部分的にしか解離しない」傾向があります。
- これは、弱酸がH⁺を放出すると、解離後の分子があまり安定しないため、再びH⁺を取り戻そうとする力が強く働くからです。その結果、H⁺の放出が部分的に留まり、解離が進みにくくなます。
Question:アミド結合の加水分解
問題文:Which type of bond is commonly broken during hydrolysis reactions in biological systems?
a. Ionic bonds
b. Amide bonds
c. Hydrogen bonds
d. Salt bridges
Answer: b
解説:加水分解ではアミド結合がよく分解され、これによりタンパク質や他の高分子がその構成成分に分解されます。aのイオン結合やdの塩橋は、加水分解の主なターゲットではなく、cの水素結合も直接的には関与しません。
加水分解によってアミド結合がよく分解されるのは、アミド結合が水分子との反応で切断されやすく、タンパク質や他の高分子がその構成成分に分解されるためです。この理由を以下でわかりやすく説明します。
1. アミド結合とは?
- アミド結合は、タンパク質の中でアミノ酸同士をつなげている結合です。この結合は「ペプチド結合」とも呼ばれ、タンパク質の主な構造を形成しています。
- アミド結合は、窒素原子(N)と炭素原子(C=O)の間にあり、比較的安定ですが、水分子の存在下で反応を受けやすい性質があります。
2. 加水分解のしくみ
- 加水分解とは、文字通り「水(H₂O)を加えることで分解する反応」です。
- 水分子がアミド結合に作用すると、H₂OがH⁺とOH⁻に分かれ、それぞれがアミド結合の炭素(C)と窒素(N)に付加します。
- この結果、アミド結合が切断され、元の成分(例えば、個々のアミノ酸)が遊離されます。
3. なぜアミド結合が分解されやすいのか
- アミド結合の炭素(C=O)は電子が不足しており、電子を求める性質が強いです。このため、水のOH⁻部分が炭素に引き寄せられ、反応が進みやすくなります。
- この反応により、アミド結合が切断されて、新しい結合(カルボン酸とアミン)が形成されます。
4. 加水分解の重要性
- 加水分解によってタンパク質が分解されると、体はアミノ酸などの基本構成成分を得ることができ、それを再利用して新しいタンパク質や他の必要な分子を作り出します。
- また、他の高分子(例えば、DNAやRNA)も加水分解によってその構成成分に分解され、さまざまな代謝反応に利用されます。
Question:ATP加水分解
問題文:In a coupled reaction involving ATP hydrolysis, what is the main purpose of coupling an energetically unfavorable reaction with ATP hydrolysis?
a. To decrease the free energy change of the reaction
b. To make the overall reaction thermodynamically favorable
c. To slow down the rate of the reaction
d. To produce more ATP
Answer: b
解説:ATP加水分解のエネルギーを利用することで、元来エネルギー的に不利な反応も総合的にエネルギーが有利になり進行可能になります。aは自由エネルギーの減少に関するものですが、bのように反応全体を有利にするためです。cとdは目的に沿わない回答です。
Question:水の解離
問題文:Which of the following best describes the slight tendency of water to dissociate?
a. Water dissociates completely at room temperature.
b. Water dissociates into hydronium (H3O+) and hydroxide (OH−) ions with a low probability.
c. Water cannot act as an acid or base.
d. Water dissociation only occurs in the presence of strong acids.
Answer: b
解説:水はわずかに水素イオン(H+として表示されるが、実際にはH3O+)と水酸化物イオン(OH−)に解離しますが、解離の確率は非常に低いです。aやdのように水が完全に解離するわけではなく、cは水の酸・塩基としての性質を否定しているため誤りです。
水(H₂O)は、非常にわずかな確率で「ヒドロニウムイオン(H₃O⁺)」と「水酸化物イオン(OH⁻)」に分解します。これは、通常の水分子がほとんどそのままの形で存在しているため、わずかにしか起こらない現象です。
1. 水のわずかな解離
- 水分子同士が互いに影響を与え、1つの水分子(H₂O)が別の水分子にプロトン(H⁺)を渡すことで、H₃O⁺(ヒドロニウムイオン)とOH⁻(水酸化物イオン)が生じます。
- ただし、このような分解(解離)はごくわずかな確率でしか起こりません。ほとんどの水分子はH₂Oの形で存在しています。
2. 低い確率での解離の意味
- 解離が低確率で起こるため、純水の中に存在するH₃O⁺とOH⁻の量は非常に少ないです。
- 例えば、25°Cの純水では、ヒドロニウムイオンと水酸化物イオンの濃度はそれぞれ約1.0×10^-7 mol/Lです。
3. 水の中性の性質
- H₃O⁺とOH⁻がごく少量ずつしか存在しないため、水は中性の性質を持ちます。つまり、酸性でも塩基性でもなく、pH 7の中性状態です。
Question:Nuclease
問題文:Which enzyme specifically catalyzes the hydrolysis of phosphoester bonds in nucleic acids, contributing to the regulation of these molecules in cells?
a. Protease
b. Lipase
c. Nuclease
d. Amylase
Answer: c
解説:
ヌクレアーゼは、細胞内でDNAやRNAの加水分解を触媒し、これにより核酸のホスホエステル結合が切断され、構成アミノ酸またはヌクレオチドに分解されます。選択肢aのプロテアーゼはタンパク質の加水分解を行う酵素であり、選択肢bのリパーゼは脂質を分解します。選択肢dのアミラーゼはデンプンなどの糖類を加水分解するため、これらは異なる酵素です。
ヌクレアーゼは、細胞内でDNAやRNAといった核酸を分解する酵素です。この酵素は、核酸中の「ホスホエステル結合」を切断し、それによってDNAやRNAをその構成要素であるヌクレオチドに分解します。
1. DNAとRNAの構造
- DNAやRNAは、「ヌクレオチド」という小さな単位が鎖状につながった高分子で、それぞれが遺伝情報を持つ分子です。
- これらのヌクレオチド同士は「ホスホエステル結合」という結合でつながっています。
2. ヌクレアーゼの役割
- ヌクレアーゼはDNAやRNAに働きかけ、このホスホエステル結合を「加水分解(加える水の力で分解)」して切断します。
- これにより、DNAやRNAの鎖が短いヌクレオチド単位に分解されます。
3. 分解の目的と重要性
- 細胞内ではDNAやRNAの分解が必要になることがあり、古くなった核酸の処理や、ウイルスRNAの破壊などに役立ちます。
- また、分解されたヌクレオチドは再利用され、新たなDNAやRNAの合成にも使われます。
Question:Kwと温度
問題文:How is the ion product of water Kw affected by temperature changes, and what impact does this have on pH calculation?
a. Kw decreases as temperature increases, making water less likely to ionize.
b. Kw remains constant across different temperatures, so pH is unaffected by temperature.
c. Kw increases with higher temperatures, thus decreasing the pH of pure water.
d. Kw only applies at 25°C, so temperature has no effect on its value.
Answer: c
解説:
水のイオン積 Kwは温度上昇に伴い増加し、それにより純水のpHは低下します。温度によってH+およびOH-イオンの生成が促進されるためです。選択肢aは逆の誤解であり、選択肢bとdは温度変化の影響を無視しています。
温度が上がるとKwが増加する理由
- 水の解離は吸熱反応で、温度が上がると反応が進みやすくなります。
- そのため、温度が上昇すると、より多くの水がH⁺とOH⁻に分かれるようになり、Kw(つまり [H+]×[OH−]の値)が増加します。
純水のpHの変化
- 純水では、H⁺とOH⁻の濃度は等しいため、[H+]の濃度も増加します。
- pHは [H+]の濃度の負の対数(-log)なので、[H+]が増加するとpHの値は低下します。
(pH=−log[H+]) - つまり、温度が上昇するとKwが増加し、pHが下がって純水がわずかに酸性寄りになりますが、H⁺とOH⁻のバランスは保たれています。
Question:pKaの目的
問題文:What is the primary consideration when selecting a buffer, such as HEPES or Tris, for maintaining a specific pH in biological experiments?
a. The buffer’s ionic strength.
b. The buffer’s molarity.
c. The buffer’s pKa relative to the desired pH.
d. The buffer’s ability to form hydrogen bonds.
Answer: c
解説:
緩衝液の選択において最も重要なのは、そのpKaが目的とするpHに近いかどうかです。pKaが目的のpHに近い緩衝液は、pHの変動に対して最大の抵抗力(緩衝作用)を発揮します。選択肢a、b、およびdは緩衝液選択の二次的な考慮事項であり、直接的にpHの安定化に影響を与える要素ではありません。
1. HEPES
- **HEPES(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid)**は、pH 6.8~8.2の範囲で安定した緩衝能力を持つ緩衝液です。
- 特に温度変化に強く、37°C(人体の体温)でもほぼ一定のpHを維持できるため、細胞培養や酵素反応に適しています。
- HEPESは、光学測定(蛍光や吸光度測定)にも影響を与えにくく、実験に適した特性を持っています。
2. Tris
- **Tris(tris(hydroxymethyl)aminomethane)**は、pH 7~9の範囲で使用される緩衝液です。
- よく使われるpH範囲は、生体に近い中性~弱アルカリ性で、DNAやRNAの実験、タンパク質の電気泳動などで広く利用されます。
- ただし、Trisは温度や溶液の濃度によってpHが変わりやすいため、一定の温度条件で使うことが推奨されます。
3. HEPESとTrisの選択
- pHの安定性:HEPESは温度の影響を受けにくく、Trisは温度依存性があるため、実験の温度条件によって使い分けることが重要です。
- 実験内容:Trisは多用途に利用されますが、HEPESは細胞培養や体温近くで行われる実験でよく選ばれます。
過去問(36)
Question 1
問題文: Which amino acid is not transaminated?
a. Glutamine
b. Serine
c. Tyrosine
d. Lysine
Answer: d. Lysine
解説:
- Lysineは、トランスアミネーション(アミノ基転移反応)を受けないアミノ酸の一つです。トランスアミネーションは、アミノ酸が他の分子にアミノ基を供与する反応であり、多くのアミノ酸がこの反応を通して代謝に関与しますが、Lysineの構造はこの反応に適していません。
- 他の選択肢の誤り理由:
- Glutamine: トランスアミネーション反応に参加することが多く、代謝経路においてアミノ基の供与として利用されます。
- Serine: セリンもトランスアミネーションの反応に使用され、代謝プロセスで重要な役割を果たします。
- Tyrosine: チロシンもまたトランスアミネーションに関与します。
Lysineのトランスアミネーションについての解説
Lysine(リジン)は、**トランスアミネーション反応(amino group transfer reaction)**を受けないアミノ酸の一つです。これにはいくつかの理由があります。
1. トランスアミネーションとは
トランスアミネーションは、アミノ酸が他の分子にアミノ基(NH₂)を供与する反応です。通常、この反応は以下のように進行します:アミノ酸 + α-ケト酸 → α-ケト酸(新しいアミノ酸) + グルタミン酸
トランスアミネーション反応は、主にアミノ基の転送を媒介する**アミノ基転移酵素(aminotransferases)**によって触媒されます。多くのアミノ酸はこの経路を通じて代謝に関与しています。
2. Lysineの構造
Lysineは、ε-アミノ基(アミノ基が側鎖の末端に存在)を持つアミノ酸です。この構造は、通常のα-アミノ酸(アミノ基がα-炭素に結合している)のトランスアミネーション反応とは異なります。トランスアミネーション反応では、アミノ基はα-アミノ基を持つアミノ酸から供与されますが、Lysineのアミノ基は側鎖に位置しており、これが反応に適さない要因となります。
3. Lysineの代謝経路
Lysineはトランスアミネーションによるアミノ基の転送には関与しませんが、代わりに他の代謝経路を通じて代謝されます。リジンの代謝には、リジンを介したカルボキシル化反応や、ケト酸の生成、さらにはエネルギー供給のためのアセチル-CoAへの変換が含まれます。
その他のトランスアミネーションを受けないアミノ酸
1. プロリン(Proline)
- 構造と代謝:プロリンはピロリジン環という環状構造を持つアミノ酸で、アミノ基が環内に存在します。この構造は、通常のアミノ酸のようにトランスアミネーション反応に適応することができません。プロリンはその代わりに、グルタミン酸を介して代謝されることが多いです。
- 代謝経路:プロリンは、グルタミン酸から合成される際に、まずグルタミン酸デヒドロゲナーゼにより酸化され、グルタミン酸に変換され、その後異なる経路で代謝されます。
2. セリン(Serine)
- 構造と代謝:セリンは、アミノ基がα-炭素に直接結合しているためトランスアミネーション反応に関与することができると思われがちですが、セリンは実際にはセリンヒドロキシメチル転送酵素によって代謝され、別の代謝経路に利用されます。セリンは、ホモシステインやグリシンに変換される過程で、アミノ基の転送よりも他の酵素の作用を受けることが多いです。
3. トリプトファン(Tryptophan)
- 構造と代謝:トリプトファンは、インドール環を持つ芳香族アミノ酸で、アミノ基がα-炭素に結合しています。しかし、このアミノ酸はトランスアミネーション経路には関与せず、キヌレニン経路などで代謝されることが一般的です。
- 代謝経路:トリプトファンはセロトニンやニコチン酸(ビタミンB3)に変換される過程でトランスアミネーション反応とは異なる経路を辿ります。
4. サイクリックアミノ酸
- 例:アスパラギン酸(Aspartic acid)のように、サイクリックな構造を持つアミノ酸もありますが、これらも構造的にトランスアミネーションに不向きで、他の酵素により代謝されます。
Question 2
問題文: Which amino acid is a precursor of Urea, Creatinine, and Nitric Oxide?
a. Glycine
b. Histidine
c. Proline
d. Arginine
Answer: d. Arginine
解説:
- Arginineは尿素、クレアチニン、及び一酸化窒素(Nitric Oxide, NO)の前駆体として重要な役割を果たします。特に、尿素回路においてアルギニンは尿素の生成に不可欠です。また、アルギニンから一酸化窒素を生成する酵素である一酸化窒素合成酵素(NOS)によって、血管拡張作用を持つ一酸化窒素が産生されます。
- 他の選択肢の誤り理由:
- Glycine: グリシンはクレアチニンや尿素の前駆体ではなく、コラーゲン合成などに関与します。
- Histidine: ヒスチジンは一酸化窒素や尿素の前駆体ではなく、ヒスタミンの前駆体です。
- Proline: プロリンは、主にコラーゲンの合成に重要なアミノ酸ですが、尿素や一酸化窒素の合成には関与しません。
Question 3
問題文: Which vitamin acts as a cofactor for hydroxylase enzymes catalyzing hydroxylation of lysine and proline residues?
a. Vitamin D
b. Vitamin A
c. Vitamin E
d. Vitamin C
Answer: d. Vitamin C
解説:
- Vitamin Cはリシンとプロリンの残基を水酸化する酵素(ヒドロキシラーゼ)の補因子として作用します。この水酸化反応はコラーゲンの形成にとって重要であり、ビタミンCが不足するとコラーゲンの安定性が低下し、壊血病を引き起こす可能性があります。
- 他の選択肢の誤り理由:
- Vitamin D: ビタミンDはカルシウム代謝に関与し、ヒドロキシラーゼの補因子としては機能しません。
- Vitamin A: ビタミンAは視覚や細胞分化に重要であり、水酸化反応には関与しません。
- Vitamin E: ビタミンEは抗酸化作用を持ちますが、水酸化反応の補因子として機能しません。
Question 4
問題文: Which protein structure is defined by the sequence of amino acids in a polypeptide chain?
a. Secondary structure
b. Quaternary structure
c. Tertiary structure
d. Primary structure
Answer: d. Primary structure
解説:
- Primary structureは、タンパク質の一次構造を指し、ポリペプチド鎖におけるアミノ酸の配列順序です。この配列はタンパク質の最も基本的な構造情報であり、タンパク質の機能や構造の決定において重要な役割を果たします。
- 他の選択肢の誤り理由:
- Secondary structure: 二次構造はαヘリックスやβシートといったポリペプチドの局所的な折り畳みを示します。
- Tertiary structure: 三次構造はタンパク質の三次元的な折り畳み構造です。
- Quaternary structure: 四次構造は複数のポリペプチド鎖が集合した複合体の構造です。
Question 5
問題文: Hemoglobin is an example of which protein structure?
a. Secondary structure
b. Quaternary structure
c. Primary structure
d. Tertiary structure
Answer: b. Quaternary structure
解説:
- Hemoglobinは複数のポリペプチド鎖が集合して形成される四次構造の代表例です。ヘモグロビンはαとβのサブユニットで構成され、これらのサブユニットが相互作用することで酸素の輸送機能を持ちます。
- 他の選択肢の誤り理由:
- Secondary structure: 二次構造は、ヘモグロビンのような複合タンパク質全体の構造を示すものではありません。
- Primary structure: 一次構造はアミノ酸の配列を示すだけであり、ヘモグロビンのような複数サブユニットからなる構造には当てはまりません。
- Tertiary structure: 三次構造は単一ポリペプチド鎖の三次元構造であり、四次構造とは異なります。
Question 6
問題文: Which enzyme catalyzes the formation of glutamate to glutamine?
a. Glutamine synthetase
b. Glutamine dehydrogenase
c. Glutamate aminotransferase
d. Glutathione reductase
Answer: a. Glutamine synthetase
解説:
- Glutamine synthetaseはグルタミン酸からグルタミンを生成する反応を触媒する酵素です。この反応は窒素代謝において重要であり、特にアンモニアの毒性を減少させる役割があります。
- 他の選択肢の誤り理由:
- Glutamine dehydrogenase: グルタミンデヒドロゲナーゼはグルタミンの代謝に関与するが、グルタミンの生成には関与しません。
- Glutamate aminotransferase: グルタミン酸アミノトランスフェラーゼはアミノ基転移反応に関わり、グルタミンの生成には関わりません。
- Glutathione reductase: グルタチオンリダクターゼはグルタチオンの酸化還元反応に関与する酵素であり、グルタミンの生成には関係しません。
Question 7
問題文: Which of the following is NOT an inhibitor of glutamate dehydrogenase activity?
a. ADP
b. NADH
c. ATP
d. GTP
Answer: a. ADP
解説:
- ADPはグルタミン酸デヒドロゲナーゼ(glutamate dehydrogenase, GDH)の活性を刺激する役割を持ち、阻害剤ではありません。GDHの活性はエネルギー状態に依存しており、エネルギーが低い状態(ADPが増加しているとき)では活性化し、アミノ酸分解によってエネルギー供給を助けます。
- 他の選択肢の誤り理由:
- NADH: NADHはGDHの阻害剤であり、細胞のエネルギーが十分であるときに反応を抑制します。
- ATP: ATPはGDHを阻害し、細胞がエネルギーを多く保有しているときにアミノ酸分解を抑制します。
- GTP: GTPもGDHの阻害剤であり、エネルギーが豊富な状態で代謝を制御します。
Question 8
問題文: An 8 1/2-month-old infant was admitted to the hospital in a coma and a temperature of 39.4°C (102.9°F). His pulse was elevated, his liver was enlarged, and an electroencephalogram was abnormal. The infant couldn’t retain milk, so intravenous glucose was administered, leading to rapid improvement. His urine showed high levels of glutamine and uracil, suggesting high blood ammonium levels. Which enzyme may be defective in this patient?
a. Ornithine transcarbamoylase
b. Carbamoyl phosphate synthetase 1
c. Arginase
d. Glutaminase
Answer: a. Ornithine transcarbamoylase, b
解説:
- **Ornithine transcarbamoylase (OTC)**の欠損は、尿素回路の異常によりアンモニアが蓄積し、昏睡や神経症状を引き起こす可能性があります。OTC欠損症は特に小児で多く見られ、高血中アンモニアが特徴的です。尿中のグルタミンとウラシルの増加も、OTC欠損による高アンモニア血症と一致します。
- 他の選択肢の誤り理由:
- Carbamoyl phosphate synthetase 1: この酵素も尿素回路で重要ですが、欠損症はまれであり、OTC欠損症ほど典型的な症状を示しません。
- Arginase: アルギナーゼ欠損は尿素生成の最終段階であり、高アンモニア症を引き起こしますが、一般的に肝腫大や昏睡の症状はあまり見られません。
- Glutaminase: グルタミナーゼの欠損は、アンモニア代謝の問題には直接関係しません。
Question 9
問題文: A condition related to a dietary deficiency of Vitamin C is:
a. Ehlers-Danlos Syndrome
b. Marfan Syndrome
c. Scurvy
d. Osteogenesis Imperfecta
Answer: c. Scurvy
解説:
- **Scurvy(壊血病)**は、ビタミンC欠乏症により引き起こされる病気です。ビタミンCはコラーゲン合成に必要であり、その欠乏により歯肉出血、貧血、筋肉痛などが発生します。
- 他の選択肢の誤り理由:
- Ehlers-Danlos Syndrome: 結合組織の遺伝的疾患で、ビタミンC欠乏が原因ではありません。
- Marfan Syndrome: 遺伝性の結合組織疾患で、ビタミンCの欠乏とは無関係です。
- Osteogenesis Imperfecta: 遺伝性の骨形成異常症で、ビタミンCの欠乏とは無関係です。
Question 10
問題文: Which amino acid is often linked to carbohydrate groups in glycoproteins?
a. Proline
b. Serine
c. Cysteine
d. Lysine
Answer: b. Serine
解説:
- Serineは糖タンパク質で糖鎖が結合される主要なアミノ酸の一つです。特にO-結合型糖鎖ではセリンやトレオニンに糖が結合されることが多く、糖鎖の形成と安定化に寄与します。
- 他の選択肢の誤り理由:
- Proline: プロリンは糖鎖の結合には関与しませんが、ポリペプチドの構造安定に関与します。
- Cysteine: システインは主にジスルフィド結合を形成し、糖鎖の結合には関与しません。
- Lysine: リシンも糖鎖結合には関与しませんが、タンパク質の安定性に寄与します。
アミノ酸と糖鎖の結合:グリコプロテインの解説
グリコプロテイン(glycoprotein)は、タンパク質に糖鎖(carbohydrate group)が結合した分子で、生命現象において重要な役割を果たします。以下に詳しく解説します。
1. 定義
グリコプロテインは、タンパク質の特定のアミノ酸残基に糖鎖が共有結合(covalent bond)で付加された構造を持つ分子です。この糖鎖の付加は**翻訳後修飾(post-translational modification)**の一種です。
2. 結合の種類
糖鎖は特定のアミノ酸残基に結合しますが、その結合形式は主に以下の2種類があります。
a. N結合型糖鎖(N-linked glycans)
結合部位: アスパラギン(Asparagine, Asn)の側鎖アミノ基(-NH₂)条件: アスパラギンが配列「Asn-X-Ser/Thr」(Xは任意のアミノ酸、ただしプロリンを除く)に存在する必要があります。
生成場所: 小胞体(ER)で付加が始まり、ゴルジ体で修飾されます。
役割: タンパク質の正しい折りたたみ、安定性の向上、細胞間シグナル伝達。
b. O結合型糖鎖(O-linked glycans)
結合部位: セリン(Serine, Ser)またはスレオニン(Threonine, Thr)の側鎖ヒドロキシル基(-OH)
生成場所: ゴルジ体で糖鎖が付加されます。
役割: 粘液タンパク質の粘性や細胞保護に寄与。
3. グリコプロテインの役割
グリコプロテインは多くの生理機能に関与します。
a. 細胞間認識とコミュニケーション
細胞膜上のグリコプロテインは、細胞認識や免疫応答に重要です。例: 血液型抗原(ABO型)は赤血球表面のグリコプロテインに由来します。
b. タンパク質の安定性と折りたたみ
N結合型糖鎖はタンパク質が正確に折りたたまれるのを助け、分解を防ぎます。
c. 粘液形成
粘液タンパク質(例: ムチン)はO結合型糖鎖を持ち、粘性と保護機能を提供します。
d. 酵素活性の調節
一部の酵素では、糖鎖の有無や構造が活性に影響を与えます。
4. 生合成の過程
糖鎖が付加されるプロセスは以下の通りです。
a. N結合型糖鎖の場合
糖鎖の前駆体形成: 小胞体で糖鎖前駆体が合成される。
転送: 糖鎖前駆体が特定のアスパラギン残基に付加される。
修飾: ゴルジ体で糖鎖が切断されたり修飾されたりする。
b. O結合型糖鎖の場合
初期付加: ゴルジ体で特定のセリンまたはスレオニンに単糖が付加される。
伸長: 糖鎖が順次伸長され、最終的な構造を形成する。
5. 疾患との関連
グリコプロテインの異常は、さまざまな疾患を引き起こします。
糖鎖付加異常症(Congenital Disorders of Glycosylation, CDG)
糖鎖付加や修飾に関与する酵素の欠損が原因。
症状: 成長障害、神経発達遅延、免疫不全。
がん
一部のがん細胞では異常な糖鎖が発現し、免疫からの逃避や転移を促進します。
6. 代表的なグリコプロテインの例
エリスロポエチン(Erythropoietin, EPO)赤血球の生成を促進するホルモンで、N結合型糖鎖を持つ。
抗体(Antibodies, Immunoglobulins)免疫応答で重要な役割を果たし、糖鎖修飾が機能を調節。
ムチン(Mucins)粘液の主要成分で、O結合型糖鎖を持つ。
Question 11
問題文: Which amino acid is considered essential under conditions of enhanced growth or surgical recovery?
a. Alanine
b. Arginine
c. Tyrosine
d. Glycine
e. Serine
Answer: b. Arginine
解説:
- Arginineは、通常は非必須アミノ酸ですが、成長期や外科手術後の回復期には重要な必須アミノ酸となります。体が必要とする以上に合成できない場合があるため、これらの状況では外部からの補給が推奨されます。
- 他の選択肢の誤り理由:
- Alanine: アラニンは一般的に非必須で、成長や回復期に特に必要ではありません。
- Tyrosine: チロシンも非必須であり、フェニルアラニンから合成可能です。
- Glycine: グリシンは通常十分に供給され、必須アミノ酸には分類されません。
- Serine: セリンも体内で合成可能な非必須アミノ酸です。
Question 12
問題文: Which enzyme converts an amino acid to an imino acid and then to a keto acid, releasing ammonium ion?
a. Peroxidase
b. Amino acid Oxidase
c. Glutathione reductase
d. Catalase
Answer: b. Amino acid Oxidase
解説:
- Amino acid oxidaseはアミノ酸をイミノ酸に変換し、最終的にケト酸に変換することでアンモニウムイオンを放出します。この反応は、アミノ酸の脱アミノ化により窒素を除去するための重要な経路です。
- 他の選択肢の誤り理由:
- Peroxidase: 過酸化水素を分解する酵素で、アミノ酸の代謝には関与しません。
- Glutathione reductase: グルタチオンの還元に関与し、アンモニウムの生成には関わりません。
- Catalase: 過酸化水素を分解する酵素で、アンモニウムの生成には関与しません。
Question 13
問題文: Folding of short, contiguous segments of polypeptide into geometrically ordered units is characteristic of which protein structure?
a. Primary structure
b. Tertiary structure
c. Secondary structure
d. Quaternary structure
Answer: c. Secondary structure
解説:
- Secondary structureはポリペプチドの短いセグメントが幾何学的に整列した構造であり、αヘリックスやβシートのような特徴的な形状をとります。これらの構造はタンパク質の基礎的な形を形成し、三次および四次構造の土台となります。
- 他の選択肢の誤り理由:
- Primary structure: 一次構造はアミノ酸の配列そのものであり、折りたたみや幾何学的な構造には関与しません。アミノ酸が並んだ線状の配列が基本構造です。
- Tertiary structure: 三次構造はポリペプチド鎖全体の三次元的な折りたたみ構造を指し、二次構造がさらに複雑に組み合わさったものです。
- Quaternary structure: 四次構造は複数のポリペプチド鎖(サブユニット)が相互作用して形成される複合体構造です。単一のポリペプチド鎖の二次構造の形成とは異なります。
Question 14
問題文: Transdeamination occurs when:
a. There is a conversion of α-amino nitrogen to creatinine by the action of glutamate aminotransferase and glutamate dehydrogenase
b. There is a conversion of α-amino nitrogen to urea by the action of glutamate synthetase and glutamate dehydrogenase
c. There is a conversion of α-amino nitrogen to ammonia by the action of alanine aminotransferase and pyruvate dehydrogenase
Answer: b. There is a conversion of α-amino nitrogen to urea by the action of glutamate synthetase and glutamate dehydrogenase, c
解説:
- Transdeaminationは、アミノ基転移反応と脱アミノ反応が組み合わさった反応であり、最終的に尿素回路で尿素が生成されます。グルタミン酸合成酵素(glutamate synthetase)とグルタミン酸デヒドロゲナーゼ(glutamate dehydrogenase)が協調して、α-アミノ窒素がアンモニアに変換され、さらに尿素に合成されます。
- 他の選択肢の誤り理由:
- a. グルタミン酸アミノトランスフェラーゼやグルタミン酸デヒドロゲナーゼはクレアチニンの合成には関与しません。
- c. アラニンアミノトランスフェラーゼとピルビン酸デヒドロゲナーゼは、アンモニアの生成と直接関係はありません。
L-グルタミン酸デヒドロゲナーゼ(L-Glutamate Dehydrogenase, GDH)の解説
L-グルタミン酸デヒドロゲナーゼ(GDH)は、**窒素代謝(nitrogen metabolism)**の中心的な役割を果たす酵素であり、特にアミノ酸代謝とアンモニアの生成において重要です。
1. 主な役割
- GDHは、アミノ酸の窒素(アミノ基)をアンモニア(ammonia, NH₃)として分離します。
- アミノ酸の代謝中、アミノ基は通常**α-ケトグルタル酸(α-ketoglutarate)**に転移され、L-グルタミン酸(L-glutamate)が生成されます。
- GDHは、このL-グルタミン酸からアンモニアを放出し、窒素代謝を進めます。
2. 反応メカニズム
a. トランスデアミネーション(Transdeamination)
- プロセス:
- まず、**グルタミン酸アミノトランスフェラーゼ(Glutamate Aminotransferase)**により、他のアミノ酸からα-ケトグルタル酸へアミノ基が転移され、L-グルタミン酸が生成されます。
- 次に、GDHがL-グルタミン酸を酸化し、アンモニアを生成します。
- この二段階のプロセスを「トランスデアミネーション(transdeamination)」と呼びます。
b. 酵素反応の詳細
- 基質:
L-グルタミン酸(L-glutamate) - 生成物:
α-ケトグルタル酸(α-ketoglutarate) + アンモニア(NH₃) - 補酵素:
NAD⁺またはNADP⁺(どちらも使用可能)
3. 可逆性と機能
GDHの反応は**可逆的(reversible)**であり、以下のように働きます:
- 分解:
グルタミン酸を分解してアンモニアを生成(異化作用)。 - 合成:
α-ケトグルタル酸を利用してグルタミン酸を合成(同化作用)。これはアミノ酸合成に寄与します。
4. 調節機構
GDH活性は、エネルギー状態によって**アロステリック制御(allosteric regulation)**されています:
- 阻害因子:
- ATP, GTP, NADH: 細胞内エネルギーが高い状態ではGDHを阻害し、窒素の放出を抑制します。
- 活性化因子:
- ADP: エネルギー不足時にGDHを活性化し、代謝を促進します。
5. 生理的意義
- 窒素代謝:
アンモニアは、尿素サイクル(urea cycle)に送られ、毒性の低い尿素に変換されて排出されます。 - アミノ酸合成:
α-ケトグルタル酸を用いてグルタミン酸を再生し、新たなアミノ酸の生成をサポートします。
6. 疾患との関連
GDHの異常は、以下のような病態に関連します:
- 高アンモニア血症(Hyperammonemia):
GDH機能が低下すると、アンモニアの適切な除去が困難になり、血中アンモニア濃度が上昇します。 - エネルギー代謝異常:
ATPやGTPによる調節不全が代謝全体に影響を及ぼします。
Question 15
問題文: Ammonia is toxic to the central nervous system.
a. TRUE
b. FALSE
Answer: a. TRUE
解説:
- Ammoniaは中枢神経系に有毒であり、特に肝不全などで高アンモニア血症になると神経症状が発生します。脳に蓄積したアンモニアは神経伝達に影響を及ぼし、昏睡などの深刻な症状を引き起こすことがあります。
Question 16
問題文: What type of metabolic pathway is urea synthesis organized?
a. Linear
b. Cyclic
c. Branched
Answer: b. Cyclic
解説:
- Urea cycle(尿素回路)は代謝経路の一種であり、環状(cyclic)構造を持ちます。尿素はアミノ酸代謝により生成された窒素を排出する役割を果たし、オルニチンやシトルリンなどの中間産物が循環的に反応に関与します。
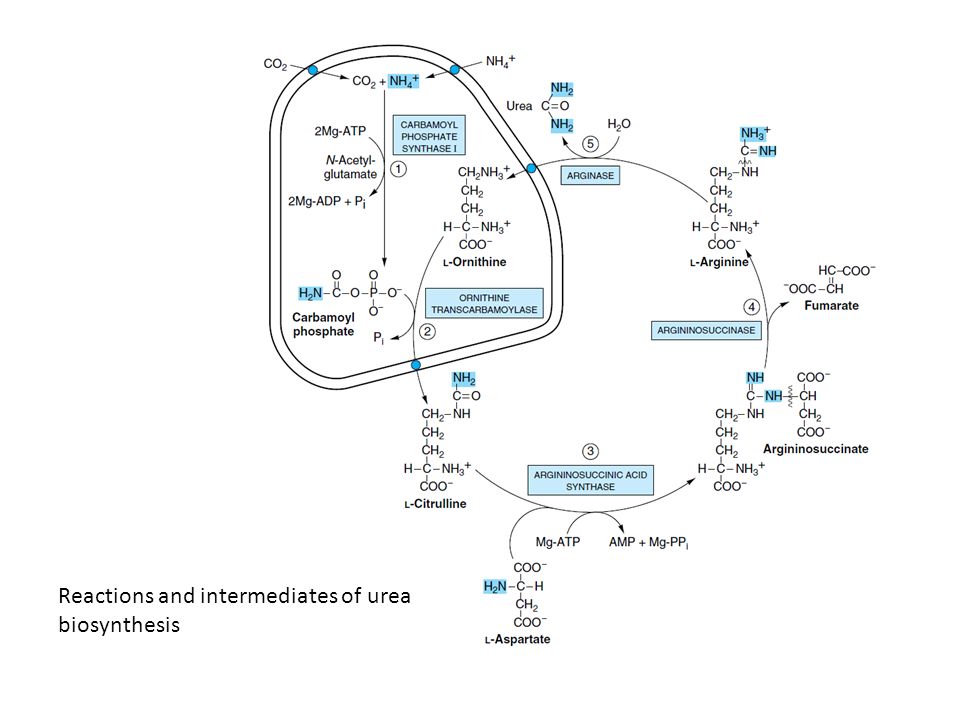
尿素回路(Urea Cycle)は、主に肝臓で行われる代謝経路で、過剰な窒素(アンモニア, NH₃)を毒性の低い尿素(urea)に変換して排出する役割を果たします。以下に、図28-16に基づき、各反応の詳細を説明します。
1. 尿素回路の全体像
尿素回路は主に次の2つの細胞内区画で進行します:
- ミトコンドリア基質(Mitochondrial Matrix)
→ 反応(1)と(2) - 肝細胞の細胞質(Cytosol)
→ 反応(3)、(4)、(5)
2. 各反応の詳細
(1) カルバモイルリン酸の合成
- 場所: ミトコンドリア基質
- 酵素: カルバモイルリン酸合成酵素I(Carbamoyl Phosphate Synthetase I, CPS I)
- 基質:
- 二酸化炭素(CO₂) → 重炭酸イオン(HCO₃⁻)として使用
- アンモニウムイオン(NH₄⁺)
- ATP(2分子)
- 生成物: カルバモイルリン酸(Carbamoyl Phosphate)
- 特徴: この反応は尿素回路の律速段階であり、N-アセチルグルタミン酸(N-Acetylglutamate, NAG)がアロステリック活性化因子として作用します。
(2) シトルリンの生成
- 場所: ミトコンドリア基質
- 酵素: オルニチントランスカルバミラーゼ(Ornithine Transcarbamylase, OTC)
- 基質:
- カルバモイルリン酸
- オルニチン(Ornithine)
- 生成物: シトルリン(Citrulline)
- 特徴: シトルリンはミトコンドリア基質から細胞質へ輸送されます(赤い点で示されたキャリアタンパク質を介して)。
(3) アルギニノコハク酸の生成
- 場所: 細胞質
- 酵素: アルギニノコハク酸合成酵素(Argininosuccinate Synthetase, ASS)
- 基質:
- シトルリン
- アスパラギン酸(Aspartate)
- ATP
- 生成物: アルギニノコハク酸(Argininosuccinate)
- 特徴: アスパラギン酸は窒素供与体として作用します。
(4) フマル酸とアルギニンの生成
- 場所: 細胞質
- 酵素: アルギニノコハク酸リアーゼ(Argininosuccinate Lyase, ASL)
- 基質: アルギニノコハク酸
- 生成物:
- フマル酸(Fumarate) → TCA回路へ送られる
- アルギニン(Arginine)
(5) 尿素の生成
- 場所: 細胞質
- 酵素: アルギナーゼ(Arginase)
- 基質: アルギニン
- 生成物:
- 尿素(Urea) → 尿中排泄
- オルニチン(Ornithine) → ミトコンドリアに戻り、再利用
3. 反応の輸送に関するポイント
- 特定のキャリアタンパク質:
- **オルニチン(Ornithine)とシトルリン(Citrulline)**は、ミトコンドリア内膜に存在する特定のキャリアタンパク質を介して移動します。これにより、回路全体がスムーズに進行します。
- 代謝の連携: ミトコンドリアと細胞質の間で中間体が移動することで、尿素回路と他の代謝経路(例: TCA回路)が密接に連携します。
4. 尿素回路の臨床的意義
a. アンモニアの排除
- アンモニア(NH₃)は神経毒性があり、高濃度になると高アンモニア血症(Hyperammonemia)を引き起こします。
- 尿素回路はアンモニアを効率的に排出する仕組みを提供します。
b. 酵素欠損症
- 尿素回路の各段階に関与する酵素(例: CPS I, OTC, ASSなど)の欠損症は、尿素の生成不全を引き起こし、高アンモニア血症に繋がります。
- 各酵素欠損症の診断には、血中または尿中の特定の中間体(例: シトルリン、アルギニノコハク酸)の測定が利用されます。
5. 尿素回路の全体の流れのまとめ
- ミトコンドリアでアンモニアとHCO₃⁻からカルバモイルリン酸を生成。
- カルバモイルリン酸とオルニチンからシトルリンを生成。
- 細胞質でシトルリンがアスパラギン酸と反応し、アルギニノコハク酸を生成。
- アルギニノコハク酸が分解され、フマル酸とアルギニンを生成。
- アルギニンが尿素を生成し、オルニチンが再利用。
これにより、体内の過剰な窒素が尿素として効率的に排出されます。
Question 17
問題文: Which enzyme catalyzes the transfer of amino groups to pyruvate?
a. Glutamate dehydrogenase
b. Alanine synthetase
c. Glutamate aminotransferase
d. Alanine-pyruvate aminotransferase
Answer: d. Alanine-pyruvate aminotransferase
解説:
- Alanine-pyruvate aminotransferaseは、ピルビン酸にアミノ基を移してアラニンを生成する反応を触媒します。この反応は、アミノ酸代謝と糖新生の重要なリンクとなります。
Question 18
問題文: Which amino acid is an important precursor of Thyroxine?
a. Threonine
b. Methionine
c. Tyrosine
d. Tryptophan
Answer: c. Tyrosine
解説:
- Tyrosineは甲状腺ホルモンであるサイロキシン(Thyroxine)の前駆体として重要です。甲状腺での酵素反応により、チロシンからサイロキシンが合成されます。
Question 19
問題文: What product is formed in a transamination reaction catalyzed by glutamate aminotransferase?
a. Aspartate
b. Pyruvate
c. Glutamate
d. Alanine
Answer: a. Aspartate, d
解説:
- Glutamate aminotransferaseは、グルタミン酸とオキサロ酢酸を反応させてアスパラギン酸を生成します。この反応は窒素代謝において重要で、アミノ酸の合成と代謝に役立ちます。
グルタミン酸アミノトランスフェラーゼ (Glutamate Aminotransferase) の役割
1. 反応概要
- 触媒する反応: グルタミン酸(Glutamate)とオキサロ酢酸(Oxaloacetate)が反応して、アスパラギン酸(Aspartate)とα-ケトグルタル酸(α-Ketoglutarate)を生成します。
- 化学式:
Glutamate + Oxaloacetate ⇌ Aspartate + α-Ketoglutarate
- 化学式:
- 酵素名: グルタミン酸アミノトランスフェラーゼ(またはアスパラギン酸アミノトランスフェラーゼとしても知られる)
- EC番号: EC 2.6.1.1
2. 反応の意義
a. 窒素代謝における中心的役割
- アミノ酸のアミノ基(Amino group)を効率的に転送し、窒素代謝を円滑に進めます。
- アスパラギン酸の生成: アスパラギン酸は尿素回路(Urea cycle)の重要な中間体であり、アンモニア(NH₃)の排出に不可欠です。
- アスパラギン酸は尿素回路でアルギノコハク酸(Argininosuccinate)の生成に使用されます。
b. アミノ酸の合成
- グルタミン酸からアミノ基を転送することで、他のアミノ酸(特にアスパラギン酸)の合成に寄与します。
- この過程は、新たなアミノ酸を作るだけでなく、代謝経路間の窒素バランスを保ちます。
c. エネルギー代謝とのリンク
- 生成されるα-ケトグルタル酸は、クエン酸回路(TCAサイクル)において重要な中間体であり、エネルギー産生に利用されます。
3. 酵素の反応機構
a. Ping-Pong 機構
- グルタミン酸アミノトランスフェラーゼの反応は、Ping-Pong機構で進行します。
- グルタミン酸が酵素の活性部位に結合し、アミノ基を転移します。
- 酵素が中間体を形成し、オキサロ酢酸にアミノ基を付加してアスパラギン酸を生成します。
b. 補酵素
- ピリドキサールリン酸(Pyridoxal Phosphate, PLP):
- 酵素の補酵素として、アミノ基の移動に重要な役割を果たします。
4. 臨床的意義
a. 血清中のAST(アスパラギン酸アミノトランスフェラーゼ)の測定
- 肝疾患(例: 肝炎、肝硬変)や心疾患(例: 心筋梗塞)において、ASTレベルが上昇します。
- 血液検査でASTとALT(アラニンアミノトランスフェラーゼ)の比率を調べることで、疾患の診断や重症度の評価に役立ちます。
b. 尿素回路障害
- アスパラギン酸の不足や酵素の異常があると、尿素回路が適切に機能せず、高アンモニア血症(Hyperammonemia)を引き起こす可能性があります。
Question 20
問題文: Which derivative of Vitamin B6 serves as a cofactor for transamination reactions in amino acid metabolism?
a. Pyridoxal Phosphate
b. Cobalamin
c. Tetrahydrobiopterin
d. N-acetyl Glutamate
Answer: a. Pyridoxal Phosphate
解説:
- **Pyridoxal Phosphate (PLP)**はビタミンB6の活性型で、アミノ基転移反応において補酵素として働きます。アミノ酸の代謝反応にはPLPが不可欠です。
Question 21
問題文: Positive Nitrogen balance occurs when:
a. There is an excess of excreted nitrogen over ingested nitrogen
b. There is a balance between excretion and ingestion of nitrogen
c. There is an excess of ingested nitrogen over excreted nitrogen
Answer: c. There is an excess of ingested nitrogen over excreted nitrogen, a
解説:
- Positive Nitrogen Balance(正の窒素バランス)は、摂取された窒素量が排出される窒素量を上回る状態を指し、主に成長期や筋肉の回復期、妊娠などで見られます。
Question 22
問題文: What is the major end product of nitrogen catabolism in humans?
a. Allantoin
b. Creatinine
c. Urea
d. Uric Acid
Answer: c. Urea
解説:
- Ureaはヒトにおける窒素代謝の主要な最終産物です。アミノ酸の分解により発生するアンモニアは毒性が高いため、肝臓で尿素に変換されて排泄されます。尿素は水溶性であり、腎臓を通じて尿中に排出されるため、体内の窒素を安全に処理できます。
- 他の選択肢の誤り理由:
- Allantoin: 一部の動物では尿酸が代謝されてアラントインが生成されますが、ヒトでは主な窒素代謝産物ではありません。
- Creatinine: クレアチニンは筋肉のエネルギー代謝の副産物であり、窒素代謝の主要最終産物ではありません。
- Uric Acid: 尿酸はプリン代謝の最終産物であり、主に窒素代謝には関係しません。
Question 23
問題文: Which amino acid contains an imino group?
a. Glycine
b. Threonine
c. Cysteine
d. Proline
Answer: d. Proline
解説:
- Prolineはイミノ基を含むアミノ酸であり、その独特の環状構造により、他のアミノ酸とは異なる特性を持ちます。この構造により、ポリペプチドの二次構造において独特の折り畳みパターンを形成することができます。
- 他の選択肢の誤り理由:
- Glycine: グリシンはアミノ基を持ちますが、イミノ基は含まれていません。
- Threonine: スレオニンもアミノ基を持ち、イミノ基は含まれていません。
- Cysteine: システインもアミノ基を持ち、イミノ基は含まれていません。
Question 24
問題文: A deficiency of which enzyme causes Hyperornithinemia, Hyperammonemia, and Homocitrullinuria (HHH) syndrome?
a. Arginase
b. Ornithine transcarbamoylase
c. Carbamoyl phosphate synthetase 1
d. Ornithine permease
Answer: d. Ornithine permease
解説:
- Ornithine permeaseの欠損は、HHH症候群の原因となります。この酵素はオルニチンのミトコンドリアへの輸送を媒介しており、欠損により高アンモニア血症や高オルニチン血症が生じます。
- 他の選択肢の誤り理由:
- Arginase: アルギナーゼ欠損はHHH症候群とは異なり、アルギニン代謝異常を引き起こします。
- Ornithine transcarbamoylase: オルニチントランスカルバモイル酵素の欠損は高アンモニア血症を引き起こしますが、HHH症候群とは異なります。
- Carbamoyl phosphate synthetase 1: カルバモイルリン酸合成酵素1の欠損も高アンモニア血症を引き起こしますが、HHH症候群ではありません。
Ornithine Permease(オルニチン透過酵素)について、そしてその欠損によって引き起こされるHHH症候群(Hyperornithinemia, Hyperammonemia, and Homocitrullinuria)について解説します。
Ornithine Permeaseとは?
Ornithine permease(オルニチン透過酵素)は、オルニチンを細胞内、特にミトコンドリアのマトリックス(内部)に輸送する膜タンパク質です。この輸送が正常に行われることで、オルニチンは尿素回路(オルニチン回路)に組み込まれ、アンモニア(NH₃)を無害な尿素に変換するための反応に使われます。
HHH症候群(Hyperornithinemia, Hyperammonemia, and Homocitrullinuria)
HHH症候群は、ORC1遺伝子の突然変異によって引き起こされる遺伝性疾患です。この遺伝子はオルニチン透過酵素をコードしており、その機能不全が尿素回路の異常を引き起こします。
- Hyperornithinemia(高オルニチン血症): オルニチンが正常にミトコンドリアに輸送されないため、細胞質にオルニチンが蓄積し、血中オルニチン濃度が高くなります。
- Hyperammonemia(高アンモニア血症): 尿素回路が正常に機能しないため、アンモニアが解毒されず血中に蓄積します。アンモニアは神経毒性を持つため、神経学的症状を引き起こすことがあります。
- Homocitrullinuria(ホモシトルリン尿症): 通常、オルニチンはミトコンドリアでカルバモイルリン酸と結びついて尿素回路に組み込まれますが、オルニチンが欠乏するとカルバモイルリン酸がリジンと結びついてホモシトルリンという化合物を生成します。これが尿中に排泄されるため、ホモシトルリン尿が発生します。
ORC1遺伝子の変異とその影響
ORC1遺伝子の変異によって、オルニチン透過酵素の機能が障害されると、オルニチンのミトコンドリアへの取り込みができなくなり、尿素回路が機能不全に陥ります。これにより、アンモニアの解毒が行われず、蓄積が起こります。
さらに、オルニチンが尿素回路で使われないと、代わりにカルバモイルリン酸がリジンと結びつき、ホモシトルリンが生成されるため、ホモシトルリン尿が発生します。
病態の要約
- オルニチン透過酵素の欠損によってオルニチンがミトコンドリアに入れず、尿素回路が機能しない。
- アンモニアが解毒されず血中に蓄積し、高アンモニア血症を引き起こす。
- オルニチンが正常に利用されないため、カルバモイルリン酸がリジンと結びつき、ホモシトルリンが生成され、ホモシトルリン尿が生じる。
この疾患は、早期の診断と治療が重要であり、特に低アンモニア血症を防ぐための治療が求められます。
Question 25
問題文: Which enzyme converts Phenylalanine to Tyrosine?
a. Phenylalanine hydroxylase
b. Tyrosine aminotransferase
c. Alanine aminotransferase
d. Proline hydroxylase
Answer: a. Phenylalanine hydroxylase
解説:
- Phenylalanine hydroxylaseはフェニルアラニンをチロシンに変換する酵素です。この反応は、チロシンがサイロキシンやドーパミンなどの重要なホルモンや神経伝達物質の前駆体となるため、代謝において非常に重要です。
- 他の選択肢の誤り理由:
- Tyrosine aminotransferase: チロシンアミノトランスフェラーゼはチロシン代謝に関与しますが、フェニルアラニンの変換には関与しません。
- Alanine aminotransferase: アラニンアミノトランスフェラーゼはアラニンと関連し、フェニルアラニンの代謝には関与しません。
- Proline hydroxylase: プロリンヒドロキシラーゼはプロリンの代謝に関与し、フェニルアラニンの変換には関係しません。
Question 26
問題文: Which amino acid is a precursor of histamine?
a. Aspartate
b. Histidine
c. Cysteine
d. Serine
Answer: b. Histidine
解説:
- Histidineはヒスタミンの前駆体です。ヒスタミンは免疫反応やアレルギー反応、胃酸分泌に関与する生理活性物質です。ヒスチジンからヒスタミンへの変換は脱炭酸酵素により行われます。
- 他の選択肢の誤り理由:
- Aspartate: アスパラギン酸はヒスタミンの前駆体ではなく、他の代謝経路に関与します。
- Cysteine: システインはグルタチオン合成に関与しますが、ヒスタミンの合成には関係しません。
- Serine: セリンもヒスタミン合成には関与していません。
Question 27
問題文: Which amino acid, though synthesized by the human body, must be taken in the diet to meet the body’s needs?
a. Methionine
b. Asparagine
c. Tyrosine
d. Proline
e. Glutamine
Answer: a. Methionine
解説:
- Methionineは体内で十分に合成できないため、食事からの摂取が必要な必須アミノ酸です。他の選択肢のアミノ酸は通常体内で合成可能です。
- 他の選択肢の誤り理由:
- Asparagine: アスパラギンは体内でグルタミン酸から合成できます。
- Tyrosine: チロシンはフェニルアラニンから合成できるため、食事からの摂取は必須ではありません。
- Proline: プロリンはグルタミン酸から合成可能です。
- Glutamine: グルタミンも体内で十分に合成可能で、必須アミノ酸には分類されません。
Question 28
問題文: Which amino acid serves as an important source of ammonia?
a. Aspartate
b. Asparagine
c. Glutamate
d. Glutamine
Answer: d. Glutamine
解説:
- Glutamineはアンモニアの主要な供給源であり、特に腎臓や肝臓でのアンモニア生成において重要な役割を果たします。グルタミンからアンモニアを放出する反応は、酸塩基バランスの調整にも寄与します。
- 他の選択肢の誤り理由:
- Aspartate: アスパラギン酸は尿素回路に関与しますが、アンモニアの主要な供給源ではありません。
- Asparagine: アスパラギンも一部でアンモニアを供給しますが、主要な供給源ではありません。
- Glutamate: グルタミン酸もアンモニアの供給源となりますが、グルタミンほどではありません。
Question 29
問題文: The condensation of CO₂, ammonia, and ATP to form carbamoyl phosphate occurs in which part of the hepatocyte?
a. Cytosol
b. Endoplasmic reticulum
c. Lysosome
d. Mitochondria
Answer: d. Mitochondria
解説:
- Carbamoyl phosphate synthesisはミトコンドリアで行われます。尿素回路の初期反応であり、ミトコンドリア内でのアンモニアと二酸化炭素の結合によってカルバモイルリン酸が生成されます。
- 他の選択肢の誤り理由:
- Cytosol: 細胞質ではなく、ミトコンドリア内で反応が進行します。
- Endoplasmic reticulum: 小胞体は主にタンパク質や脂質の合成に関与し、カルバモイルリン酸の合成には関わりません。
- Lysosome: リソソームは細胞内消化に関与し、尿素回路の反応には関与しません。
Question 30
問題文: What is an important activator of Carbamoyl Phosphate Synthetase 1?
a. N-acetylglutamate
b. Citrulline
c. Argininosuccinate
d. Carbamoyl phosphate
Answer: a. N-acetylglutamate
解説:
- N-acetylglutamateはカルバモイルリン酸シンターゼ1(CPS1)の必須の活性化因子であり、尿素回路の初期段階でCPS1を活性化します。この活性化はアンモニアの排出と毒性制御に重要です。
- 他の選択肢の誤り理由:
- Citrulline: シトルリンは尿素回路の中間産物ですが、CPS1の活性化には関与しません。
- Argininosuccinate: アルギニノコハク酸も中間産物であり、活性化因子ではありません。
- Carbamoyl phosphate: カルバモイルリン酸は生成物であり、活性化因子ではありません。
Question 31
問題文: What is the rate-limiting step of urea metabolism?
a. Arginase
b. Ornithine transcarbamoylase
c. Glutaminase
d. Carbamoyl phosphate synthetase 1
Answer: d. Carbamoyl phosphate synthetase 1
解説:
- **Carbamoyl phosphate synthetase 1 (CPS1)**は尿素回路の律速段階であり、アンモニアの取り込みと尿素生成を調整します。この酵素の活性化にはN-アセチルグルタミン酸が必要であり、尿素回路の主要な制御ポイントです。
Question 32
問題文: In which part of the cell does post-translational modification of preprocollagen occur?
a. Cytosol
b. Endoplasmic reticulum
c. Nucleus
d. Mitochondria
Answer: b. Endoplasmic reticulum
解説:
- **Endoplasmic reticulum (ER)**は、プレプロコラーゲンの翻訳後修飾が行われる場所です。ここで、ヒドロキシ化やグリコシル化などの修飾が行われ、安定なコラーゲン分子が形成されます。
Endoplasmic reticulum (ER)(内因性細胞質網)は、細胞内で多くの重要な生理的過程が行われる場所で、特にタンパク質の翻訳後修飾において重要な役割を果たします。コラーゲン合成においても、ERは重要な修飾の場となります。
プレプロコラーゲンの翻訳後修飾
- **プレプロコラーゲン(Preprocollagen)**は、コラーゲンの前駆体として細胞の核内で合成され、その後細胞質内に移動します。プレプロコラーゲンは、プロコラーゲンという前駆体に変換されるために、ERに輸送されます。
- ER内での翻訳後修飾
ERは、プレプロコラーゲンが修飾される場所です。ここでは以下のような重要な翻訳後修飾が行われます。- ヒドロキシ化(Hydroxylation)
プレプロコラーゲンのプロリン(Proline)およびリジン(Lysine)残基は、ヒドロキシラーゼという酵素によってヒドロキシル化されます。この修飾により、コラーゲンの三重らせん構造が安定化し、コラーゲンの強度や機能が向上します。特に、プロリンのヒドロキシ化は、後の三重らせん形成に必要不可欠です。 - グリコシル化(Glycosylation)
コラーゲンの一部のリジン残基やヒドロキシリジン残基に、糖分子が結合するグリコシル化反応が行われます。このグリコシル化は、コラーゲン分子の安定性や、細胞外での機能に重要です。
- ヒドロキシ化(Hydroxylation)
- ER内での折りたたみと品質管理
ER内で、プレプロコラーゲンは適切に折りたたまれ、最終的な三重らせん構造を形成します。この過程には、分子シャペロンが関与し、誤って折りたたまれたタンパク質が修正されるか、細胞外に輸送される前に除去されます。 - コラーゲンの輸送
翻訳後修飾を受けて、安定したプロコラーゲン分子は、ゴルジ体を経て細胞外に分泌され、そこで最終的に成熟したコラーゲンとして機能します。
Question 33
問題文: Negative nitrogen balance occurs when:
a. There is an excess of ingested nitrogen over excreted nitrogen
b. There is an excess of excreted nitrogen over ingested nitrogen
c. There is a balance between excretion and ingestion of nitrogen
Answer: b. There is an excess of excreted nitrogen over ingested nitrogen
解説:
- Negative nitrogen balanceは、排泄される窒素が摂取される窒素を上回る状態を指し、通常は飢餓や疾患時に見られます。体内でのタンパク質の分解が増加し、筋肉量が減少する傾向があります。
Question 34
問題文: What is an important precursor of γ-aminobutyric acid (GABA)?
a. Glutamine
b. Glutathione
c. Glutamate
d. Glycine
Answer: c. Glutamate
解説:
- GlutamateはGABAの直接の前駆体であり、神経系において抑制性の神経伝達物質であるGABAに変換されます。この変換はグルタミン酸脱炭酸酵素により行われます。
Question 35
問題文: Which amino acid contributes to the fibrous structure of collagen and interrupts α-helices in globular proteins?
a. Isoleucine
b. Glycine
c. Proline
d. Valine
Answer: c. Proline
解説:
- Prolineはコラーゲンの繊維構造に寄与し、ポリペプチド鎖のαヘリックス構造を中断させる役割を持ちます。プロリンの独特の環状構造により、タンパク質の三次元構造において屈曲が生じ、コラーゲンの強度と柔軟性を生み出します。
Question 36
問題文: What is the important function of prolyl hydroxylase and lysyl hydroxylase in collagen synthesis?
a. Post-translational modification of peptidyl prolyl and peptidyl lysyl residues
b. Hydroxylation of peptidyl prolyl and peptidyl lysyl residues
c. Oxidation of proline and lysine peptides
d. Reduction of peptide residues of proline and lysine
Answer: b. Hydroxylation of peptidyl prolyl and peptidyl lysyl residues
解説:
- Prolyl hydroxylaseとlysyl hydroxylaseは、コラーゲン合成の過程でペプチドのプロリンおよびリシン残基のヒドロキシ化を行います。この修飾によりコラーゲンの安定性が高まり、適切な繊維構造が形成されます。


コメント