Contents
- 1 概要(OUTLINE)
- 2 安静時および活動時の心拍出量の正常値(NORMAL VALUES FOR CARDIAC OUTPUT AT REST AND DURING ACTIVITY)
- 3 静脈還流による心拍出量の制御—心のフランク-スターリングの法則(CONTROL OF CARDIAC OUTPUT BY VENOUS RETURN—FRANK-STARLING MECHANISM OF THE HEART)
- 3.1 心拍出量はすべての組織血流の合計です—組織の代謝がほとんどの局所血流を制御します(Cardiac Output Is the Sum of All Tissue Blood Flows—Tissue Metabolism Regulates Most Local Blood Flow)
- 3.2 心拍出量は全周辺抵抗と逆に変化する、動脈圧が変わらない場合(Cardiac Output Varies Inversely With Total Peripheral Resistance When Arterial Pressure Is Unchanged)
- 3.3 心拍出量の限界(Limits for the Cardiac Output)
- 3.4 高効率心臓の原因となる要因(Factors That Cause a Hypereffective Heart)
- 3.5 心臓の低効率の原因となる要因(Factors That Cause a Hypoeffective Heart)
- 4 心臓出力の神経系調節(NERVOUS SYSTEM REGULATION OF CARDIAC OUTPUT)
- 5 心拍出量曲線を用いた心拍出量調節の定量分析(CARDIAC OUTPUT CURVES USED IN QUANTITATIVE ANALYSIS OF CARDIAC OUTPUT REGULATION)
- 6 静脈還流曲線(VENOUS RETURN CURVES)
- 6.1 通常の静脈還流曲線(Normal Venous Return Curve)
- 6.2 大静脈の崩壊による負の心房圧で静脈還流曲線のプラトー(Plateau in Venous Return Curve at Negative Atrial Pressures Caused by Collapse of the Large Veins)
- 6.3 平均循環充填圧と平均全身充填圧 — 静脈還流への影響(Mean Circulatory Filling Pressure, Mean Systemic Filling Pressure — Effects on Venous Return)
- 6.4 平均全身充填圧と平均循環充填圧との関係(Mean Systemic Filling Pressure and Relationship to Mean Circulatory Filling Pressure)
- 6.5 平均全身充填圧の変化が静脈還流曲線に与える影響(Effect on Venous Return Curve of Changes in Mean Systemic Filling Pressure)Psf(systemic filling pressure )
- 6.6 静脈還流の圧力勾配がゼロの場合、静脈還流は存在しない(When Pressure Gradient for Venous Return Is Zero There Is No Venous Return)
- 6.7 静脈還流への抵抗(Resistance to Venous Return)
- 6.8 静脈還流への抵抗が静脈還流曲線に与える影響(Effect of Resistance to Venous Return on the Venous Return Curve)
- 6.9 静脈還流曲線パターンの組み合わせ(Combinations of Venous Return Curve Patterns)
- 7 心拍出量と右心房圧の同時分析(ANALYSIS OF CARDIAC OUTPUT AND RIGHT ATRIAL PRESSURE BY SIMULTANEOUS CARDIAC OUTPUT AND VENOUS RETURN CURVES)
- 7.1 血液量の増加が心拍出量に与える影響(Effect of Increased Blood Volume on Cardiac Output)
- 7.2 血液量の増加に対する補償効果(Compensatory Effects Initiated in Response to Increased Blood Volume)
- 7.3 交感神経刺激が心拍出量に与える影響(Effect of Sympathetic Stimulation on Cardiac Output)
- 7.4 交感神経の抑制が心拍出量に与える影響(Effect of Sympathetic Inhibition on Cardiac Output)
- 7.5 大動静脈瘻(Arteriovenous Fistula)の開放が心拍出量に与える影響(Effect of Opening a Large Arteriovenous Fistula)
- 7.6 心拍出量調整のその他の分析
- 8 心拍出量測定方法(METHODS FOR MEASURING CARDIAC OUTPUT)
概要(OUTLINE)
Learning Objectives
- Define cardiac output, venous return, cardiac index, Frank-Starling Law of the heart
- Describe the effect of total peripheral resistance to long-term cardiac output
- Explain Cardiac Output & Venous Return
Curves - Name factors that can cause a hypereffective or hypoeffective heart
- Enumerate conditions that can cause an abnormally high or low cardiac output
- Describe the effect of changes in external cardiac pressure on the cardiac output curve
- Describe the factors that affect venous return to the heart from the systemic circulation
心拍出量(Cardiac output)は、心臓(heart)によって毎分大動脈(aorta)に送り出される血液の量です。これはまた、循環(circulation)する血液の量でもあります。心拍出量は体の全組織(tissues)への血流(blood flow)の合計であるため、心血管系(cardiovascular system)の機能に関連して考慮する最も重要な要素の一つです。 静脈還流(Venous return)も同様に重要です。これは毎分静脈(veins)から右心房(right atrium)に流れる血液の量を指します。静脈還流と心拍出量は、心臓(heart)と肺(lungs)に血液が一時的に蓄えられたり取り除かれたりする数回の心拍(heartbeats)を除いて、等しくなければなりません。
安静時および活動時の心拍出量の正常値(NORMAL VALUES FOR CARDIAC OUTPUT AT REST AND DURING ACTIVITY)
心拍出量は体の活動レベルによって大きく変動します。以下の要因が心拍出量に直接影響を与えます:
(1) 体の基本的な代謝レベル(basic level of body metabolism);
(2) 運動中かどうか(exercising);
(3) 人の年齢(age);
(4) 体のサイズ(size of the body)。
若い健康な男性では、安静時の心拍出量は平均約5.6 L/分です。女性の場合、この値は約4.9 L/分です。また、年齢を考慮すると、年齢とともに体の活動や一部の組織(例えば、骨格筋(skeletal muscle))の質量が減少するため、安静時成人の平均心拍出量は一般的に約5 L/分とされています。しかし、健康な男女間で心拍出量は、筋肉量(muscle mass)、脂肪性(adiposity)、身体活動(physical activity)、代謝率(metabolic rate)と栄養需要(nutritional needs)に影響を与えるその他の要因によってかなり異なります。
心拍指数(Cardiac Index)
実験により、心拍出量は体表面積(surface area of the body)にほぼ比例して増加することが示されています。したがって、心拍出量はしばしば心拍指数という項目で表されます。これは、体表面積1平方メートルあたりの心拍出量です。70キログラムの体重の平均的な人は、約1.7平方メートルの体表面積を持っているため、成人の正常平均心拍指数は約3 L/分/m²です。
心拍出量の年齢による影響(Effect of Age on Cardiac Output)
図20-1に示されているように、心拍出量(心拍指数として表現)は異なる年齢での変化を示します。心拍指数は10歳で4 L/分/m²を超えるレベルまで急速に上昇し、80歳で約2.4 L/分/m²まで減少します。後ほどこの章で説明するように、心拍出量は生涯にわたってほぼ全体的な代謝活動(overall metabolic activity)に直接比例して調節されます。したがって、減少する心拍指数は、年齢とともに活動が減少することや筋肉量が減少することを示しています。
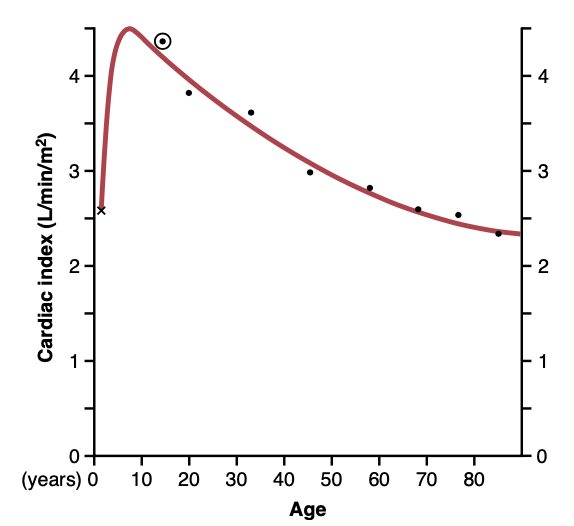
Figure 20-1. Cardiac index for a person—cardiac output per square meter of surface area—at different ages. (Modified from Guyton AC, Jones CE, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
静脈還流による心拍出量の制御—心のフランク-スターリングの法則(CONTROL OF CARDIAC OUTPUT BY VENOUS RETURN—FRANK-STARLING MECHANISM OF THE HEART)
心臓の機能は心拍出量を決定する上で明らかに重要ですが、静脈(veins)から心臓(heart)への血流、つまり静脈還流(Venous return)を影響する周辺循環(peripheral circulation)の様々な要因が通常、心拍出量の主なコントローラーです。 周辺要因が心拍出量を制御する主な理由は、心臓には通常、静脈から右心房(right atrium)に流れる血液の量を自動的にポンプする内蔵メカニズムがあるからです。このメカニズムは、心のフランク-スターリングの法則(Frank-Starling law of the heart)と呼ばれ、第9章で議論されました。基本的に、この法則は心臓への血流が増加すると、血液の増加した容量が心室(heart chambers)の壁を伸ばし、その結果、心筋(cardiac muscle)は増強した力で収縮し、体系循環(systemic circulation)から入ってきた余分な血液を排出すると述べています。したがって、心臓に流れ込む血液は自動的に遅延なく大動脈(aorta)にポンプされ、再び循環(circulation)を通じて流れます。
心拍出量はすべての組織血流の合計です—組織の代謝がほとんどの局所血流を制御します(Cardiac Output Is the Sum of All Tissue Blood Flows—Tissue Metabolism Regulates Most Local Blood Flow)
心への静脈還流(venous return to the heart)は、周辺循環(peripheral circulation)のすべての個々の組織セグメントを通るすべての局所血流(local blood flow)の合計です(図20-2)。したがって、通常、心拍出量の調整はすべての局所血流の調整の合計であるということになります。 局所血流の調整のメカニズムは第17章で議論されました。ほとんどの組織では、血流は主に各組織の代謝(metabolism)に比例して増加します。例えば、局所血流はほぼ常に組織の酸素消費(oxygen consumption)が増加するときに増加します。この効果は図20-3で運動の異なるレベルで示されています。運動中の各増加する作業レベルで、酸素消費と心拍出量は互いに並行して増加します。
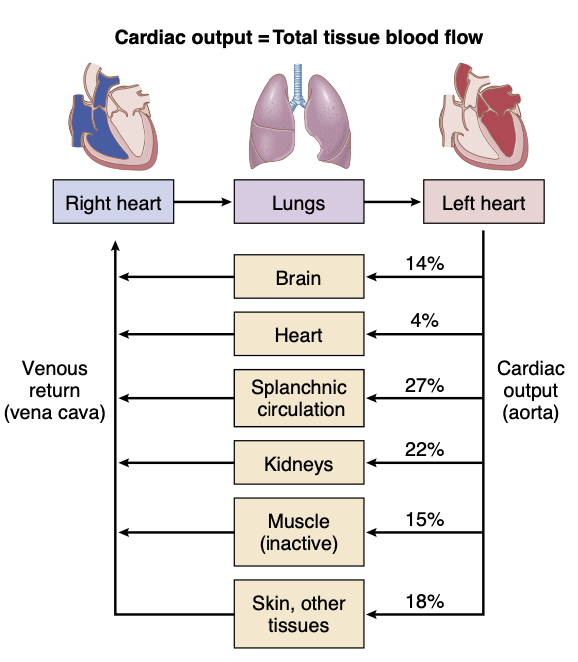
Figure 20-2. Cardiac output is equal to venous return and is the sum of tissue and organ blood flows. Except when the heart is severely weakened and unable to pump the venous return adequately, cardiac output (total tissue blood flow) is determined mainly by the metabolic needs of the tissues and organs of the body.
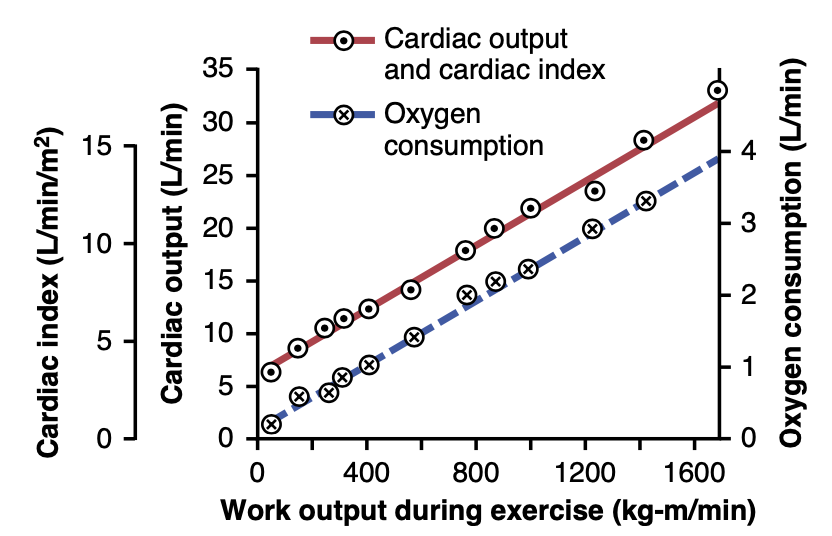
Figure 20-3. Effect of increasing levels of exercise to increase car- diac output (red solid line) and oxygen consumption (blue dashed line). (Modified from Guyton AC, Jones CE, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
心拍出量は全周辺抵抗と逆に変化する、動脈圧が変わらない場合(Cardiac Output Varies Inversely With Total Peripheral Resistance When Arterial Pressure Is Unchanged)
図20-3は図19-5と同じで、心拍出量制御の非常に重要な原則を示すためにここで再度掲載されています。多くの状況下で、長期的な心拍出量レベルは全周辺血管抵抗(total peripheral vascular resistance)の変化と逆に変動しますが、動脈圧(arterial pressure)が変わらない限りです。図20-4に示すように、全周辺抵抗が正常値(100%マーク)のときには、心拍出量も正常です。その後、全周辺抵抗が正常よりも増加すると心拍出量は減少し、逆に全周辺抵抗が減少すると心拍出量は増加します。この現象は、オームの法則(Ohm’s law)の一形態を再考することで簡単に理解できます。これは第14章で表現されました。
心拍出量(Cardiac output) = 動脈圧(Arterial pressure) / 全周辺抵抗(Total peripheral resistance)
したがって、全周辺抵抗(total peripheral resistance)の長期的なレベルが変化する時(しかし循環の他の機能は変わらない時)、心拍出量(cardiac output)は量的に正反対の方向に変化します。
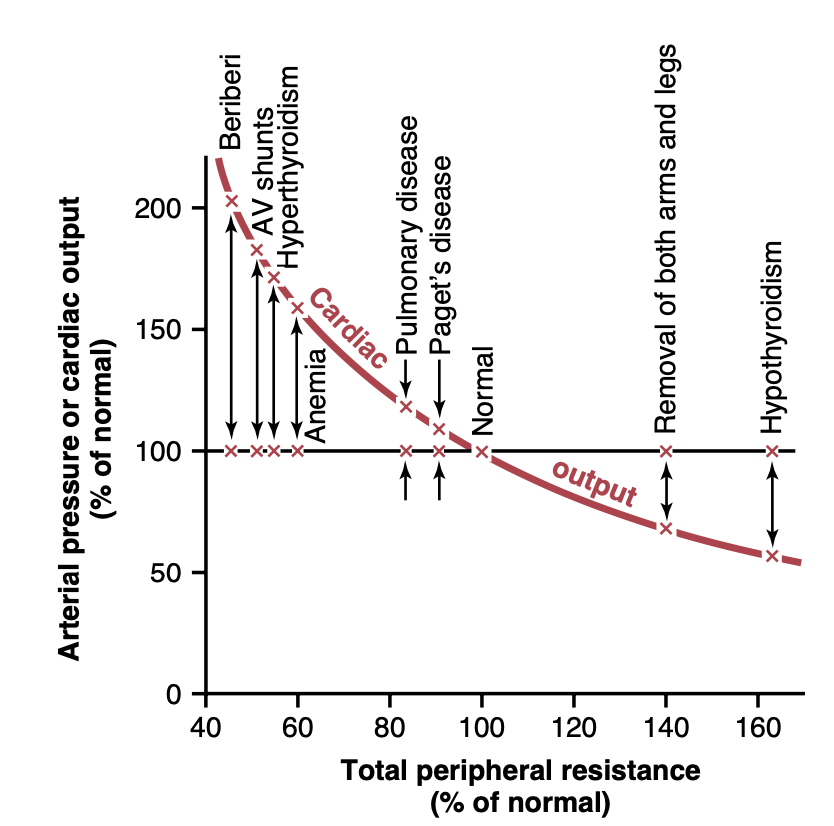
Figure 20-4. Chronic effect of different levels of total peripheral resistance on cardiac output, showing a reciprocal relationship be- tween total peripheral resistance and cardiac output. AV, Atrioven- tricular. (Modified from Guyton AC: Arterial Pressure and Hyperten- sion. Philadelphia: WB Saunders, 1980.)
心拍出量の限界(Limits for the Cardiac Output)
心がポンプできる血液の量には明確な限界があり、これは心拍出量曲線(cardiac output curves)として定量的に表現されます。 図20-5は通常の心拍出量曲線を示しており、各右心房圧(right atrial pressure)レベルでの分ごとの心拍出量を示しています。これは第9章で議論された心機能曲線(cardiac function curve)の一種です。この通常の心拍出量曲線のプラトー(plateau)レベルは約13 L/分で、通常の心拍出量の約2.5倍です。これは、特別な刺激なしで正常に機能する人間の心が、通常の静脈還流の約2.5倍までポンプできることを意味します。 図20-5には、通常通りポンプしていない心臓のいくつかの他の心拍出量曲線も示されています。最上部の曲線は、通常よりもよくポンプしている高効率(hypereffective)心臓用です。最下部の曲線は、通常以下のレベルでポンプしている低効率(hypoeffective)心臓用です。
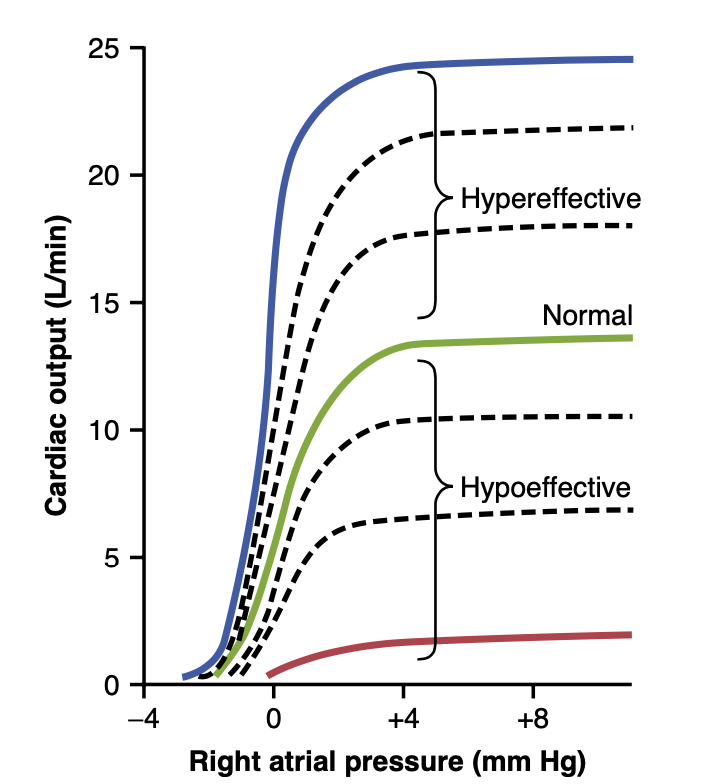
Figure 20-5. Cardiac output curves for the normal heart and for hypoeffective and hypereffective hearts. (Modified from Guyton AC, Jones CE, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
高効率心臓の原因となる要因(Factors That Cause a Hypereffective Heart)
心臓を通常よりも強力なポンプにすることができる一般的な2つの要因は、神経刺激(nervous stimulation)と心筋肥大(hypertrophy of the heart muscle)です。
神経興奮が心臓のポンプ能力を増加させる(Nervous Excitation Can Increase Heart Pumping) 第9章で見たように、交感神経の刺激(sympathetic stimulation)と副交感神経の抑制(parasympathetic inhibition)の組み合わせは、心臓のポンプ効率を2つの方法で高めます:
(1) 心拍数(heart rate)を大幅に増加させる—若い人では通常の72拍/分から180〜200拍/分まで増加することがあります—そして、
(2) 心収縮力(increased contractility)を通常の2倍に増加させます。これら2つの効果を組み合わせることで、最大の神経刺激は心拍出量曲線のプラトーを通常の曲線のほぼ2倍にすることができます。これは図20-5で示された上部の25 L/分の曲線レベルによって示されます。
心筋肥大がポンプ効率を高める(Heart Hypertrophy Can Increase Pumping Effectiveness) 長期間にわたる増加した負荷(increased workload)は、心にダメージを与えるほどの過負荷ではないにもかかわらず、心筋を増量し収縮力を増加させる原因となります。これは重い運動が骨格筋(skeletal muscles)の肥大を引き起こすのと同じ方式です。例えば、マラソンランナーの心臓は50%から75%増量されることがあります。この要因は、心拍出量曲線のプラトーを時には60%から100%増加させ、したがって心臓に通常よりも多くの心拍出量をポンプさせることができます。 心臓の神経興奮と肥大が組み合わされると、マラソンランナーの場合のように、心臓は平均人の2.5倍に達する30〜40 L/分までポンプすることが可能になります。この増加したポンプレベルは、ランナーの走行時間を決定する最も重要な要因の一つです。
心臓の低効率の原因となる要因(Factors That Cause a Hypoeffective Heart)
心臓のポンプ能力が低下することを引き起こす要因は、心臓の低効率(hypoeffectivity)を引き起こします。心臓のポンプ能力を低下させる要因には、次のものがあります:
- 心臓がポンプしなければならない増加した動脈圧(increased arterial pressure)に対抗する、重度の高血圧(severe hypertension)など
- 心臓の神経興奮(nervous excitation of the heart)の抑制
- 異常な心リズムや心拍数(abnormal heart rhythm or rate of heartbeat)を引き起こす病理学的要因(pathological factors)
- 冠動脈の閉塞(coronary artery blockage)による心筋梗塞(heart attack)
- 弁膜症(valvular heart disease)
- 先天性心疾患(congenital heart disease)
- 心筋炎(myocarditis)、心筋の炎症
- 心臓の低酸素症(cardiac hypoxia)
これらの要因は、心臓が血液を効果的にポンプする能力を低下させ、結果として心拍出量が減少します。
心臓出力の神経系調節(NERVOUS SYSTEM REGULATION OF CARDIAC OUTPUT)
周辺血管が拡張されて静脈還流と心拍出量が増加する際、動脈圧を維持するために神経系の重要性。図20-6は、機能する自律神経系がある場合とない場合の心拍出量制御の重要な違いを示しています。実線の曲線は、全身のほぼすべての組織の代謝を約4倍に増加させる薬物ディニトロフェノールを投与することによって引き起こされる周辺血管の激しい拡張の効果を正常な犬で示しています。神経制御メカニズムが損なわれずにすべての周辺血管が拡張されると、動脈圧にほとんど変化はなく、心拍出量はほぼ4倍に増加しました。しかし、神経系の自律制御がブロックされた後、ディニトロフェノールによる血管の拡張(点線の曲線)は、動脈圧を正常の約半分にまで大幅に低下させ、心拍出量は4倍ではなく1.6倍の増加にとどまりました。 したがって、第18章で説明されているメカニズムにより、神経系反射による正常な動脈圧の維持は、周辺組織が血管を拡張して静脈還流を増加させるときに高い心拍出量を達成するために不可欠です。
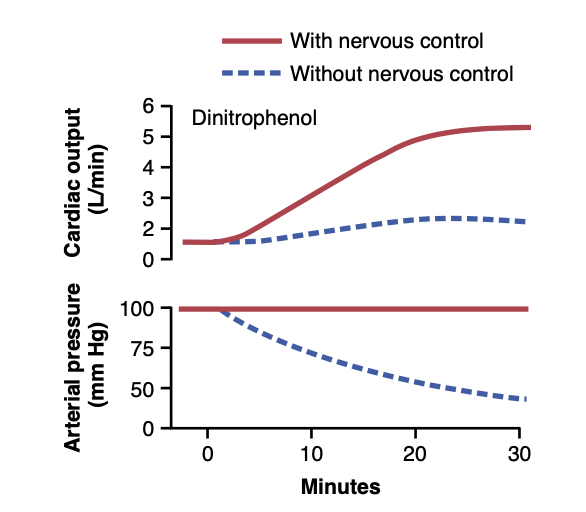
Figure 20-6. Experiment in a dog to demonstrate the importance of nervous maintenance of the arterial pressure as a prerequisite for cardiac output control. Note that with pressure control, the meta- bolic stimulant dinitrophenol increased cardiac output greatly; with- out pressure control, the arterial pressure fell, and the cardiac output increased very little. (Drawn from experiments by Dr. M. Banet.)
運動中の動脈圧を増加させるための神経系の効果(Effect of Nervous System to Increase Arterial Pressure During Exercise)
運動中、活動的な骨格筋の代謝が激しく増加すると、筋動脈細動脈(muscle arterioles)がリラックスし、筋収縮を維持するために必要な十分な酸素とその他の栄養素が供給されます。これにより全周辺抵抗が大幅に減少し、通常は動脈圧も低下します。しかし、神経系がすぐに補償します。筋肉への運動信号を送るのと同時に、脳の自律神経中枢に循環活動を刺激する信号を送り、大静脈の収縮、心拍数の増加、心の収縮力の増加を引き起こします。これらの変化が一緒に作用することで、動脈圧を正常以上に上げ、さらに多くの血液を活動筋に流し込むことを促します。 要約すると、局所組織の血管が拡張して静脈還流と心拍出量が正常よりも増加する場合、神経系は動脈圧が致命的に低いレベルに落ちるのを防ぐために重要な役割を果たします。運動中には、神経系がさらに進んで追加の信号を提供し、動脈圧を正常よりも上げ、それによって心拍出量を追加で30%から100%増加させます。
病理的に高いまたは低い心拍出量(Pathologically High or Low Cardiac Outputs)
複数の臨床異常が高いまたは低い心拍出量を引き起こす可能性があります。これらの異常な心拍出量のいくつかを図20-7で示しています。
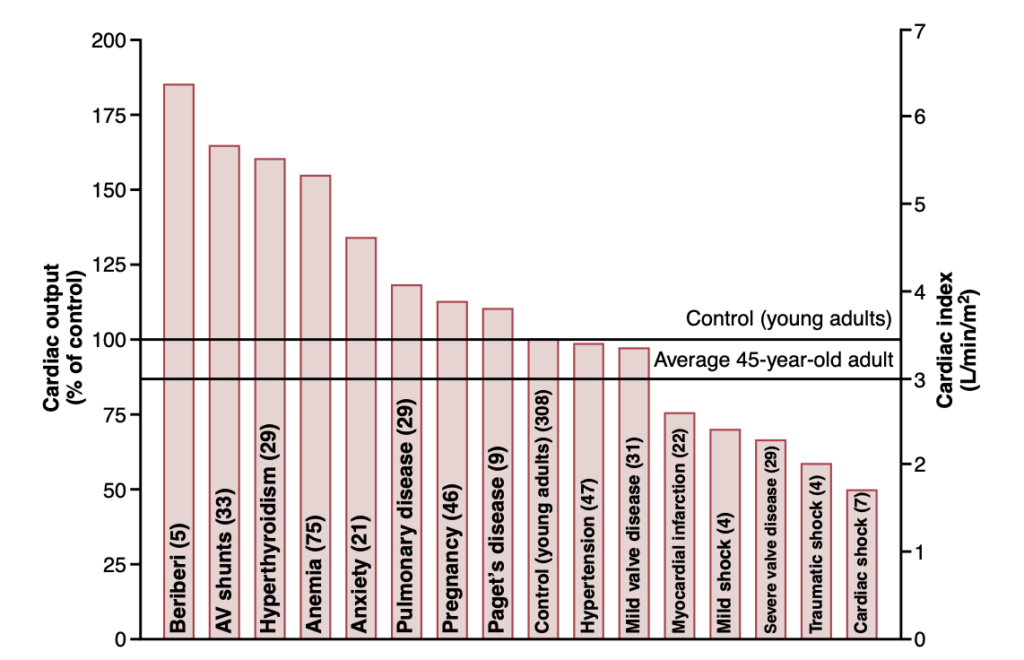
Figure 20-7. Cardiac output in different pathological conditions. The numbers in parentheses indicate the number of patients studied in each condition. AV, Atrioventricular. (Modified from Guyton AC, Jones CE, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
高い心拍出量が引き起こされる状態(High Cardiac Output Caused by Reduced Total Peripheral Resistance)
図20-7の左側は異常に高い心拍出量を引き起こす状態を特定しています。これらの状態の特徴的な要素の一つは、すべてが慢性的に低下した全周辺抵抗から生じることです。いずれも心自体の過度の興奮から生じるわけではありません。周辺抵抗が減少し、同時に心拍出量を正常以上に増加させる状態をいくつか考慮しましょう。
- 脚気(Beriberi)。この病気は、食事中のビタミンB1(thiamine)の不足によって引き起こされます。このビタミンの不足は、組織が一部の細胞内栄養素を利用する能力を低下させ、局所組織の血流制御メカニズムが顕著な補償性末梢血管拡張を引き起こします。時には全周辺抵抗が正常の半分まで減少することがあります。その結果、長期的な静脈還流と心拍出量も正常の2倍に増加することがあります。
- 动静脉瘘(AV fistula)。以前、主要な動脈と静脈の間に瘘(またはAVシャントとも呼ばれます)が発生すると、大量の血液が直接動脈から静脈に流れることを指摘しました。これにより全周辺抵抗が大幅に減少し、同様に静脈還流と心拍出量が増加します。
- 甲状腺機能亢進症(Hyperthyroidism)。甲状腺機能亢進症では、体のほとんどの組織の代謝が大幅に増加します。酸素使用が増加し、組織から血管拡張物質が放出されます。したがって、全周辺抵抗は体全体の局所組織血流制御反応により顕著に減少し、結果として静脈還流と心拍出量はしばしば正常の40%から80%以上に増加します。
- 貧血(Anemia)。貧血では、末梢抵抗を大幅に減少させる2つの効果があります。これらの効果の一つは、赤血球の濃度が減少することによる血液の粘度の低下です。もう一つの効果は、組織への酸素の供給が減少することによる局所血管の拡張です。その結果、心拍出量は大幅に増加します。 他の要因でも、動脈圧があまり低下しない限り、全周辺抵抗を慢性的に減少させると心拍出量も増加します。
低い心拍出量(Low Cardiac Output)
図20-7の右端には、異常に低い心拍出量を引き起こすいくつかの状態が示されています。これらの状態は2つのカテゴリに分けられます:
(1) 心のポンプ効率を低下させる異常;及び
(2) 静脈還流を減少させるもの。
心臓因子による心拍出量の減少。 心臓が深刻な損傷を受けると、その原因に関係なく、そのポンプレベルが組織への適切な血流に必要なレベル以下に低下する場合があります。この状態のいくつかの例には次のものが含まれます:
(1) 重度の冠状血管閉塞とそれに続く心筋梗塞;
(2) 重度の弁膜症;
(3) 心筋炎;
(4) 心タンポナーデ;及び
(5) 心代謝異常。
これらのいくつかの状態の効果は図20-7の右側に示されており、その結果として生じる低い心拍出量を示しています。 心拍出量が低下して体全体の組織が栄養不足に陥ると、その状態は心臓ショックと呼ばれます。この状態は第22章で心不全との関係で議論されています。
非心臓周辺因子による心拍出量の減少—静脈還流の減少
静脈還流に干渉するものは何でも心拍出量の減少につながる可能性があります。これらの要因には以下のようなものがあります:
- 血液量の減少。最も一般的な非心臓周辺因子で、心拍出量の減少につながるのは血液量の減少で、しばしば出血によるものです。血液の喪失は血管系の充填を非常に低いレベルに減少させ、周辺血管に血液を心臓に押し戻すのに十分な末梢血管圧を作り出すことができなくなります。
- 急性静脈拡張。急性静脈拡張は、交感神経系が突然非活性化したときに最も頻繁に発生します。例えば、交感神経系の活動の突然の喪失によって、特に静脈などの周辺収容血管が顕著に拡張し、しばしば失神を引き起こします。この拡張は、血液量がもはや弛緩した周辺血管内で適切な圧力を作り出すことができなくなるため、血管系の充填圧を低下させます。その結果、血液は血管内に滞留し、通常よりも速く心臓に戻ることはありません。
- 大静脈の閉塞。稀に、心臓に通じる大静脈が閉塞し、周辺血管の血液が心臓に戻ることができなくなります。その結果、心拍出量は著しく低下します。
- 組織質量の減少、特に骨格筋質量の減少。正常な老化や長期間の身体活動の欠如により、通常、骨格筋のサイズが減少します。この減少は、筋肉の全酸素消費量と血流需要を減少させ、骨格筋の血流と心拍出量を低下させます。
- 組織の代謝率の低下。組織の代謝率が低下すると、例えば長期間の臥床中の骨格筋で発生するように、組織の酸素消費量と栄養需要も低下し、組織への血流が減少し、心拍出量が低下します。低甲状腺機能症(hypothyroidism)など他の状態も代謝率を低下させ、それによって組織の血流と心拍出量を減少させることがあります。 低い心拍出量の原因が末梢因子であれ心臓因子であれ、心拍出量が組織の適切な栄養に必要なレベル以下に低下すると、その人は循環ショックを経験していると言われます。この状態は数分から数時間で致命的になる可能性があります。循環ショックは非常に重要な臨床問題であり、第24章で詳細に議論されています。
心拍出量曲線を用いた心拍出量調節の定量分析(CARDIAC OUTPUT CURVES USED IN QUANTITATIVE ANALYSIS OF CARDIAC OUTPUT REGULATION)
これまでの心拍出量(Cardiac Output)調節の議論は、ほとんどの単純な条件で心拍出量を制御する要因を理解するために十分です。しかし、運動の極端な状態、心不全(cardiac failure)、循環ショック(circulatory shock)など、特にストレスの多い状況での心拍出量調節を理解するためには、より複雑な定量分析を以下のセクションで提示します。 より定量的な分析を行うためには、心拍出量調節に関連する2つの主要な要因を別々に区別する必要があります:(1) 心拍出量曲線(cardiac output curves)によって表される心臓(heart)のポンピング能力;及び (2) 静脈還流曲線(venous return curves)によって表される心臓への血液の流れに影響を与える末梢要因(peripheral factors)。それから、これらの曲線を定量的な方法で組み合わせて、同時に心拍出量、静脈還流(venous return)、及び右心房圧(right atrial pressure)をどのように決定するかを示すことができます。 心のポンピング効率を表すために使用されるいくつかの心拍出量曲線はすでに図20-5で示されています。しかし、次のセクションで説明される心臓の外側の外部圧力が心拍出量に与える影響を示すために、追加の曲線セットが必要です。
心臓の外側の外部圧力が心拍出量曲線に及ぼす影響(Effect of External Pressure Outside the Heart on Cardiac Output Curves)
図20-8は、外部心臓圧(external cardiac pressure)の変化が心拍出量曲線に与える影響を示しています。通常の外部圧力は通常の胸膜内圧(normal intrapleural pressure、胸腔内の圧力)に等しく、約−4 mm Hgです。図中で胸膜内圧が−2 mm Hgに上昇すると、心拍出量曲線が同じ量だけ右にシフトすることに注意してください。このシフトは、心臓の外側の圧力が増加したため、心房(cardiac chambers)に血液を充填するのに追加の2 mm Hgの右心房圧(right atrial pressure)が必要になるために起こります。同様に、胸膜内圧が+2 mm Hgに増加すると、通常の−4 mm Hgから右心房圧が6 mm Hg増加する必要があり、心拍出量曲線全体が右に6 mm Hgシフトします。 心臓にかかる外部圧力を変更し、心拍出量曲線をシフトする可能性のあるいくつかの要因は次のとおりです:
- 呼吸中の胸膜内圧(intrapleural pressure)の周期的変化は、通常の呼吸では約±2 mm Hgですが、激しい呼吸中には±50 mm Hgに達することがあります。
- 負圧(negative pressure)に対して呼吸すると、曲線がより負の右心房圧(negative right atrial pressure)へとシフトします(左へ)。
- 正圧呼吸(positive-pressure breathing)は、曲線を右へシフトします。
- 胸腔(thoracic cage)を開くと、胸膜内圧を0 mm Hgに増加させ、心拍出量曲線を4 mm Hg右にシフトします。
- 心タンポナーデ(cardiac tamponade)は、心臓の周囲の心膜腔(pericardial cavity)に大量の液体が蓄積し、外部心臓圧(external cardiac pressure)が増加し、曲線が右にシフトすることを意味します。 図20-8に示されているように、心タンポナーデは、心房の腔(chambers of the heart)が心拍出量の高い状態で増加した容量に達するとき、外部タンポナーデ圧(external tamponade pressure)が高い値に達するため、曲線の上部を下部よりもさらに右にシフトさせます。
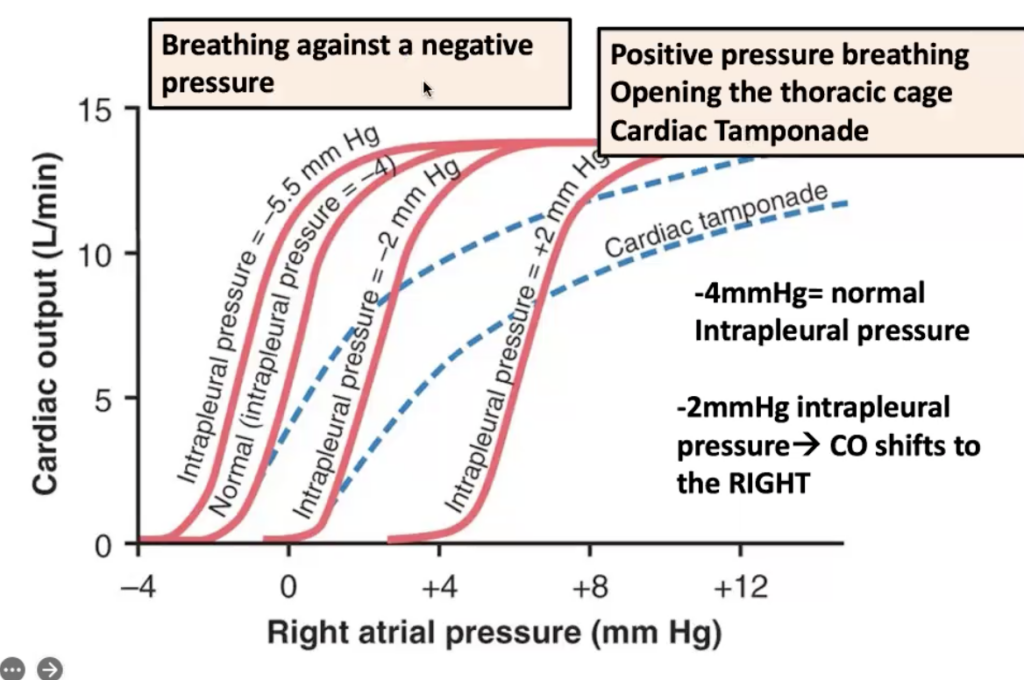
Figure 20-8. Cardiac output curves at different levels of intrapleural pressure and different degrees of cardiac tamponade. (Modified from Guyton AC, Jones CE, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
心拍出量曲線の異なるパターンの組み合わせ(Combinations of Different Patterns of Cardiac Output Curves)
図20-9は、次の同時変化の結果として最終的な心拍出量曲線が変化することを示しています:
(1) 外部心臓圧(external cardiac pressure);及び
(2) ポンプとしての心臓(heart as a pump)の効果。
たとえば、過剰効率的な心臓(hypereffective heart)と増加した胸膜内圧(increased intrapleural pressure)の組み合わせは、心臓の増加したポンピング能力(pumping capability)により最大心拍出量レベルを増加させますが、増加した胸膜内圧のために心拍出量曲線は右に(高い心房圧へ)シフトします。したがって、外部圧力とポンプとしての心臓の能力が何をしているのかを知ることにより、一つの心拍出量曲線によって心臓の瞬間的な血液ポンプ能力を表現することができます。
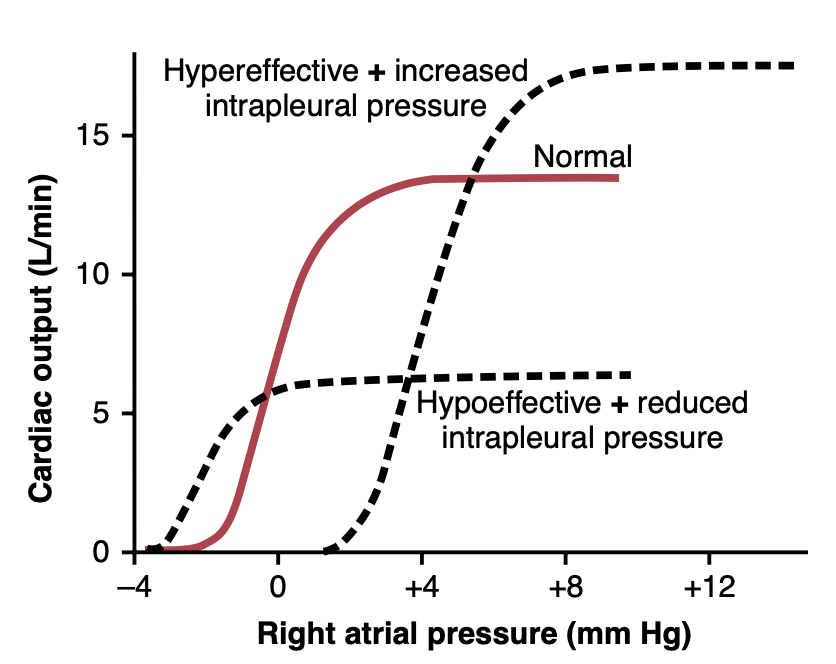
Figure 20-9. Combinations of two major patterns of cardiac output curves showing the effect of alterations in both extracardiac pressure and effectiveness of the heart as a pump. (Modified from Guyton AC, Jones CE, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
静脈還流曲線(VENOUS RETURN CURVES)
心臓調節の完全な分析を達成する前に、全身循環(systemic circulation)全体を考慮する必要があります。全身循環の機能を実験的に分析するため、動物の循環から心臓と肺を取り除き、ポンプと人工酸素供給器(artificial oxygenator)システムで置き換えました。その後、血液量(blood volume)、血管抵抗(vascular resistances)、及び右心房(right atrium)の中心静脈圧(central venous pressure)などの異なる要因を変更して、異なる循環状態での全身循環がどのように機能するかを決定しました。これらの研究から、全身循環から心臓への静脈還流(venous return)に影響を与える三つの主要な要因が見つかりました:
- 右心房圧(Right atrial pressure)は、静脈から右心房への血流を妨げる後方力を及ぼします。0mmHg。
- 全身循環の充填度(Degree of filling of the systemic circulation)、これは平均全身充填圧(mean systemic filling pressure)によって測定され、全身の血を心臓に押し出します(これは、血液の流れが停止したときに全身循環で測定される圧力です、後で詳しく説明します)。
- 周辺血管(peripheral vessels)と右心房との間の血流の抵抗(Resistance to blood flow)。
これらの要因はすべて、後のセクションで説明するように、静脈還流曲線(venous return curve)によって定量的に表現することができます。
通常の静脈還流曲線(Normal Venous Return Curve)
心拍出量曲線が心臓による血のポンプと右心房圧(right atrial pressure)との関係を示すのと同様に、静脈還流曲線は静脈還流を右心房圧と関連付けます。つまり、異なる右心房圧のレベルで全身循環から心臓に血が流れ込む静脈流(venous flow)です。 図20-10に示された曲線は、通常の静脈還流曲線です。この曲線は、心のポンピング能力が低下して右心房圧が上昇すると、上昇する心房圧が全身循環の静脈に後方力を及ぼし、心臓への静脈還流が減少することを示しています。すべての神経循環反射が作用することが防がれた場合、右心房圧が約+7 mm Hgに上昇すると静脈還流はゼロ(mean systemic filling pressure)に減少します。右心房圧のわずかな上昇が静脈還流の劇的な減少を引き起こすのは、背圧の増加が血を全身循環でダムアップさせ、心臓に戻ることを防ぐためです。
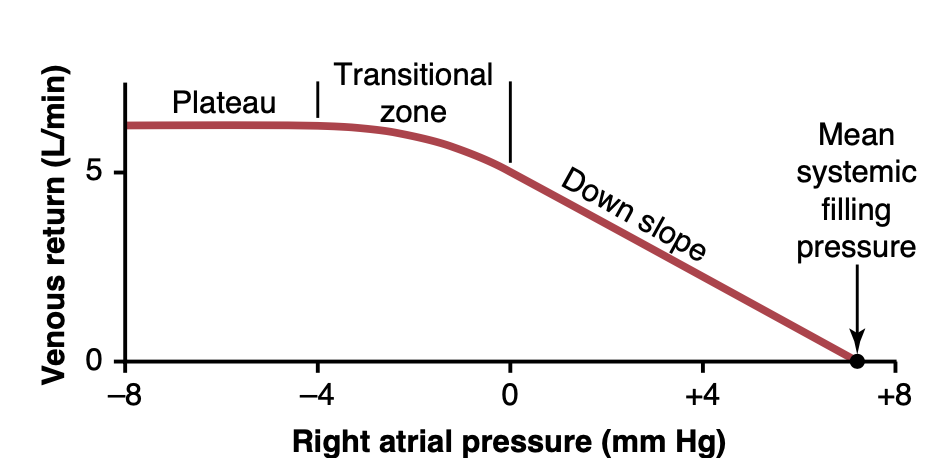
Figure 20-10. Normal venous return curve. The plateau is caused by collapse of the large veins entering the chest when the right atrial pressure falls below atmospheric pressure. Note also that venous re- turn becomes zero when the right atrial pressure rises to equal the mean systemic filling pressure.
大静脈の崩壊による負の心房圧で静脈還流曲線のプラトー(Plateau in Venous Return Curve at Negative Atrial Pressures Caused by Collapse of the Large Veins)
右心房圧がゼロ以下、つまり大気圧以下に下がると、静脈還流の増加はほぼ停止し、右心房圧が約−2 mm Hgに下がるころに静脈還流はプラトーに達します。右心房圧が−20 mm Hg、−50 mm Hg、あるいはそれ以上に下がっても、このプラトーのレベルは維持されます。このプラトーは、胸に入る静脈の崩壊によって引き起こされます。右心房の負圧が胸に入る静脈の壁を吸引し合わせるため、周辺静脈からの追加の血流が防がれます。その結果、右心房の非常に負の圧力でも、通常の心房圧0 mm Hgで存在するもの以上に静脈還流を顕著に増加させることはできません。
平均循環充填圧と平均全身充填圧 — 静脈還流への影響(Mean Circulatory Filling Pressure, Mean Systemic Filling Pressure — Effects on Venous Return)
心臓のポンピングが電気ショックによる心室細動で停止されたり、他の方法で停止されたりすると、循環内の血流は数秒後に停止します。血流がないと、循環内の圧力はどこも平等になります。この平衡状態の圧力レベルは平均循環充填圧(mean circulatory filling pressure)と呼ばれます。
血液量の増加による平均循環充填圧の上昇
循環内の血液量が多いほど、平均循環充填圧も高くなります。これは追加の血液量が血管の壁を伸ばすためです。図20-11の赤い曲線は、異なる血液量レベルが平均循環充填圧にどのように影響するかのおおよその通常効果を示しています。血液量が約4000 mlのとき、平均循環充填圧はゼロに近いですが、これは循環の非ストレス量ですが、血液量が5000 mlのとき、充填圧は通常値の7 mm Hgです。さらに高い血液量では、平均循環充填圧はほぼ線形に増加します。
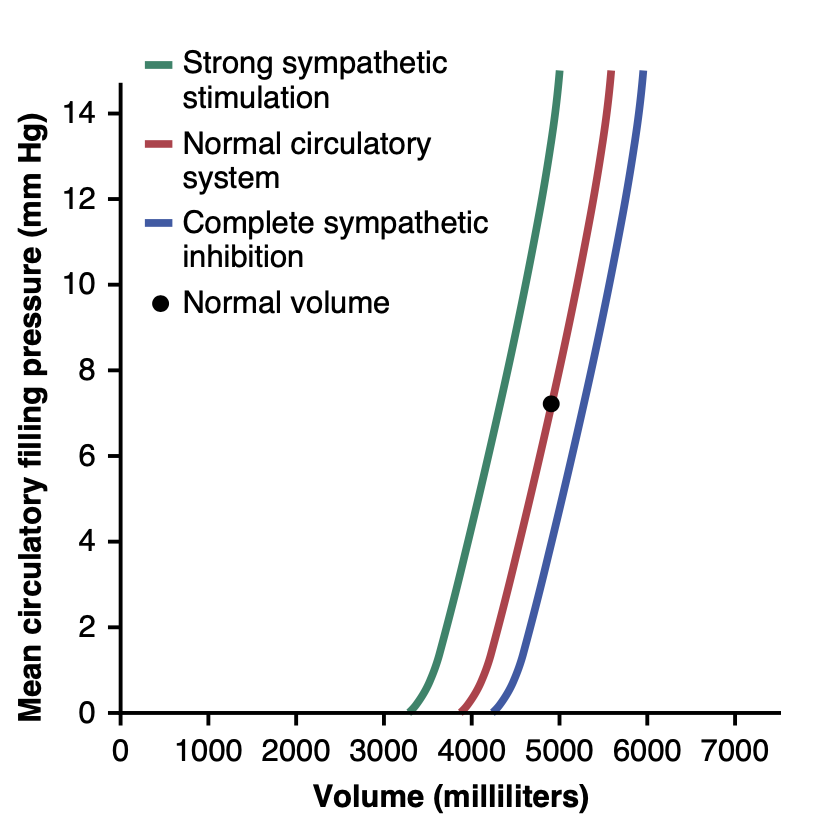
Figure 20-11. Effect of changes in total blood volume on the mean circulatory filling pressure (volume-pressure curve for the entire circulatory system). These curves also show the effects of strong sympathetic stimulation and complete sympathetic inhibition.
交感神経刺激による平均循環充填圧の増加
図20-11の緑色曲線と青色曲線は、それぞれ高いレベルと低いレベルの交感神経活動が平均循環充填圧にどのような影響を与えるかを示しています。強い交感神経刺激は全身の血管、さらには大きな肺血管や心室までも収縮させます。したがって、システムの容量が減少するため、各血液量レベルで平均循環充填圧が増加します。通常の血液量で、最大の交感神経刺激は平均循環充填圧を7 mm Hgから約2倍の値、約14 mm Hgに増加させます。
交感神経システムの完全な抑制による平均循環充填圧の減少
逆に、交感神経システムの完全な抑制は血管と心臓をリラックスさせ、平均循環充填圧を通常値の7 mm Hgから約4 mm Hgに下げます。図20-11に示されているように、曲線は急で、これはシステムの血液量または容量のわずかな変化が交感神経活動のさまざまなレベルによって引き起こされ、平均循環充填圧に大きな影響を及ぼすことを意味します。
平均全身充填圧と平均循環充填圧との関係(Mean Systemic Filling Pressure and Relationship to Mean Circulatory Filling Pressure)
平均全身充填圧(Psf)は平均循環充填圧と少し異なります。これは、心臓で大血管をクランプして血流を停止した後、肺循環から独立して全身循環内の圧力を測定できるように、全身循環内のどこでも測定される圧力です。生きた動物ではほとんど測定不可能ですが、平均全身充填圧はほぼ常に平均循環充填圧に近い値です。これは、肺循環が全身循環の容量の8分の1以下であり、血液量も約10分の1しかないためです。
平均全身充填圧の変化が静脈還流曲線に与える影響(Effect on Venous Return Curve of Changes in Mean Systemic Filling Pressure)Psf(systemic filling pressure )
図20-12は、Psfの増減が静脈還流曲線に与える影響を示しています。通常のPsfは約7 mm Hgです。図の最上部の曲線では、Psfが14 mm Hgに増加しており、最下部の曲線では3.5 mm Hgに減少しています。これらの曲線は、Psfが高いほど(循環システムが血液で「密に」満たされていることを意味する)、静脈還流曲線が上方および右方にシフトすることを示しています。逆に、Psfが低いほど、曲線は下方および左方にシフトします。
このことを別の方法で表現すると、システムがより充填されているほど、血液が心臓に流れ込むのが容易になります。システムの充填度が低いほど、血液が心臓に流れ込むのが難しくなります。
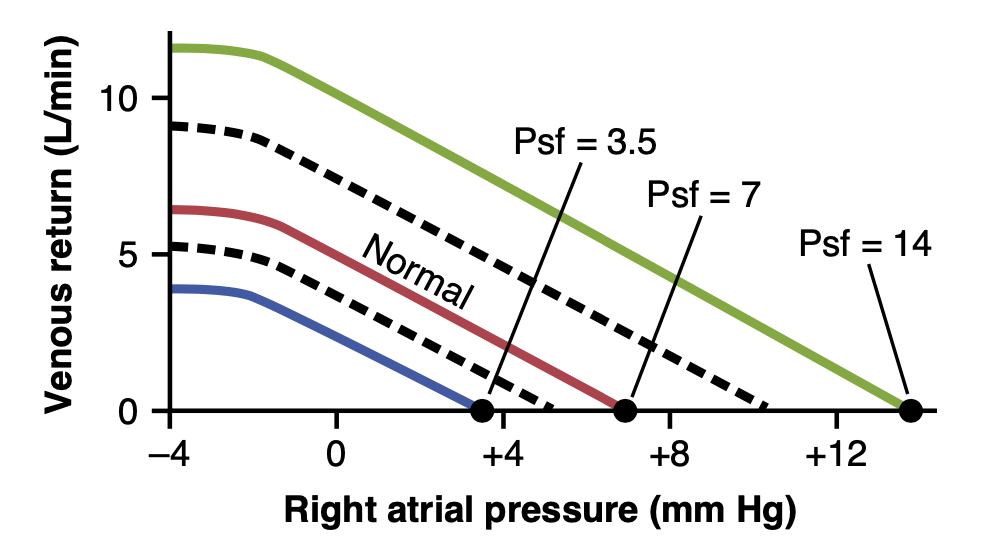
Figure 20-12. Venous return curves showing the normal curve when the mean systemic filling pressure (Psf) is 7 mm Hg and the effect of altering the Psf to 3.5, 7, or 14 mm Hg. (Modified from Guyton AC, Jones CE, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
静脈還流の圧力勾配がゼロの場合、静脈還流は存在しない(When Pressure Gradient for Venous Return Is Zero There Is No Venous Return)
右心房圧(right atrial pressure)が平均全身充填圧(Psf)に等しくなると、周辺血管と右心房間の圧力差がなくなります。その結果、周辺血管から右心房への血流はもはや存在し得ません。しかし、右心房圧がPsfよりも徐々に低下すると、心臓への血流は比例して増加します。これは図20-12の静脈還流曲線を研究することで確認できます。つまり、Psfと右心房圧の間の差が大きいほど、静脈還流が増大します。したがって、これら二つの圧力の差は静脈還流のための圧力勾配(pressure gradient for venous return)と呼ばれます。
このように、心臓の機能と全身循環の複雑な相互作用を理解するためには、心拍出量と静脈還流の両方に関連する多くの要因を考慮に入れることが重要です。この定量的アプローチは、心不全や循環ショックなどの臨床状況において、治療戦略を計画する際に特に価値があります。平均全身充填圧や右心房圧の微妙な変化が全体の心血管系の機能にどのように影響するかを理解することで、より効果的な介入が可能になります。
さらに、これらの理論を基にした実験や臨床試験を通じて、特定の循環調節メカニズムの理解が深まることで、新しい治療薬の開発や既存の治療法の改善につながる可能性があります。このように心拍出量と静脈還流の制御機構を詳細に理解することは、心血管疾患の管理における大きな進歩を意味します。
静脈還流への抵抗(Resistance to Venous Return)
Psf(平均全身充填圧、Mean Systemic Filling Pressure)が、末梢(periphery)から心臓(heart)へと血液を押し出す圧力を代表するのと同じように、静脈還流(venous return)の流れにも抵抗があります。これは「静脈還流への抵抗(resistance to venous return)」と呼ばれています。この抵抗の大部分は静脈(veins)で発生しますが、一部は細小動脈(arterioles)や小動脈(small arteries)でも発生します。
静脈抵抗がなぜ静脈還流の抵抗を決定するのかという重要性についてですが、静脈の抵抗が増加すると、血液が主に静脈自体で停滞し始めます。しかし、静脈は非常に可撓性(distensible)が高いため、静脈圧の上昇は抵抗を克服するのにあまり効果的ではなく、その結果、右心房(right atrium)への血流は劇的に減少します。一方で、細小動脈や小動脈の抵抗が増加すると、血液は動脈(arteries)内に蓄積します。動脈のキャパシタンス(capacitance)は静脈の約30分の1しかないため、動脈内のわずかな血液の蓄積でも圧力が上昇し、この高圧が増加した抵抗を克服します。数学的には、静脈還流へのいわゆる抵抗の約2/3が静脈抵抗(venous resistance)によるもので、約1/3が細小動脈や小動脈の抵抗(arteriolar and small artery resistance)によるものです。
静脈還流は次の式によって計算することができます:
VR=(Psf−PRA)/RVR
ここで、VRは静脈還流(venous return)、Psfは平均全身充填圧(mean systemic filling pressure)、PRAは右心房圧(right atrial pressure)、RVRは静脈還流への抵抗(resistance to venous return)を表します。健康な成人ではこれらの値は以下の通りです:静脈還流は5 L/min、Psfは7 mm Hg、右心房圧は0 mm Hg、静脈還流への抵抗は1.4 mm Hg/L/minの血流です。
静脈還流への抵抗が静脈還流曲線に与える影響(Effect of Resistance to Venous Return on the Venous Return Curve)
図20-13は、静脈還流への抵抗(resistance to venous return)の異なるレベルが静脈還流曲線(venous return curve)にどのような影響を与えるかを示しています。この抵抗が半分の通常レベルに減少すると、血液の流れが2倍になり、その結果、曲線が2倍の勾配まで上向きに回転します。逆に、抵抗が通常の2倍に増加すると、曲線は半分の勾配まで下向きに回転します。
また、右心房圧(right atrial pressure)が平均全身充填圧(Psf)に等しくなると、静脈還流がすべての抵抗レベルでゼロになることに注意してください。これは、血液の流れを引き起こす圧力勾配が存在しないためです。したがって、心臓がどれだけ不全になろうとも、右心房圧が上がることができる最高レベルはPsfに等しくなります。
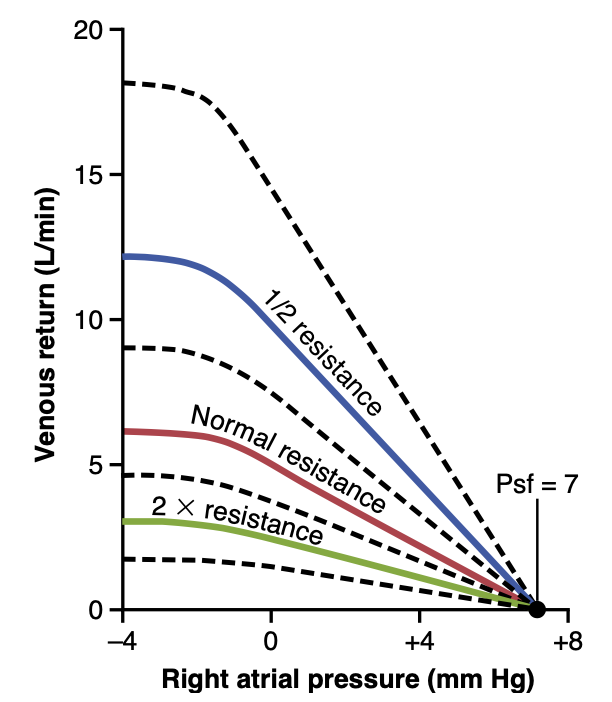
Figure 20-13. Venous return curves depicting the effect of altering the resistance to venous return. Psf, Mean systemic filling pressure. (Modified from Guyton AC, Jones CE, Coleman TG: Circulatory Physi- ology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
静脈還流曲線パターンの組み合わせ(Combinations of Venous Return Curve Patterns)
図20-14は、Psfと静脈還流への抵抗の同時変化が静脈還流曲線に与える影響を示しており、これらの要因が同時に作用することができることを示しています。
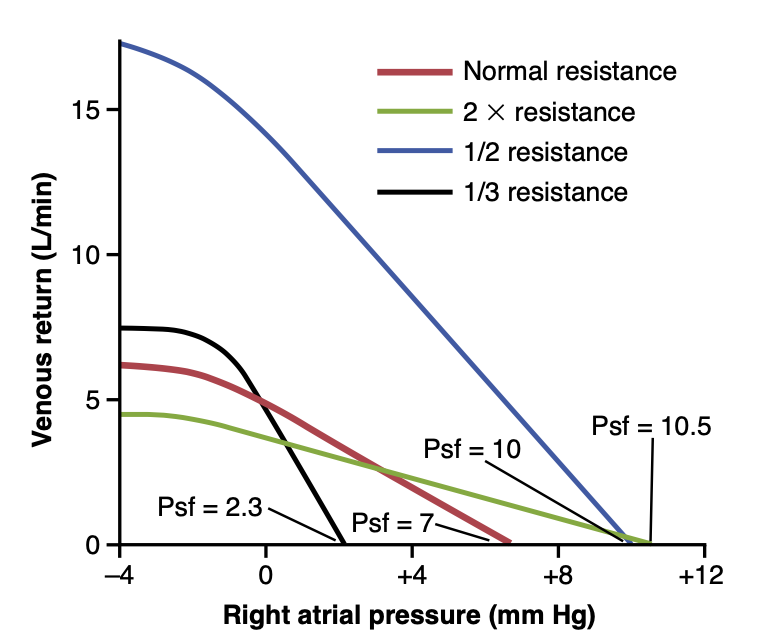
Figure 20-14. Combinations of the major patterns of venous return curves showing the effects of simultaneous changes in the mean sys- temic filling pressure (Psf) and in resistance to venous return. (Modi- fied from Guyton AC, Jones CE, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saun- ders, 1973.)
心拍出量と右心房圧の同時分析(ANALYSIS OF CARDIAC OUTPUT AND RIGHT ATRIAL PRESSURE BY SIMULTANEOUS CARDIAC OUTPUT AND VENOUS RETURN CURVES)
完全な循環系では、心臓と全身循環は一緒に機能する必要があります。これは、(1) 全身循環からの静脈還流(venous return)が心臓からの心拍出量(cardiac output)に等しくなければならず、(2) 心臓と全身循環における右心房圧が同じでなければならないことを意味します。
したがって、以下の方法で心拍出量と右心房圧を予測することができます:
- 心臓の瞬間的なポンピング能力を決定し、この能力を心拍出量曲線(cardiac output curve)の形で表現します。
- 全身循環から心臓への瞬間的な流れの状態を決定し、この流れの状態を静脈還流曲線の形で表現します。
- 図20-15に示されるように、これらの曲線を互いに対等にします。
図中の2つの曲線は、正常な心拍出量曲線(赤い線)と正常な静脈還流曲線(青い線)を示しています。グラフ上には、静脈還流が心拍出量に等しく、心臓と全身循環の右心房圧が同じである点Aが1つだけあります。したがって、正常な循環では、右心房圧、心拍出量、静脈還流はすべて点Aによって示され、これを平衡点(equilibrium point)と呼び、心拍出量は正常値5 L/min、右心房圧は0 mm Hgとされます。
血液量の増加が心拍出量に与える影響(Effect of Increased Blood Volume on Cardiac Output)
約20%の血液量の突然の増加は、心拍出量を通常の約2.5から3倍に増加させます。この効果の分析は図20-15で示されています。大量の追加血液を急速に注入すると、システムの充填が増加し、Psfが16 mm Hgに増加し、これによって静脈還流曲線が右にシフトします。同時に、増加した血液量が血管を膨張させ、その抵抗を減少させ、これにより静脈還流への抵抗が減少し、曲線が上向きに回転します。これらの二つの効果の結果、図20-15の静脈還流曲線は右にシフトされ、この新しい曲線は心拍出量曲線と点Bで等しくなり、心拍出量と静脈還流が2.5から3倍増加し、右心房圧が約+8 mm Hgに上昇することを示しています。
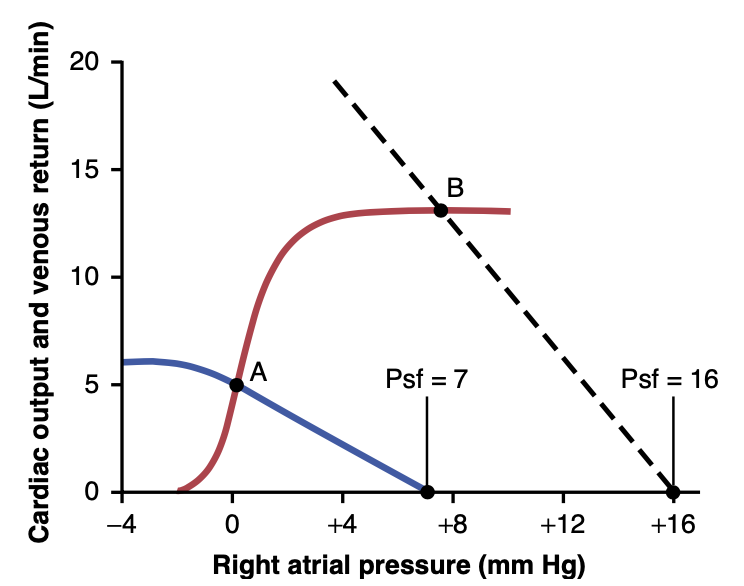
Figure 20-15. The two solid curves demonstrate an analysis of car- diac output and right atrial pressure when the cardiac output (red line) and venous return (blue line) curves are normal. Transfusion of blood equal to 20% of the blood volume causes the venous return curve to become the dashed curve. As a result, the cardiac output and right atrial pressure shift from point A to point B. Psf, Mean systemic filling pressure.
血液量の増加に対する補償効果(Compensatory Effects Initiated in Response to Increased Blood Volume)
増加した血液量による大幅な心拍出量の増加は数分間しか持続しません。これは、いくつかの補償効果が直ちに始まるためです:
- 増加した心拍出量は毛細血管圧(capillary pressure)を上昇させ、その結果、液体が毛細血管から組織へと滲出し始め、血液量が正常に戻ります。
- 静脈の圧力が上昇することで、静脈はストレスリラクゼーションと呼ばれるメカニズムにより徐々に拡張を続け、特に肝臓や脾などの静脈血液貯蔵庫が拡張され、Psfが減少します。
- 末梢組織を通る過剰な血流は末梢血管抵抗の自動調節増加を引き起こし、静脈還流への抵抗が増加します。
これらの要因はPsfを正常に戻し、全身循環の抵抗血管を収縮させます。その結果、10分から40分の期間をかけて、心拍出量はほぼ正常に戻ります。
交感神経刺激が心拍出量に与える影響(Effect of Sympathetic Stimulation on Cardiac Output)
交感神経刺激は心臓と全身循環に影響を及ぼします:(1) 心臓をより強力なポンプにする、及び (2) 末梢血管、特に静脈の収縮によりPsfを増加させ、静脈還流への抵抗が増加します。
図20-16では、正常な心拍出量と静脈還流曲線が示されており、これらは点Aで等しくなり、これは正常な静脈還流、心拍出量5 L/分、及び右心房圧0 mm Hgを表しています。図に示されているように、最大の交感神経刺激(緑の曲線)はPsfを17 mm Hg(静脈還流曲線が静脈還流ゼロレベルに達する点)まで増加させます。交感神経刺激はまた、心臓のポンピング効率をほぼ100%増加させます。その結果、心拍出量は平衡点Aの正常値から平衡点Dでほぼ2倍の正常値に上昇し、それでも右心房圧はほとんど変わりません。したがって、交感神経刺激の異なる程度は、補償効果が数秒または数分以内に発生するまでの短期間、心拍出量を約2倍に進行的に増加させることができます。
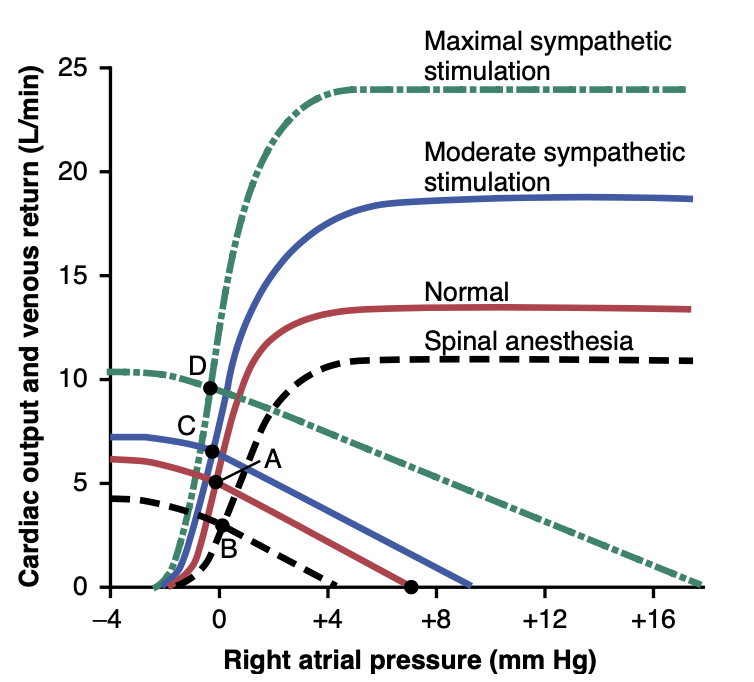
Figure 20-16. Analysis of the effect on cardiac output of (1) moder- ate sympathetic stimulation (from point A to point C), (2) maximal sympathetic stimulation (point D), and (3) sympathetic inhibition caused by total spinal anesthesia (point B). (Modified from Guyton AC, Jones CE, Coleman TG: Circulatory Physiology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
交感神経の抑制が心拍出量に与える影響(Effect of Sympathetic Inhibition on Cardiac Output)
交感神経系は、全脊椎麻酔を誘発するか、自律神経節を通じた神経信号の伝達をブロックする薬剤(例えばヘキサメトニウム)を使用することでブロックできます。図20-16の一番下の曲線は、全脊椎麻酔による交感神経抑制の効果を示しており、以下のことが示されています:(1) Psfが約4 mm Hgに低下し、(2) ポンプとしての心臓の効率が通常の約80%に減少します。心拍出量は点Aから点Bに減少し、これは正常の約60%の減少です。
大動静脈瘻(Arteriovenous Fistula)の開放が心拍出量に与える影響(Effect of Opening a Large Arteriovenous Fistula)
図20-17は、大きな動静脈瘻(AV fistula)、つまり大動脈と大静脈の間に直接開口を作る後の循環変化のさまざまな段階を示しています。
- 点Aにおける2つの赤い曲線が正常な状態を示しています。
- 点Bにおける曲線が大動静脈瘻を開放直後の循環状態を示しています。主な影響は以下の通りです: (a) 大動脈から静脈系へとほぼ障害なく血流が直接流れることを許可すると、静脈還流曲線が急激に上向きに回転し、これは静脈還流への抵抗の大幅な減少によるものです。 (b) 心臓がより簡単にポンプできるように動脈圧が急激に低下し、心拍出量曲線がわずかに上昇します。結果として、点Bで示されるように、心拍出量は5 L/分から13 L/分に増加し、右心房圧は約+3 mm Hgに上昇します。
- 点Cは約1分後の効果を表しており、交感神経反射が動脈圧をほぼ正常に戻し、以下の2つの効果を引き起こしました: (a) 全ての静脈と動脈の収縮によりPsfが7 mm Hgから9 mm Hgに上昇し、これにより静脈還流曲線が2 mm Hg右にシフトします。 (b) 心臓の交感神経興奮による心拍出量曲線のさらなる上昇。このため、心拍出量はほぼ16 L/分に上昇し、右心房圧は約4 mm Hgになります。
- 点Dは数週間後の効果を示しています。この時点で、動脈圧のわずかな低下と交感神経の刺激が一時的に腎臓の尿の産出を減少させ、塩分と水分の保持を引き起こしたため、血液量が増加しています。Psfは+12 mm Hgに上昇し、静脈還流曲線をさらに3 mm Hg右にシフトします。また、長期間の増加した負荷により心筋がわずかに肥大し、心拍出量曲線のレベルがさらに上昇します。したがって、点Dでは心拍出量がほぼ20 L/分になり、右心房圧は約6 mm Hgになります。
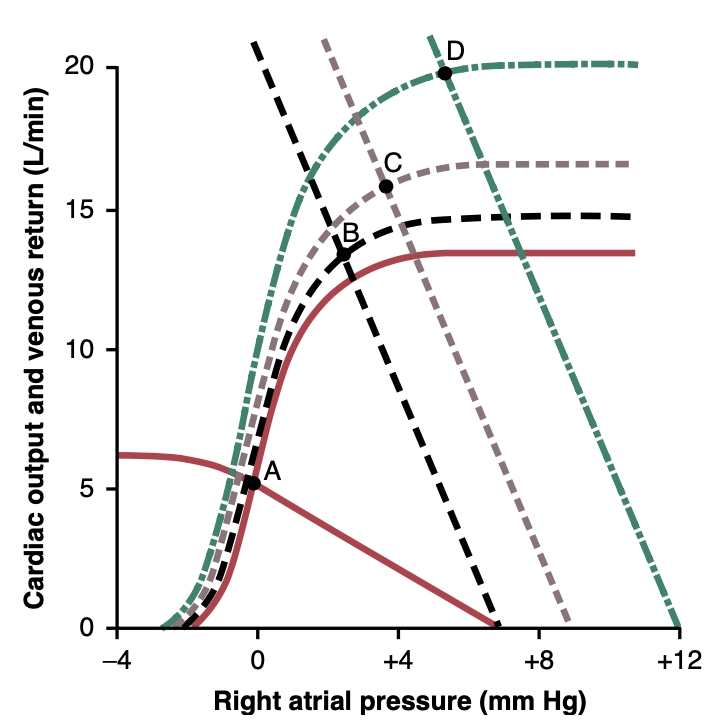
Figure 20-17. Analysis of successive changes in cardiac output and right atrial pressure in a human after a large arteriovenous (AV) fis- tula is suddenly opened. The stages of the analysis, as shown by the equilibrium points, are as follows: A, normal conditions; B, immedi- ately after opening the AV fistula; C, 1 minute or so after the sym- pathetic reflexes have become active; and D, several weeks after the blood volume has increased and the heart has begun to hypertrophy. (Modified from Guyton AC, Jones CE, Coleman TG: Circulatory Physi- ology: Cardiac Output and Its Regulation, 2nd ed. Philadelphia: WB Saunders, 1973.)
心拍出量調整のその他の分析
第21章では、運動中の心拍出量調整の分析が提示されます。第22章では、うっ血性心不全のさまざまな段階での心拍出量調整の分析が議論されます。
心拍出量測定方法(METHODS FOR MEASURING CARDIAC OUTPUT)
正確な心拍出量(cardiac output)の評価は、特に重篤な患者や手術を受ける高リスク患者では、現代の医療実践において非常に重要です。動物実験では、大動脈(aorta)または肺動脈(pulmonary artery)に配置された電磁流量計(electromagnetic flowmeter)や超音波流量計(ultrasonic flowmeter)を使用して心拍出量を測定することができます。しかし、人間では通常、手術を必要としない間接的な方法で心拍出量が測定されます。
心臓の拍動出力の測定(Pulsatile Output of the Heart Measured by Electromagnetic or Ultrasonic Flowmeter)
図20-18は、犬の大動脈根部の血流を電磁流量計を使用して記録したものです。この記録は、収縮期(systole)の間に血流が急速にピークに達し、収縮期の終わりに一瞬逆流することを示しています。この逆流は大動脈弁(aortic valve)の閉鎖と流れのゼロへの戻りを引き起こします。
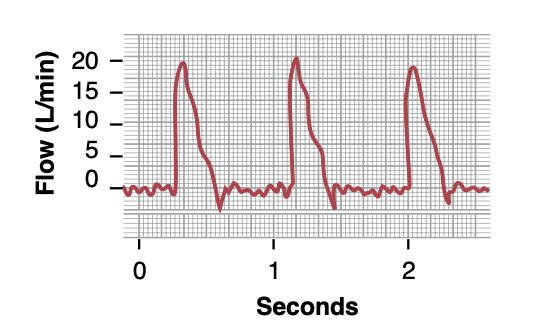
Figure 20-18. Pulsatile blood flow in the root of the aorta recorded using an electromagnetic flowmeter.
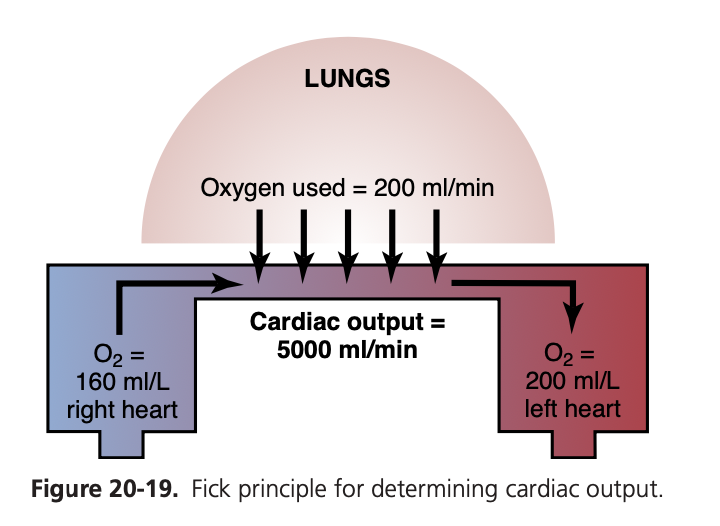
フィックの原理を使用した心拍出量の測定(Measurement of Cardiac Output Using the Oxygen Fick Principle)
フィックの原理(Fick principle)は図20-19に説明されています。この図は、毎分200 mlの酸素が肺(lungs)から肺血(pulmonary blood)に吸収されていることを示しています。また、右心(right heart)に入る血液の酸素濃度は血液1リットルあたり160 mlであるのに対し、左心(left heart)を出る血液の酸素濃度は200 ml/Lです。これらのデータから、肺を通過する各リットルの血液が40 mlの酸素を吸収することが計算できます。 肺から毎分200 mlの酸素が血液に吸収されるため、200を40で割ると、この量の酸素を吸収するために毎分5リットルの血液が肺循環(pulmonary circulation)を通過しなければならないことがわかります。したがって、肺を通過する血液の量は毎分5リットルであり、これも心拍出量の尺度です。したがって、心拍出量は以下の式によって計算することができます:
心拍出量 (L/min)=肺による1分間の酸素吸収量 (ml/min) / 動静脈酸素差 (ml/L of blood)
このフィック手法を人間で心拍出量測定に応用する場合、通常、前腕の上腕静脈(brachial vein)から鎖骨下静脈(subclavian vein)を通って右心房、最終的には右心室または肺動脈にカテーテルを挿入して混合静脈血(mixed venous blood)を得ます。その後、体の任意の全身動脈から全身動脈血(systemic arterial blood)を得ることができます。肺による酸素吸収の速度は、呼吸された空気からの酸素の消失率を測定することにより、任意のタイプの酸素計(oxygen meter)を使用して測定されます。
指示薬希釈法(Indicator Dilution Method)
心拍出量を指示薬希釈法(indicator dilution method)で測定するために、染料(dye)などの少量の指示薬を大きな全身静脈(large systemic vein)または好ましくは右心房(right atrium)に注入します。この指示薬は迅速に心臓の右側を通過し、次に肺の血管(blood vessels of the lungs)、左心(left side of the heart)、そして最終的には全身動脈系(systemic arterial system)を通過します。染料の濃度は周辺動脈(peripheral arteries)を通過する際に記録され、図20-20に示されているような曲線を生成します。これらのケースでは、各ケースで5ミリグラムのカーディオグリーン染料(Cardiogreen dye)が注入され、上部の記録では、注入後約3秒間は染料が動脈樹(arterial tree)に入らず、その後、動脈濃度が約6から7秒で急速に最大に達します。その後、濃度は急速に低下しますが、濃度がゼロに達する前に、一部の染料が周辺の全身血管を通って心臓を再び通過し始めます。結果として、動脈内の染料濃度が再び上昇し始めます。計算のためには、各曲線の初期の下降線を点線で示されているゼロ点まで外挿する必要があります。この方法により、循環再生を含まない全身動脈の染料の初期部分の時間濃度曲線を測定し、後半部分を合理的に正確に推定することができます。
一度外挿された時間濃度曲線が決定されると、曲線の持続時間にわたる動脈血中の染料の平均濃度を計算することができます。たとえば、図20-20の上部の例では、曲線全体の初期部分と外挿部分の下の面積を測定し、その後、曲線の持続時間にわたる染料濃度の平均を算出しました。上図の曲線をまたぐ影付きの長方形から、血液100 ml中に含まれる染料の平均濃度が0.25 mgであり、この平均値の持続時間が12秒であることがわかります。実験の始めに5ミリグラムの染料が注入されました。100 mlの血液中に0.25ミリグラムの染料のみを含む血液が心臓と肺を通って12秒で5ミリグラムの染料を運ぶためには、12秒間に100 mlの血液が20ポーション通過する必要があり、これは心拍出量が2 L/12秒、または10 L/分と同じです。図20-20の下部の外挿曲線から心拍出量を計算することは読者に任せます。要約すると、以下の式を使用して心拍出量を決定することができます:
心拍出量(Cardiac output, ml/min) = (注入された染料のミリグラム(Milligrams of dye injected) x 60) / ((曲線の期間における血液1ミリリットルあたりの染料の平均濃度(Average concentration of dye in each milliliter of blood for the duration of the curve)) x (曲線の持続時間(Duration of the curve in seconds)))
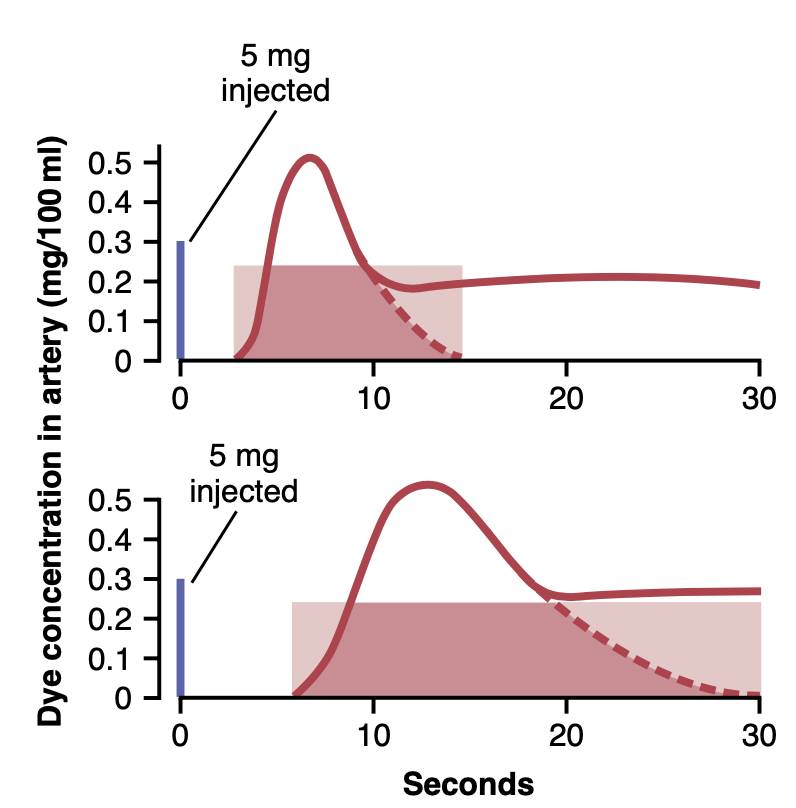
Figure 20-20. Extrapolated dye concentration curves used to calcu- late two separate cardiac outputs by the dilution method. The rectan- gular areas are the calculated average concentrations of dye in the arterial blood for the durations of the respective extrapolated curves.
エコーカルディオグラフィー(Echocardiography)
心拍出量はエコーカルディオグラフィー(echocardiography)、つまり胸壁に置かれたトランスデューサー(transducer)または患者の食道に挿入されたトランスデューサーからの超音波(ultrasound waves)を使用して心室(heart’s chambers)のサイズや左心室(left ventricle)から大動脈(aorta)へ流れる血液の速度を測定する方法によっても推定することができます。ストロークボリューム(stroke volume)は大動脈へ流れる血液の速度から計算され、大動脈の断面積(aorta cross-sectional area)は超音波画像(ultrasound imaging)によって測定された大動脈の直径(aorta diameter)から決定されます。その後、心拍出量はストロークボリュームと心拍数(heart rate)の積から計算されます。
胸部電気生体インピーダンス法(Thoracic Electrical Bioimpedance Method)
インピーダンス心臓グラフィー(impedance cardiography)、または胸部電気生体インピーダンス(thoracic electrical bioimpedance)とも呼ばれるこの非侵襲技術は、心臓出力(cardiac output)などの血行動態パラメーターを間接的に評価するために胸部の総電気伝導性の変化を測定するために使用されます。この方法は、測定セグメントの外側に位置する追加の二対の電極間を流れる高周波数、低強度の電流によって引き起こされるインピーダンスの変化を検出します。電気インピーダンス(electrical impedance)は、電圧が適用されたときに回路が電流に対して示す反対力です。心拍ごとに大動脈(aorta)の血液量と速度が変化し、それに応じたインピーダンスの変化とそのタイミングが測定され、心臓出力を推定するために使用されます。
インピーダンス心臓グラフィーは、ある条件下で心臓出力の合理的な評価を提供するかもしれないと示唆されている一方で、電気的干渉(electrical interferences)、運動アーティファクト(motion artifacts)、心周囲や肺における液体の蓄積、不整脈(arrhythmias)など、いくつかの潜在的な誤差源にも影響されます。この方法の平均誤差は20%から40%に達する可能性があると示唆されています。
心拍出量の正確な評価は、心機能(heart function)と組織への血流(tissue perfusion)の洞察を提供します。なぜなら、心拍出量は体の全ての臓器と組織への血流の合計を表すからです。したがって、循環不全(circulatory distress)の患者を管理するために、より正確な心拍出量測定のための非侵襲方法が継続的に開発されています。


コメント