Contents
第14章
循環の概要:圧力、流量、抵抗
循環の役割は、体組織のニーズに応じて、栄養素を組織に運び、老廃物を運び出し、ホルモンを体内のある部分から別の部分へ輸送することです。さらに、細胞が生存し、最適な機能を発揮するために、すべての組織液中で適切な環境を維持することが目的です。
多くの組織を流れる血液の流量は、主に栄養素の供給や代謝産物の排出の必要性に応じて調節されます。腎臓のような一部の臓器では、循環が追加の役割を果たします。例えば、腎臓に流れる血液は代謝に必要な量をはるかに超えており、これは一分間に大量の血液が濾過される必要がある排泄機能に関連しています。
心臓と血管は、適切な組織血流を供給するために必要な心拍出量(cardiac output)と動脈圧(arterial pressure)を提供するために制御されます。血液量(blood volume)と血流(blood flow)を制御するためのメカニズムとは何か、そしてこのプロセスが循環の他の機能とどのように関連しているか、これらのトピックについてこの章で取り上げます。
循環の物理的特性
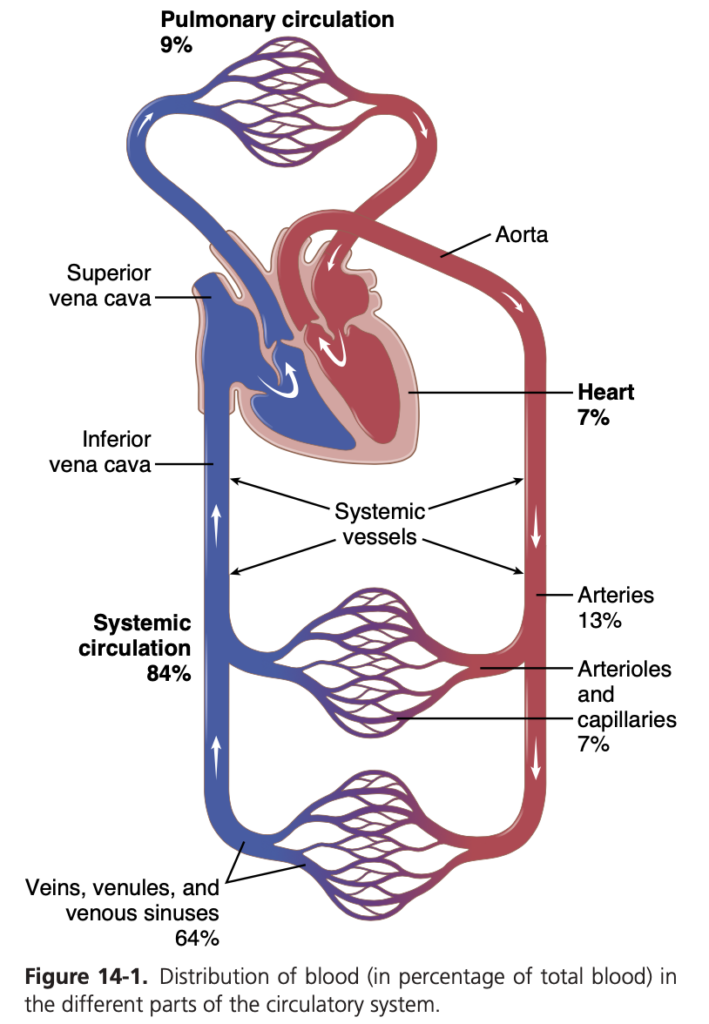
図14-1に示されているように、循環は体循環(systemic circulation)と肺循環(pulmonary circulation)に分かれています。体循環は、肺以外の全身組織に血流を供給するため、大循環(greater circulation)または末梢循環(peripheral circulation)とも呼ばれます。
循環の機能的部分
循環機能の詳細を説明する前に、循環の各部分の役割を理解することが重要です。
- 動脈(arteries)の役割は、高圧(high pressure)下で血液を組織に運ぶことです。このため、動脈には強い血管壁(vascular walls)があり、動脈内の血流速度は非常に速くなっています。
- 細動脈(arterioles)は動脈系の最後の小枝であり、血液が毛細血管(capillaries)に放出される際の制御経路として機能します。細動脈には強い筋肉層があり、完全に閉じたり、緩んで血管(vessels)が数倍に広がったりします。これにより、細動脈は組織のニーズに応じて血流を大きく変えることができます。
- 毛細血管(capillaries)の役割は、血液と組織間の液体(fluid)、栄養素(nutrients)、電解質(electrolytes)、ホルモン(hormones)などの物質交換を行うことです。この役割を果たすために、毛細血管の壁は薄く、多数の細かい毛細血管孔(capillary pores)があり、水や小さな分子物質が透過しやすくなっています。
- 細静脈(venules)は毛細血管から血液を集め、徐々に大きな静脈(veins)に合流していきます。
- 静脈の役割は、細静脈から心臓へ血液を運ぶ経路として機能することです。また、静脈は余分な血液の主要な貯蔵庫(reservoir)としても機能します。静脈系の圧力(pressure)は低いため、静脈壁は薄いですが、筋肉が十分に発達しており、必要に応じて収縮または拡張することで、少量から大量の血液まで制御可能な貯蔵庫として機能します。
循環の各部分における血液量
図14-1は、循環全体の概要と、循環の主要部分における総血液量(total blood volume)の割合を示しています。例えば、体全体の血液量の約84%が体循環(systemic circulation)にあり、16%が心臓と肺にあります。体循環の84%のうち、約64%が静脈に、13%が動脈に、7%が体の細動脈および毛細血管にあります。心臓(heart)には7%、肺血管(pulmonary vessels)には9%の血液が含まれています。
最も驚くべきことは、毛細血管に含まれる血液量が非常に少ないことです。しかし、ここで循環の最も重要な機能である、血液と組織間の物質の拡散が行われます。この内容については第16章で詳しく説明されています。
血流の断面積と速度
各種類の体循環血管を並べた場合、平均的な総断面積(total cross-sectional area)は以下の通りです:
- 静脈の断面積は動脈の約4倍です。この違いは、動脈系に比べて静脈系が大きな血液貯蔵容量を持っている理由を説明しています。
- 血流量(F)は各循環部分を毎分通過する血液量が一定であるため、血流速度(velocity)は血管の断面積(A)に反比例します:
- v = F/A
- したがって、通常の条件下での大動脈(aorta)における血流速度は約33 cm/secであるのに対し、毛細血管内ではその1/1000である約0.3 mm/secに過ぎません。しかし、毛細血管の長さは通常0.3~1 mmしかないため、血液が毛細血管内に滞在する時間はわずか1~3秒です。この短時間で、栄養物質や電解質のすべての拡散が行われることが驚くべき事実です。
各循環部分の圧力
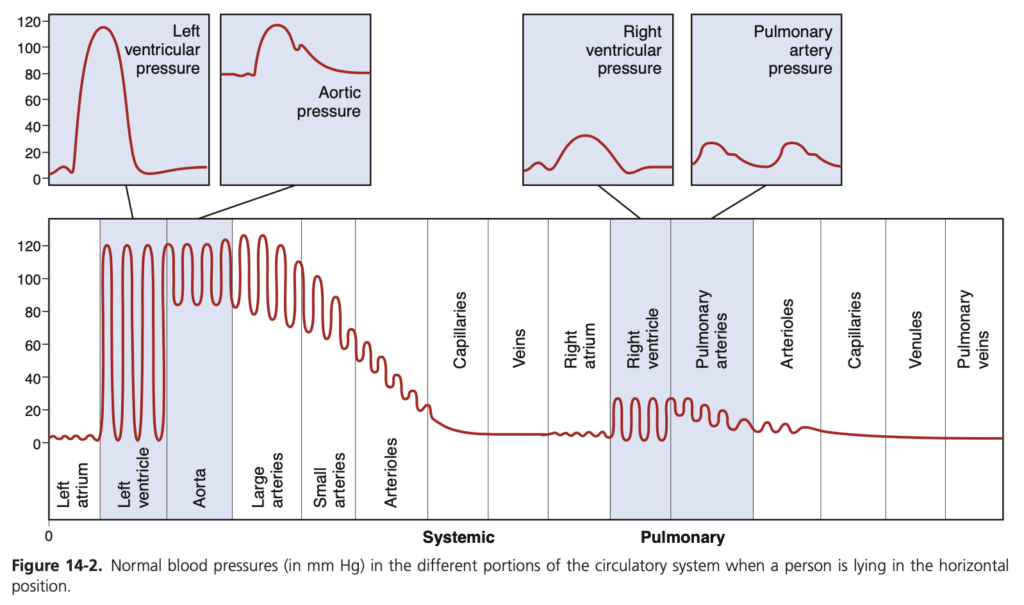
心臓が血液を大動脈(aorta)に継続的に送り出すため、大動脈圧(aortic pressure)は高く、平均で約100 mm Hgです。また、心臓のポンプ作用が脈動性(pulsatile)であるため、動脈圧は通常、収縮期圧(systolic pressure)平均120 mm Hgと拡張期圧(diastolic pressure)平均80 mm Hgの間を交互に変動します(図14-2の左側を参照)。
血液が体循環を通過するにつれて、その平均圧は徐々に低下し、最終的には上大静脈(superior vena cava)と下大静脈(inferior vena cava)が右心房(right atrium)に流れ込む時点で約0 mm Hgに達します。
体毛細血管(systemic capillaries)における圧力は、細動脈末端(arteriolar ends)では35 mm Hg程度で、静脈末端(venous ends)では10 mm Hg程度まで低下しますが、大部分の血管床(vascular beds)での平均的な機能圧(functional pressure)は約17 mm Hgです。この圧力は、血漿が毛細血管の細孔を通過して漏れ出さない程度に低いですが、栄養素はこれらの同じ細孔を通じて容易に拡散することができます。例えば、腎臓の糸球体毛細血管(glomerular capillaries)では圧力がかなり高く、平均60 mm Hg程度で、これにより大量の体液が濾過されます。
図14-2の右側に示されているように、肺循環(pulmonary circulation)の各部分の圧力を見てください。肺動脈(pulmonary artery)における圧力は、大動脈と同様に脈動性ですが、はるかに低く、肺動脈の収縮期圧(systolic pressure)は平均約25 mm Hg、拡張期圧(diastolic pressure)は平均約8 mm Hgで、平均肺動脈圧(mean pulmonary arterial pressure)はわずか16 mm Hgです。また、平均肺毛細血管圧(mean pulmonary capillary pressure)は約7 mm Hgです。しかし、肺を通過する総血流量(total blood flow)は、体循環を通過する血流量と同じです。肺循環の圧力が低いことは、肺のニーズに合致しており、必要なことは、肺毛細血管内の血液を肺胞(alveoli)での酸素や他のガスと接触させることだけだからです。
循環機能の基本原則
循環機能の詳細は複雑ですが、すべての機能に共通する3つの基本原則があります。
- 血流は組織のニーズに応じて制御される。
組織が活発なとき、栄養素の供給が必要となり、その結果として、安静時の20~30倍の血流が必要となることもあります。しかし、心臓は通常、心拍出量(cardiac output)を安静時の4~7倍以上に増加させることはできません。そのため、特定の組織が血流を増加させる必要があるときに、単に全身の血流を増加させることはできません。代わりに、各組織の微小血管(microvessels)、特に細動脈が、酸素(oxygen)や他の栄養素の供給状態や二酸化炭素(carbon dioxide)などの老廃物(waste products)の蓄積を継続的にモニターし、それに応じて局所的な血流を制御します。加えて、中枢神経系からの神経制御(nervous control)やホルモン(hormones)が、組織血流を制御するために補助的な役割を果たします。 - 心拍出量は局所的な組織血流の合計である。
血液が組織を通過すると、すぐに静脈を通って心臓に戻ります。心臓はこの血液流入の増加(increased inflow)に自動的に反応し、それをすぐに動脈に送り返します。したがって、心臓が正常に機能している限り、心臓は自動的に動作し、組織の要求に応じて反応します。ただし、心臓はしばしば神経信号(nerve signals)などの特別な助けを必要とし、これにより必要な量の血流を供給します。 - 動脈圧の調節は局所的な血流制御や心拍出量制御とは一般に独立している。
循環系には、動脈血圧(arterial blood pressure)を制御するための広範なシステムが備わっています。例えば、動脈圧が正常なレベル(約100 mm Hg)を大きく下回ると、多数の神経反射(nervous reflexes)が一連の循環変化を引き起こし、数秒以内に圧を元のレベルに戻すようにします。これらの神経信号は、特に次のような作用を行います:(a)心臓のポンプ作用を強化する、(b)大静脈貯蔵庫(venous reservoirs)の収縮を促し、心臓により多くの血液を提供する、(c)多くの組織で細動脈の収縮(arteriolar constriction)を引き起こし、血液が大動脈により多く蓄積されることで動脈圧が上昇します。その後、数時間から数日にわたって、腎臓(kidneys)が圧力調節ホルモンを分泌し、血液量を調節することで、動脈圧の制御において重要な役割を果たします。
このように、各組織のニーズは循環によって特別に満たされます。この章の残りでは、組織の血流、心拍出量、および動脈圧の基本的な制御について説明を始めます。
圧力、流量、抵抗の相互関係
血管(blood vessel)を流れる血液の流量は、次の2つの要因によって決まります:
(1)血管の両端における血液の圧力差(pressure difference)、これは圧力勾配(pressure gradient)とも呼ばれ、血管を通じて血液を押し出す力です。
(2)血管内を通る血流の抵抗(resistance)。図14-3はこれらの関係を示しており、循環系のどこに位置するかに関係なく、血管の一部を表しています。
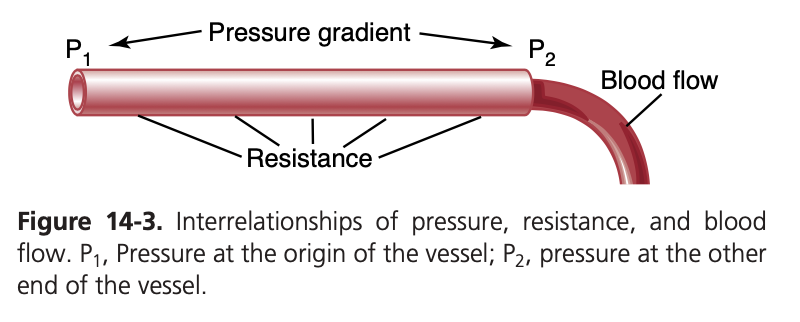
- P1は血管の起点での圧力を表し、P2は他端での圧力を示します。抵抗(resistance)は、血液が血管の内壁(内皮:endothelium)を流れる際に発生する摩擦によって生じます。血流は次の式で計算できます。この式はオームの法則(Ohm’s law)と呼ばれます:
- F = ΔP / R
注意すべきは、血流速度を決定するのは血管の両端の圧力差(pressure difference)であって、絶対的な圧力ではないという点です。例えば、血管の両端の圧力が100 mm Hgであり、圧力差が存在しない場合、100 mm Hgの圧力が存在しても血流は発生しません。
上記のオームの法則は、循環の血行力学(hemodynamics)を理解するために最も重要な関係の1つを示しています。この法則は重要であるため、次の代数形式(algebraic forms)にも慣れておく必要があります:- ΔP = F × R
- R = ΔP / F
このようにして、圧力、流量、抵抗の関係を理解することが循環システムの基本となります。
血流(Blood Flow)
血流量(blood flow rate)は、ある循環の一点を一定の時間内に通過する血液の量を指します。
通常、血流量は「ミリリットル/分」(ml/min)または「リットル/分」(L/min)で表されますが、「ミリリットル/秒」(ml/sec)や他の任意の流量と時間の単位でも表すことができます。
安静時の成人の総循環における血流量は約5000 ml/minです。これを心拍出量(cardiac output)と呼び、これは心臓が毎分大動脈(aorta)に送り出す血液の量に相当します。
血流を測定する方法
多くの機械式(mechanical)および機械電気式(mechanoelectrical)流量計(flowmeter)デバイスは、血管に直接挿入したり、ある場合には血管の外側に適用したりして血流を測定することができます。
電磁流量計(Electromagnetic Flowmeter)
図14-4に示されている原理に基づく電磁流量計(electromagnetic flowmeter)は、血管を開けずに実験的に血流を測定するために使用されます。図14-4Aは、磁場中を横切るようにワイヤーを急速に動かすときに発生する起電力(electromotive force:電圧)を示しています。これは電気発電機の電気生成原理としてよく知られています。
図14-4Bは、血液が磁場を通過する際に、同様の原理で起電力が発生することを示しています。この場合、血管は強力な磁石(magnet)の極の間に置かれ、電極が血管の両側に配置され、磁力線に垂直になります。血液が血管を流れると、血流速度に比例した電圧が2つの電極間に生成され、この電圧が電圧計(voltmeter)または電子記録装置で記録されます。図14-4Cは、実際に大きな血管に設置されたプローブを示しており、このプローブには強力な磁石と電極が含まれています。
電磁流量計の特別な利点は、1/100秒以内に流量の変化を記録できるため、脈動する血流の変化や安定した血流の両方を正確に記録できることです。
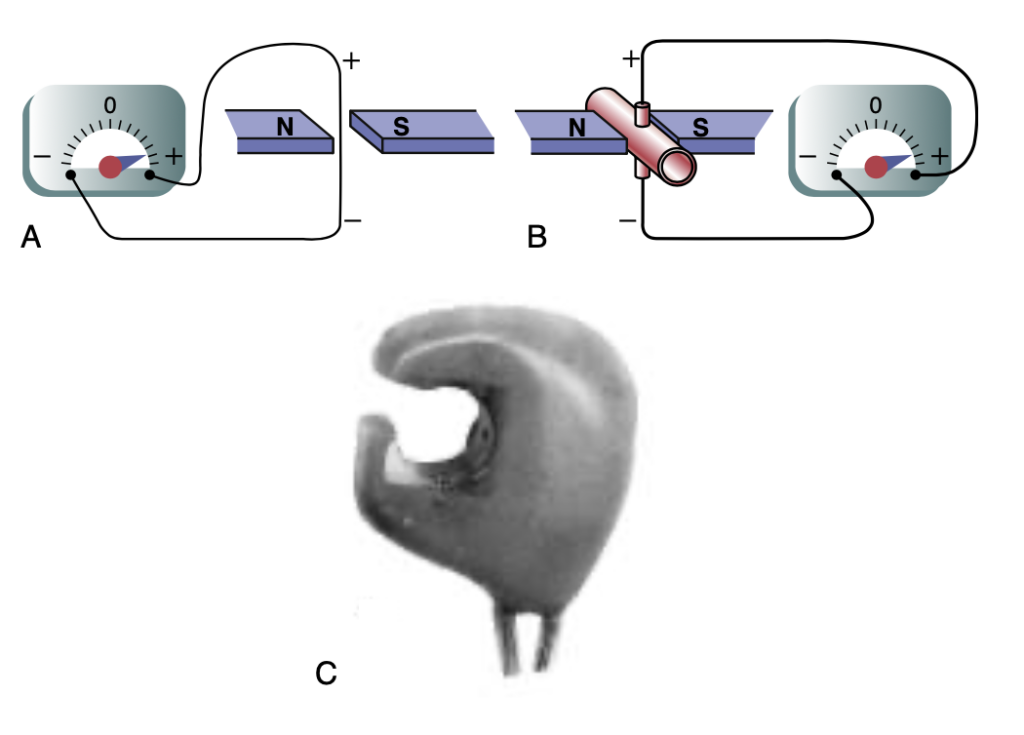
Figure 14-4. A, Electromagnetic flowmeter showing generation of an electrical voltage in a wire as it passes through an electromagnetic field. B, Generation of an electrical voltage in electrodes on a blood vessel when the vessel is placed in a strong magnetic field, and blood flows through the vessel. C, Modern electromag- netic flowmeter probe for chronic implantation around blood vessels. N and S refer to the mag- net’s north and south poles.
超音波ドップラー流量計(Ultrasonic Doppler Flowmeter)
もう一つの流量計は、電磁流量計と同様に血管の外側に取り付けられ、多くの利点を持つ超音波ドップラー流量計(ultrasonic Doppler flowmeter)です。図14-5に示されているように、このデバイスの一端には小さな圧電結晶(piezoelectric crystal)が取り付けられています。この結晶は適切な電子装置でエネルギーが供給されると、数十万サイクル/秒の超音波(ultrasound)を血流方向に発射します。流れる血液中の赤血球(red blood cells)によって、超音波の一部が反射されます。反射された超音波波は、送信された波に比べて周波数が低くなります。これは、赤血球が送信結晶から離れて移動しているためです。この現象をドップラー効果(Doppler effect)と呼びます。
(電車が近づいて笛を鳴らしているときに、電車が通り過ぎると音の高さが急に低くなる現象と同じです。)
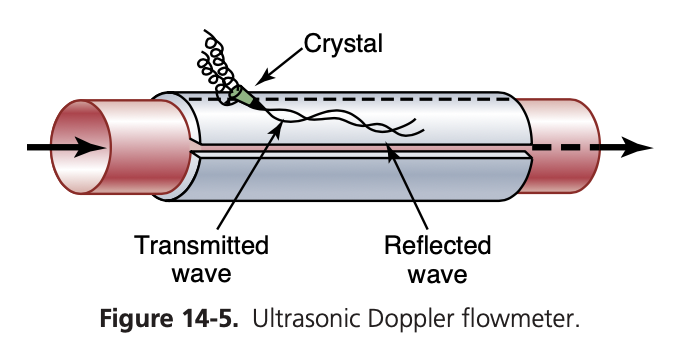
図14-5に示されている流量計では、超音波波が断続的にカットされ、反射された波が結晶に戻り、大幅に増幅されます。電子機器の他の部分は、送信された波と反射された波の周波数の差を計算し、それによって血流速度が決定されます。血管の直径(diameter)が変化しない限り、血管内の血流量の変化は血流速度の変化に直接関連します。
電磁流量計と同様に、超音波ドップラー流量計は、脈動する流量の急速な変化や、安定した流量の両方を記録することができます。
血管内での層流(Laminar Flow)
血液が一定速度(steady rate)で長い滑らかな血管(smooth blood vessel)を通過すると、血流は流線型(streamlines)となり、各血液層が血管壁から同じ距離を保ちながら流れます。また、最も中央にある血液は血管の中央に留まります。このタイプの流れを層流(laminar flow)または流線型流れ(streamline flow)と呼び、後述する乱流(turbulent flow)とは対照的です。
層流時の速度プロファイル(Parabolic Velocity Profile)
層流が発生すると、血管中央部の流速は、外側に向かうにつれて大幅に減少します。この現象は図14-6に示されています。図14-6Aでは、血管内に色のついた液体と透明な液体があり、流れは発生していません。これらの液体が流れ始めると、1秒後には図14-6Bのように放物線状の境界(parabolic interface)が現れます。血管壁に接した部分の液体はほとんど動かず、壁から少し離れた部分の液体はわずかに移動し、中央の液体は大きく移動しています。この効果を流速の放物線プロファイル(parabolic profile for velocity of blood flow)と呼びます。
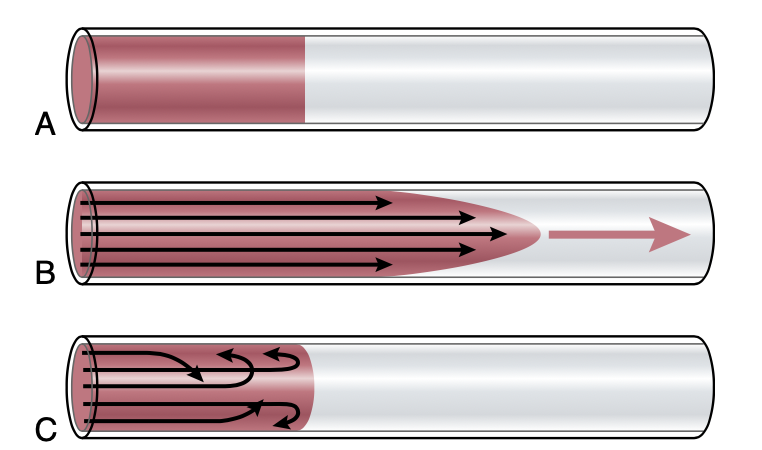
Figure 14-6. A, Two fluids (one dyed red, and the other clear) before flow begins. B, The same fluids 1 second after flow begins. C, Turbu- lent flow, with elements of the fluid moving in a disorderly pattern.
この放物線プロファイルの原因は次の通りです。壁に接している液体分子は血管壁に付着(adherence)しているため、移動速度が遅くなります。次の層の分子はそれらの上を滑り、次の層もさらにその上を滑ります。したがって、血管の中央部の液体は、壁と中央部の間に存在する多くの滑る層によって、迅速に移動できるのです。中央に向かうにつれて各層の流速が増加するため、血管中央の層が最も速く流れます。
乱流(Turbulent Flow)
血流速度が過度に速くなったり、血管内に障害(obstruction)がある場合、急激な曲がり(sharp turn)を通過したり、粗い表面(rough surface)を通過する際には、流れが乱れ、秩序立った流れ(streamlined)ではなくなることがあります(図14-6C)。この乱れた流れを乱流(turbulent flow)と呼びます。乱流が発生すると、血流は血管内で横方向や斜めに流れ、通常渦流(eddy currents)を形成します。これらの渦流は、急流の川で障害物がある箇所で見られる渦巻き(whirlpools)と似ています。渦流が存在すると、流線型の流れのときに比べて抵抗が大幅に増加し、血液の流れに対する全体的な摩擦が非常に増加します。
乱流の発生傾向は、血流速度(v)、血管径(d)、および血液の密度(density)に比例し、粘度(viscosity)には反比例します。これらの関係は以下の式で示されます:
- Re = (v × d × ρ) / η
ここで、Reはレイノルズ数(Reynolds’ number)、血流が乱流を引き起こす傾向を表す数値です。vは平均血流速度(mean velocity of blood flow、cm/sec)、dは血管径(vessel diameter、cm)、ρは密度(grams/ml)、ηは粘度(poise)です。血液の粘度は通常約1/30ポアスで、密度は1を少し超える程度です。
レイノルズ数が200~400を超えると、血管の枝で乱流が発生することがありますが、滑らかな部分では消滅します。しかし、レイノルズ数が約2000を超えると、直線で滑らかな血管でも通常乱流が発生します。
通常、血管系(vascular system)でのレイノルズ数は200~400まで上昇し、特に大きな動脈では、血管の枝で何らかの乱流が常に存在します。大動脈(aorta)および肺動脈(pulmonary artery)の近位部分では、レイノルズ数は心室からの急速な駆出相(ejection phase)中に数千に達し、かなりの乱流を引き起こします。これには以下の条件が整っている場合があります:(1)血流速度が高い、(2)流れが脈動している、(3)血管径が急激に変化する、(4)血管径が大きい。しかし、小さな血管では、レイノルズ数が乱流を引き起こすほど高くなることはほとんどありません。
血圧(Blood Pressure)
標準圧力単位(Standard Units of Pressure):血圧はほぼ常にミリメートル水銀柱(mm Hg)で測定されます。これは、1846年にポアズイユ(Poiseuille)が発明した水銀圧力計(manometer)が圧力測定の標準として使用されているからです。実際の血圧は、血液が血管壁の単位面積に対して作用する力(force)を指します。例えば、血管内の圧力が100 mm Hgである場合、これは水銀柱を50 mmの高さまで押し上げる力が存在することを意味します。
時折、圧力が水柱センチメートル(cm H₂O)で測定されることがあります。例えば、10 cm H₂Oの圧力は、水柱を10 cmの高さまで引き上げる力を意味します。1 mm Hgの圧力は1.36 cm H₂Oの圧力に相当します。これは、水銀の比重(specific gravity)が水の13.6倍であり、1センチメートルは1ミリメートルの10倍であるためです。
高忠実度の血圧測定方法
水銀は慣性(inertia)が大きいため、急速に上昇したり下降したりすることができません。このため、水銀圧力計(mercury manometer)は安定圧(steady pressures)の記録には優れていますが、2~3秒ごとに発生する圧力変化には対応できません。急速に変化する圧力を記録する場合は、別の種類の圧力記録装置(pressure recorder)が必要です。
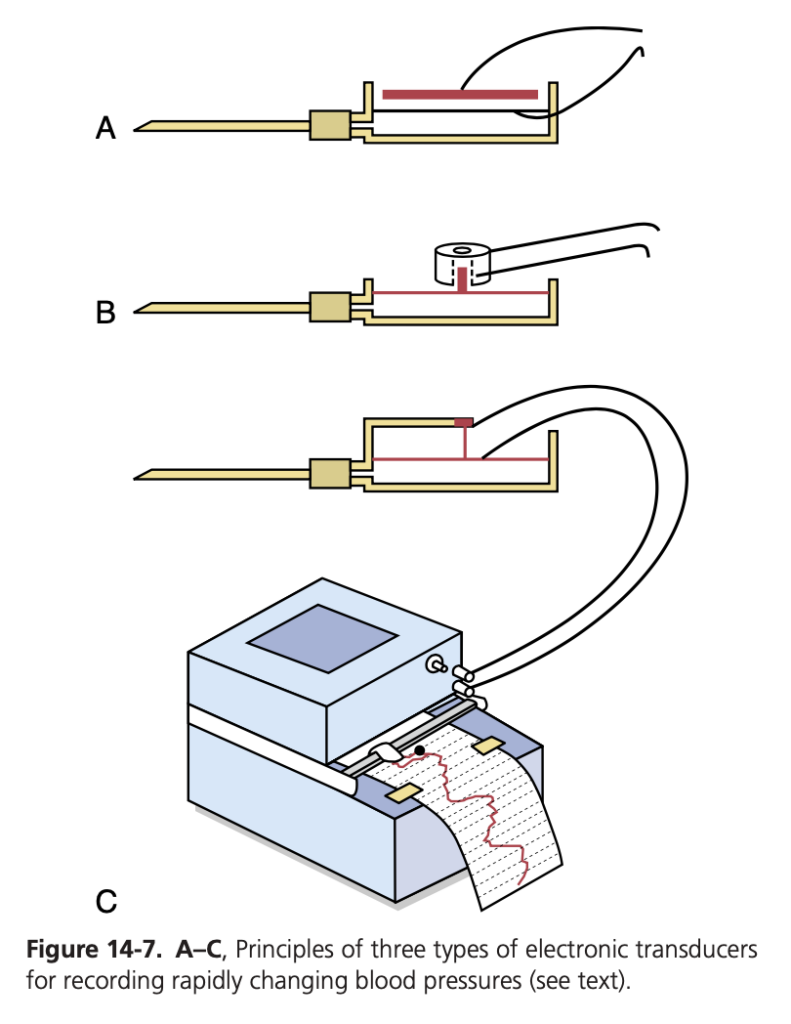
図14-7では、血圧や急激な圧力変化を電気信号(electrical signals)に変換し、その信号を高速度電気記録装置(electrical recorder)に記録するために使用される3つの電子圧力トランスデューサ(electronic pressure transducers)の基本原理が示されています。
血圧測定のための電子圧力トランスデューサ
これらの圧力トランスデューサ(pressure transducers)のそれぞれは、非常に薄く、強く伸ばされた金属膜(metal membrane)を使用しており、この膜は流体室の壁の一部を形成します。この流体室は、圧力を測定したい血管に挿入された針(needle)やカテーテル(catheter)を通じて接続されています。圧力が高くなると、膜がわずかに膨らみ、圧力が低くなると、膜は元の位置に戻ります。
図14-7Aでは、単純な金属板(metal plate)が膜の上に数百分のセンチメートルの距離で配置されています。膜が膨らむと、膜は板に近づき、その結果、2つの間の電気容量(electrical capacitance)が増加し、この容量の変化が適切な電子システムを使用して記録されます。
図14-7Bでは、小さな鉄の塊(iron slug)が膜の上に置かれ、鉄塊は電線コイル(wire coil)の中央の空間に上昇することができます。鉄塊がコイルの中に入るとインダクタンス(inductance)が増加し、これも電子的に記録されます。
最後に、図14-7Cでは、非常に薄い伸ばされた抵抗線(resistance wire)が膜に接続されています。この抵抗線が大きく伸ばされると抵抗(resistance)が増加し、少し伸ばされると抵抗は減少します。これらの変化も電子システムを使用して記録できます。
トランスデューサからの電気信号は、アンプ(amplifier)に送られ、適切な記録装置に送られます。これらの高忠実度タイプの記録システムでは、最大500サイクル/秒の圧力サイクル(pressure cycles)が正確に記録されています。一般的に使用されている記録装置では、図14-7Cの記録器に示されているように、20~100サイクル/秒の速さで発生する圧力変化を記録することができます。
血流に対する抵抗(Resistance to Blood Flow)
抵抗の単位(Units of Resistance):抵抗(resistance)は血管内の血流に対する妨げですが、直接測定する方法はありません。代わりに、血流量と血管内の2点間の圧力差(pressure difference)の測定値から計算されます。例えば、2点間の圧力差が1 mm Hgで、流量が1 ml/秒である場合、抵抗は1末梢抵抗単位(1 peripheral resistance unit、PRU)とされます。
抵抗をCGS単位で表現する方法
時折、CGS(センチメートル、グラム、秒)単位という基本的な物理単位(basic physical unit)が抵抗を表現するために使用されます。この単位はダイン秒/平方センチメートル(dyne sec/cm^5)です。抵抗は次の式で計算されます:
- R = 1333 × (mm Hg / ml/sec)
総末梢血管抵抗と総肺血管抵抗(Total Peripheral Vascular Resistance and Total Pulmonary Vascular Resistance)
全身循環系を通る血流量は、心臓のポンプ作用による血流量、すなわち心拍出量(cardiac output)に等しくなります。成人では、これは約100 ml/秒です。体循環系における動脈と静脈の圧力差は約100 mm Hgです。したがって、全身循環の抵抗、すなわち総末梢抵抗(total peripheral resistance)は約1 PRU(100mmHg/100ml/sec)となります。
全身の血管が強く収縮する状態では、総末梢抵抗は最大で4 PRUに上昇することがあります。逆に、血管が大きく拡張する状態では、抵抗はわずか0.2 PRUまで低下することもあります。
肺循環においては、平均肺動脈圧(mean pulmonary arterial pressure)は約16 mm Hg、平均左心房圧(mean left atrial pressure)は約2 mm Hgで、正味圧力差(net pressure difference)は14 mm(16-2mmHg)となります。したがって、心拍出量が正常な100 ml/秒である場合、総肺血管抵抗(total pulmonary vascular resistance)は約0.14 PRU(全身循環の約7分の1)となります。
血管内の血液の伝導率は抵抗の逆数である(Conductance of Blood in a Vessel Is the Reciprocal of Resistance)
伝導率(conductance)は、一定の圧力差で血管を通る血流量を測定する指標です。この測定値は通常、ml/秒/mm Hg(ml/sec per mm Hg pressure)で表されますが、L/秒/mm Hgや他の単位で表すことも可能です。
伝導率は抵抗の逆数であるため、次の式で表されます:
- Conductance = 1 / Resistance
伝導率は抵抗に反比例する。
血管径のわずかな変化が伝導率に大きな影響を与える(Small Changes in Vessel Diameter Markedly Change Its Conductance)
血管の直径(diameter)がわずかに変化するだけで、血液を通す能力は大幅に変わります。この現象は図14-8Aに示されており、直径が1、2、4の3つの血管が同じ圧力差(100 mm Hg)を持っている場合を示しています。これらの血管の直径は4倍しか増加していないにもかかわらず、血流量はそれぞれ1、16、256 ml/分であり、血流量は256倍に増加しています。したがって、血管の伝導率は直径の4乗に比例して増加します。この関係は次の式で表されます:
- Conductance ∝ Diameter^4
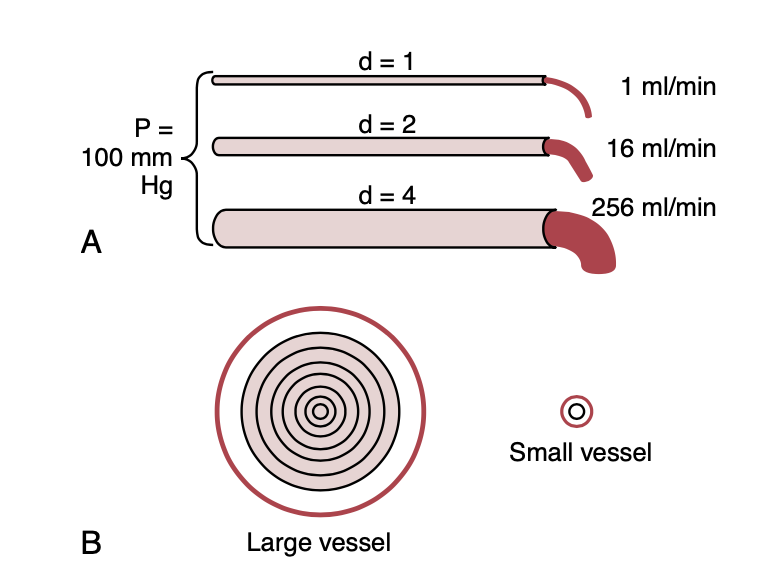
Figure 14-8. A, Demonstration of the effect of vessel diameter on blood flow. B, Concentric rings of blood flowing at different veloci- ties; the farther away from the vessel wall, the faster the flow. d, diameter; P, pressure difference between the two ends of the vessels.
ポスワの法則(Poiseuille’s Law)
直径が増加することで伝導率が大幅に増加する理由は、図14-8Bに示されているように、大きな血管(large vessel)と小さな血管(small vessel)の断面を比較すると説明できます。血管の内側の同心円の層は、それぞれの流速が異なることを示しており、これは層流(laminar flow)の結果です。血管壁に接している血液は、血管内皮(vascular endothelium)に付着しているため、ほとんど流れていません。隣の層の血液は最初の層を越えて流れるため、やや速く流れます。同様に、次の層、さらにその次の層と、内側の層になるほど流速は増加します。このように、血管の壁付近の血液はゆっくりと流れますが、中央部分の血液ははるかに速く流れます。
小さな血管では、血液のほとんどが壁に近いため、中央流れ(central stream)の血液は実質的に存在しません。流れる血液の各層の速度をすべて積分し、それらの層の面積で掛け算することによって、次の式で示されるポアズイユの法則(Poiseuille’s Law)を導くことができます:
- F = (πΔPr^4) / (8ηl)
ここで、Fは血流量(rate of blood flow)、ΔPは血管の両端の圧力差(pressure difference)、rは血管半径(radius)、lは血管長(length)、ηは血液の粘度(viscosity)です。
この式において特に注目すべきは、血流量が血管の半径の4乗に直接比例するということです。これにより、血管の直径(diameter)が血流量の決定において非常に重要な役割を果たすことが示されています。
血管径の4乗則が細動脈の抵抗を決定する重要性(Importance of the Vessel Diameter Fourth Power Law in Determining Arteriolar Resistance)
体循環(systemic circulation)において、全体の全身血流抵抗(total systemic resistance)の約3分の2は、細動脈(arterioles)での抵抗に由来します。細動脈の内径(internal diameter)は、約4ミクロンから25ミクロンの範囲にありますが、その強力な血管壁により、内径は大幅に変化します。場合によっては、直径が4倍になることもあります。前述の血管径に対する4乗則(fourth power law)に基づくと、血管径が4倍になると血流は256倍に増加する可能性があります。このため、細動脈は神経信号(nervous signals)や局所組織の化学的信号(local tissue chemical signals)にわずかに反応して、組織への血流をほぼ完全に停止させたり、逆に大量の血流を引き起こすことができます。実際に、細動脈の最大収縮(maximum arteriolar constriction)と最大拡張(maximum dilation)の間で、ある組織領域における血流の100倍以上の範囲が記録されています。
直列および並列の血管回路での血流抵抗(Resistance to Blood Flow in Series and Parallel Vascular Circuits)
心臓から送り出された血液は、高圧側(high-pressure side)の大動脈(aorta)から低圧側(low-pressure side)の大静脈(vena cava)まで流れ、多くの血管を経由します。これらの血管は、直列(series)および並列(parallel)に配置されています。動脈(arteries)、細動脈(arterioles)、毛細血管(capillaries)、細静脈(venules)、および静脈(veins)は、直列に配置されています。直列に配置された血管では、各血管を通る血流は同じであり、総血管抵抗(total vascular resistance:Rtotal)は、各血管の抵抗の合計に等しくなります。
- Rtotal = R1 + R2 + R3 + …
したがって、総末梢血管抵抗(total peripheral vascular resistance)は、動脈、細動脈、毛細血管、細静脈、および静脈の抵抗の合計に等しくなります。図14-9Aに示されている例では、総血管抵抗はR1とR2の合計に等しいです。
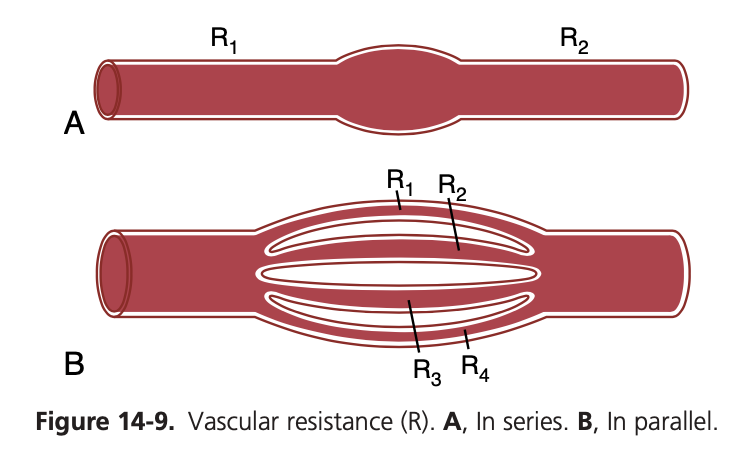
血管は、広範に枝分かれして並列回路(parallel circuits)を形成し、体内の多くの臓器や組織に血液を供給します。この並列配置により、各組織は他の組織への血流とは独立して自分自身の血流を調整できるようになります。
図14-9Bに示されているように、並列に配置された血管では、総抵抗は次のように表されます:
- 1/Rtotal = 1/R1 + 1/R2 + 1/R3 + …
この式から明らかなように、並列システムでは、与えられた圧力勾配(pressure gradient)に対して、個々の血管よりもはるかに多くの血液が流れます。したがって、総抵抗はどの単一血管の抵抗よりもはるかに低くなります。各並列血管を流れる血流は、圧力勾配(pressure gradient)とその血管自体の抵抗によって決まりますが、他の並列血管の抵抗には依存しません。しかし、どの血管の抵抗が増加しても、総血管抵抗(total vascular resistance)は増加します。
並列回路に血管が追加されると、総血管抵抗が減少するというのは一見逆説的(paradoxical)に思えるかもしれません。しかし、多くの並列血管が存在すると、それぞれの並列血管が別の経路(pathway)を提供するため、血液が回路を流れやすくなります。総伝導率(Ctotal)は、各並列経路の伝導率の合計として次のように表されます:
- Ctotal = C1 + C2 + C3 + …
例えば、脳(brain)、腎臓(kidney)、筋肉(muscle)、消化管(gastrointestinal tract)、皮膚(skin)、および冠循環(coronary circulation)は並列に配置されており、各組織は全身循環の伝導率に寄与しています。各組織を流れる血流は心拍出量(cardiac output)の一部であり、組織血流の抵抗(tissue resistance)および圧力勾配によって決定されます。そのため、四肢の切断や腎臓の外科的切除は、並列回路を除去し、総伝導率および総血流量(心拍出量)を減少させると同時に、総末梢血管抵抗を増加させます。
血液のヘマトクリットと粘度が血管抵抗と血流に与える影響(Effect of Blood Hematocrit and Blood Viscosity on Vascular Resistance and Blood Flow)
ポアズイユの法則(Poiseuille’s Law)において、もう一つ重要な要素は血液の粘度(viscosity)です。粘度が高くなると、他の要因が一定であれば、血管内の血流量は減少します。さらに、正常血液(normal blood)の粘度は水の約3倍です。
では、何が血液を粘性にするのでしょうか?主な要因は、血液中に浮遊している大量の赤血球(red blood cells)です。これらの赤血球は、お互いに、そして血管壁に対して摩擦を引き起こします。
ヘマトクリット(Hematocrit)— 血液中の赤血球の割合
人がヘマトクリット(hematocrit)40を持つ場合、これは血液の40%が細胞成分(cells)であり、残りが血漿(plasma)であることを意味します。成人男性の平均ヘマトクリットは約42、女性では約38です。これらの値は、貧血の有無、身体活動の程度、居住地の高度によって大きく異なることがあります。これらのヘマトクリットの変化は、第33章で赤血球および酸素輸送機能に関連して説明されています。
ヘマトクリットは、図14-10に示されているように、校正された遠心管(centrifuge tube)で血液を遠心分離することによって決定されます。この校正により、細胞の割合を直接読み取ることができます。
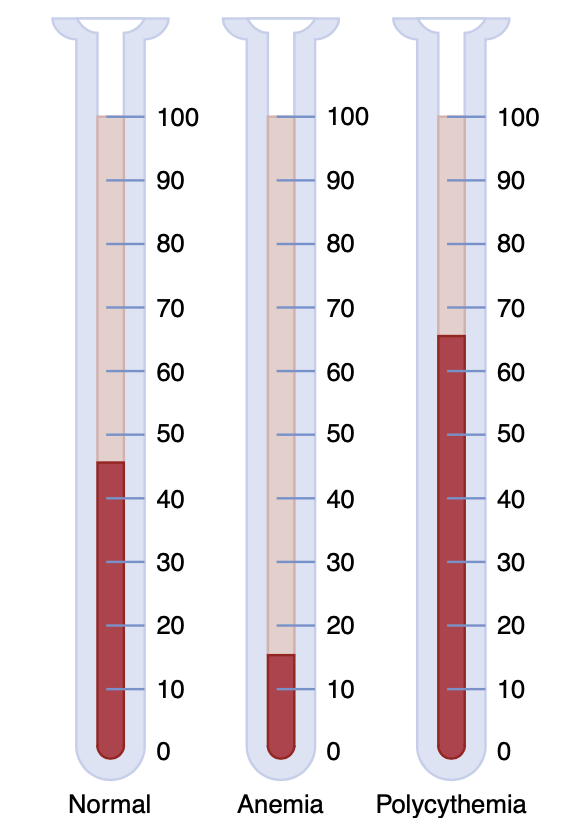
Figure 14-10. Hematocrit values in a healthy (normal) person and in patients with anemia and polycythemia. The numbers refer to the percentage of the blood composed of red blood cells.
ヘマトクリットの増加が血液粘度を著しく増加させる(Increasing Hematocrit Markedly Increases Blood Viscosity)
図14-11に示されているように、ヘマトクリットが増加すると血液の粘度は著しく増加します。正常なヘマトクリットを持つ全血の粘度は約3~4であり、これは水と比較して同じ血管を通過するのに3~4倍の圧力が必要であることを意味します。多血症(polycythemia)を持つ人では、ヘマトクリットが60または70に達することがあり、その場合、血液の粘度は水の10倍にも達し、血管を通る血流が著しく遅くなります。
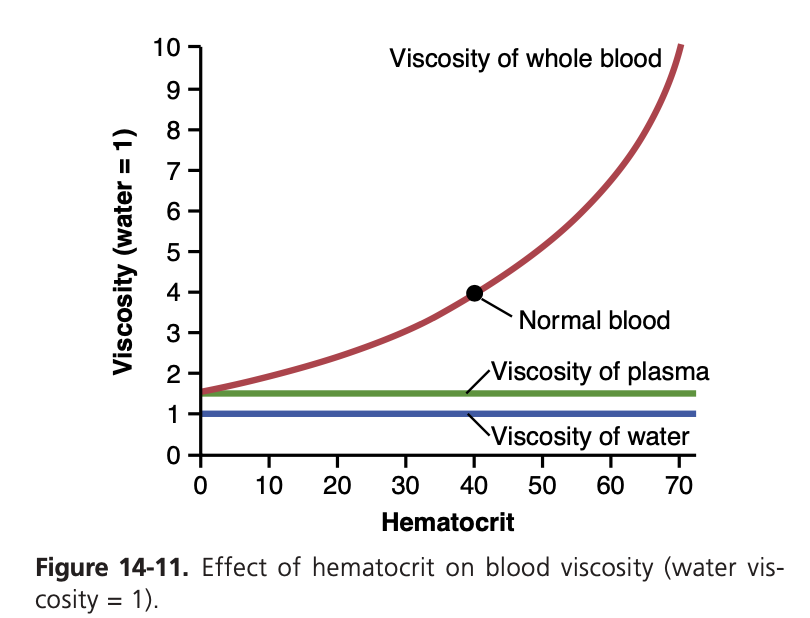
血液粘度に影響を与える他の要因としては、血漿タンパク質濃度(plasma protein concentration)および血漿中のタンパク質の種類(types of proteins)がありますが、これらの影響はヘマトクリットの影響に比べてはるかに小さいため、ほとんどの血行力学的研究では重要な考慮事項とはされていません。血漿の粘度は水の約1.5倍です。
圧力が血管抵抗および組織血流に与える影響
自動調節は動脈圧が組織血流に与える影響を軽減する(Autoregulation Attenuates the Effect of Arterial Pressure on Tissue Blood Flow)
これまでの議論から、動脈圧(arterial pressure)の上昇は体内の組織を通る血流量の比例的な増加を引き起こすと予想されるかもしれません。しかし、図14-12に示されているように、動脈圧が血流に与える影響は、一般に予想よりもはるかに小さくなります。これは、動脈圧の上昇が血液を血管内に押し進める力を増加させるだけでなく、数秒以内に局所制御メカニズム(local control mechanisms)を活性化して、血管抵抗(vascular resistance)を補償的に増加させるためです(これについては第17章で詳しく説明します)。逆に、動脈圧が低下すると、ほとんどの組織で血管抵抗が即座に減少し、血流が比較的一定の状態に保たれます。動脈圧の変化に対して、各組織が血管抵抗(vascular resistance)を調整し、血流を正常に維持する能力を「血流自動調節(blood flow autoregulation)」と呼びます。
図14-12に示されているように、強力な交感神経刺激(sympathetic stimulation)は血管を収縮させ、血流を一時的に減少させることがあります。同様に、ノルエピネフリン(norepinephrine)、アンジオテンシンII(angiotensin II)、バソプレッシン(vasopressin)、またはエンドセリン(endothelin)などのホルモン性血管収縮因子(hormonal vasoconstrictors)も一時的に血流を減少させることがあります。
しかし、動脈圧が持続的に上昇した場合や、血管収縮因子のレベルが上昇した場合でも、ほとんどの組織では数時間以内に血流の変化は通常、短期間に終わります。この理由は、各組織の局所自動調節メカニズム(local autoregulatory mechanisms)が、血管収縮因子の影響を最終的に上回り、組織のニーズに応じた血流を提供するためです。
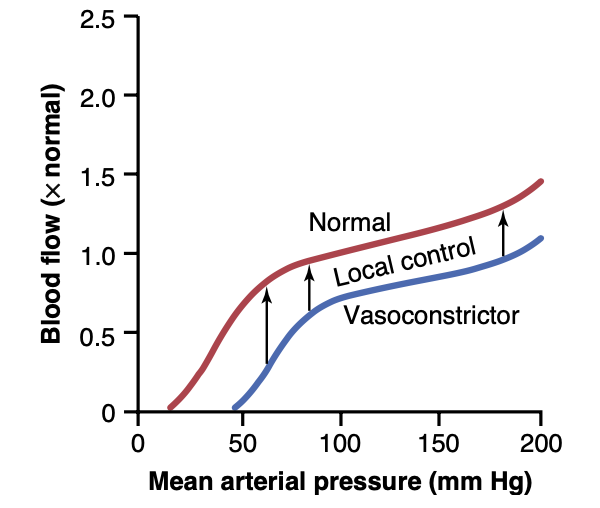
Figure 14-12. Effect of changes in arterial pressure over a period of several minutes on blood flow in a tissue such as skeletal muscle. Note that between pressures of 70 and 175 mm Hg, blood flow is autoregulated. The blue line shows the effect of sympathetic nerve stimulation or vasoconstriction by hormones such as norepineph- rine, angiotensin II, vasopressin, or endothelin on this relationship. Reduced tissue blood flow is rarely maintained for more than a few hours because of the activation of local autoregulatory mechanisms that eventually return blood flow toward normal.
受動的血管床における圧力と血流の関係(Pressure-Flow Relationship in Passive Vascular Beds)
孤立した血管(isolated blood vessels)や自動調節(autoregulation)を示さない組織では、動脈圧の変化が血流に重要な影響を与えることがあります。圧力が血流に与える影響は、ポアズイユの法則で予測されるよりも大きくなる場合があります。これは、動脈圧の上昇が血液を血管内に押し進める力を増加させるだけでなく、弾性のある血管を拡張させ、実際に血管抵抗(vascular resistance)を減少させるためです。逆に、動脈圧の低下は弾性血管が徐々に収縮し、抵抗が増加します。圧力が臨界閉鎖圧(critical closing pressure)と呼ばれるレベル以下に低下すると、血管が完全に閉塞し、血流が停止します。
交感神経刺激(sympathetic stimulation)や他の血管収縮因子は、図14-13に示されている受動的圧力-血流関係を変更することができます。交感神経活動が抑制されると血管が大幅に拡張し、血流が2倍以上に増加することがあります。逆に、非常に強力な交感神経刺激は、血管を非常に収縮させることがあり、高い動脈圧にもかかわらず血流が一時的にゼロになることもあります。
実際の生理的条件下では、組織が図14-13に示されているような受動的圧力-血流関係を示すことはほとんどありません。動脈圧の急性変化に対して効果的に血流を自動調節しない組織でも、圧力変化が持続すると、組織のニーズに応じて血流が調節されます(これについては第17章で詳しく説明します)。

Figure 14-13. Effect of arterial pressure on blood flow through a passive blood vessel at different degrees of vascular tone caused by increased or decreased sympathetic stimulation of the vessel.
血管壁の張力(Vascular Wall Tension)
血管壁の張力(wall tension)は、内外圧差(transmural pressure gradient)に応じて発生し、血管平滑筋(vascular smooth muscle)および内皮細胞(endothelial cells)がすべての方向に伸展されます(図14-14A)。ラプラスの法則(law of Laplace)によれば、薄壁の管における張力(T)は、内外圧差(ΔP)に比例し、血管の半径(radius:r)を壁の厚さ(wall thickness:h)で割った値となります:
- T = ΔP × (r/h)
したがって、高圧にさらされる大きな血管(例:大動脈)は、より高い張力に耐えるために強力な壁を持つ必要があり、通常、コラーゲン繊維の線維帯(fibrous bands)で強化されています。これに対して、毛細血管(capillaries)は半径が非常に小さいため、張力が非常に低く、腎臓(kidneys)のような臓器では65〜70 mm Hgの高圧にも耐えることができます。第17章で説明するように、血圧の慢性的な変化(chronic changes in blood pressure)は、血管の構造的な再構築を引き起こし、壁張力の変化に対応します。
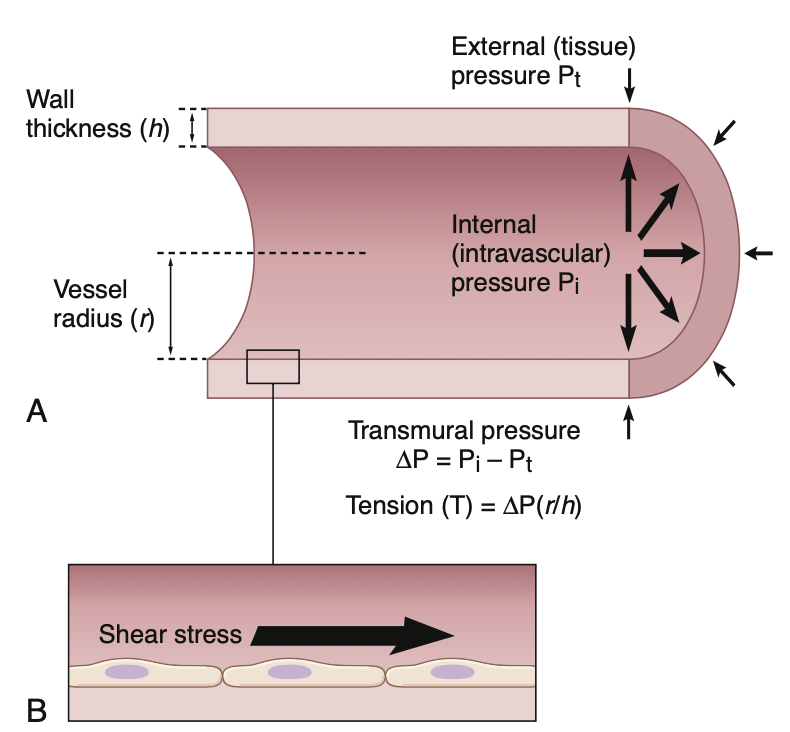
Figure 14-14. Illustration of the effects of vessel wall tension and shear stress on blood vessels. Wall tension develops in response to transmural pressure gradients and causes stretch of endothelial and vascular smooth muscle cells in all directions. Shear stress is the fric- tional force or drag on endothelial cells caused by flowing blood. Shear stress results in unidirectional endothelial cell deformation.
血管せん断応力(Vascular Shear Stress)
血液が流れるとき、血管内皮細胞(endothelial cells)に摩擦力(frictional force)が生じます(図14-14B参照)。この力はせん断応力(shear stress)と呼ばれ、流速(flow velocity)と血液の粘度に比例し、血管の半径の3乗に反比例します。この応力は通常、力/単位面積(dynes/cm²)で表されます。臨床的には、せん断応力を測定するための一般的に使用される単一の方法は存在しません。しかし、せん断応力の大きさは、血圧(blood pressure)による壁の伸展や収縮力(contractile forces)に比べて比較的小さいものの、血管系の発達や適応において重要です。内皮細胞には複数のタンパク質が含まれており、それらが機械センサー(mechanical sensors)として作用し、胚発生(embryonic development)中に血管を形成し続け、成体(adult life)においても組織に適切な血流を供給するために血管の形態(blood vessel morphology)を最適化します(第17章でさらに詳しく説明します)。


コメント