Contents
- 1 心筋、ポンプとしての心臓と心臓弁の機能
- 2 心筋の活動電位
- 3 興奮収縮連関(Excitation-Contraction Coupling)-カルシウムイオンと横細管の役割
- 4 心周期(Cardiac Cycle)
- 5 心室のポンプ機能
- 6 心音と心臓のポンプ機能の関係
- 7 心臓の仕事出力(Work Output of the Heart)
- 8 心室ポンプのグラフィカル解析
- 9 容積圧力図と心臓の仕事出力
- 10 前負荷(Preload)と後負荷(Afterload)の概念
- 11 心筋収縮に必要な化学エネルギー: 心臓の酸素消費量
- 12 心臓の効率
- 13 心臓のポンプ機能の調節
- 14 心臓ポンプの内因性調節 – フランク-スターリング機構
- 15 交感神経と副交感神経による心臓の制御
- 16 カリウムイオンとカルシウムイオンが心臓機能に与える影響
- 17 温度が心臓機能に与える影響
- 18 動脈圧の増加が心拍出量に与える影響
心筋、ポンプとしての心臓と心臓弁の機能
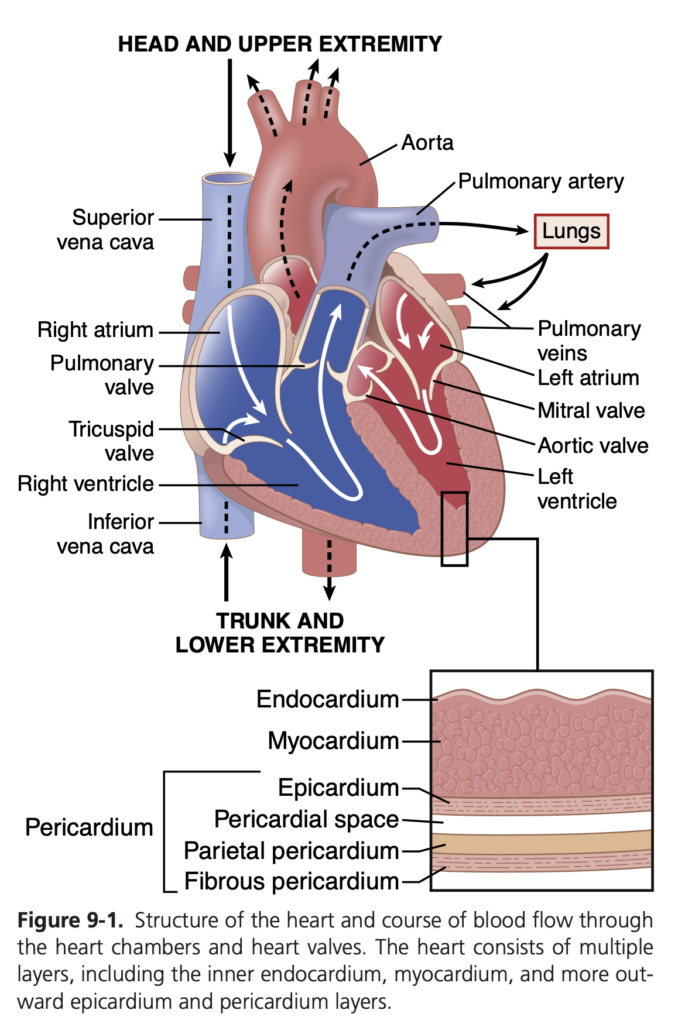
心臓は、図9-1に示されるように、実際には2つの独立したポンプから成り立っています。右心系(right heart)は肺を通じて血液を送り、左心系(left heart)は全身循環(systemic circulation)を通じて他の臓器や組織に血液を供給します。各心系は、心房(atrium)と心室(ventricle)の2つの部屋からなる拍動性のポンプです。心房は心室への血液の移動を助ける弱い予備ポンプとして機能し、心室が主要なポンプ力を提供して、血液を(1)右心室から肺循環(pulmonary circulation)に、または(2)左心室から全身循環に送ります。心臓は、心臓を保護し位置を固定する2層の膜「心膜(pericardium)」で包まれています。
心臓には、心臓のリズミカルな拍動を引き起こす特殊なメカニズムが備わっており、活動電位(action potential)が心筋全体に伝わり、リズミカルな拍動が続きます。このリズムを制御するシステムについては、第10章で詳しく説明します。本章では、心臓がポンプとしてどのように機能するかを、まず心筋の特別な特徴から説明していきます。
心筋の生理学
心臓は大きく分けて3つのタイプの心筋で構成されています:心房筋(atrial muscle)、心室筋(ventricular muscle)、および特殊な興奮性・伝導性筋繊維(specialized excitatory and conductive muscle fibers)です。心房筋と心室筋は、骨格筋(skeletal muscle)とほぼ同じように収縮しますが、収縮の持続時間は骨格筋よりも長いです。一方、特殊な興奮性・伝導性筋繊維は、収縮力が弱く、収縮性フィブリル(contractile fibrils)がほとんど含まれていませんが、リズミカルな電気的放電を自動的に行い、活動電位を心臓全体に伝導します。これにより、心臓のリズミカルな拍動が制御されます。
心筋の解剖学
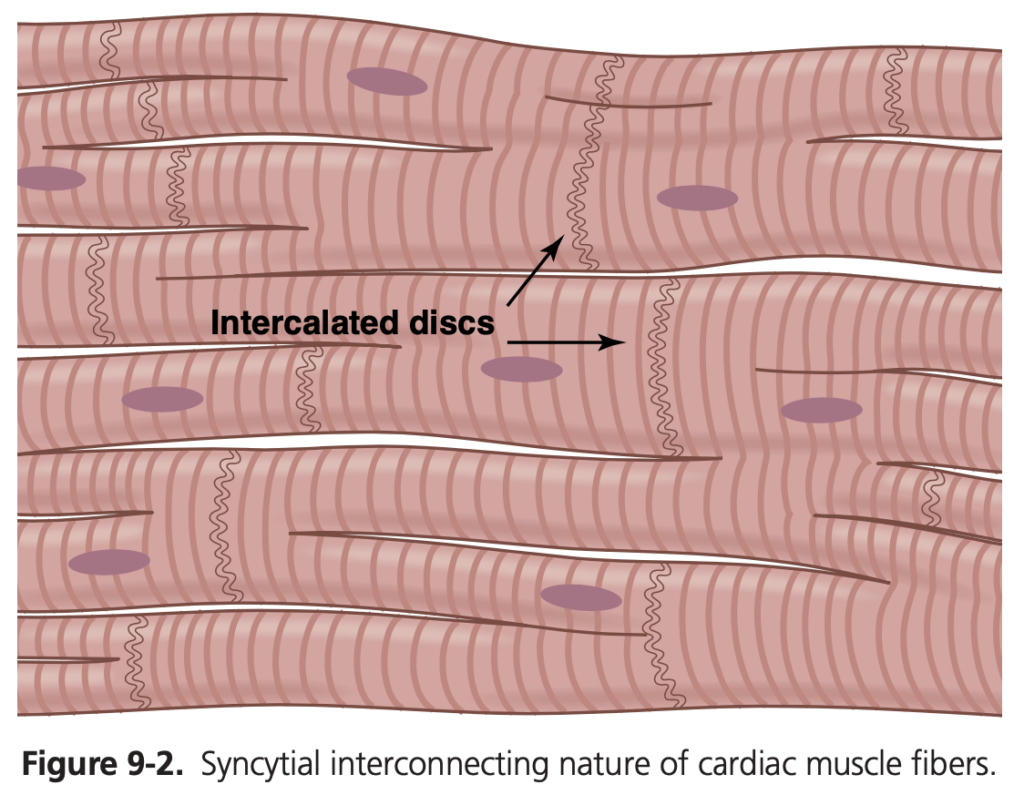
図9-2に示されるように、心筋の繊維は格子状に配置されており、繊維は分岐し再結合した後、再び広がります。心筋は骨格筋と同じように横紋構造(striated)を持っており、さらにアクチン(actin)とミオシン(myosin)フィラメントを含む典型的な筋原線維(myofibrils)も備えています。これらのフィラメントは骨格筋と同様に、収縮中に横に並んで滑ります(詳細は第6章を参照)。しかし、心筋は他の面で骨格筋と異なります。
左心室の回転(ねじり)が収縮と弛緩を助ける
左心室(left ventricle)は、複雑な筋繊維層からなり、それぞれ異なる方向に走っています。これにより、収縮期(systole)にはねじれ運動が生じます。外側の層である心外膜下層(subepicardial layer)は左方向に、内側の層である心内膜下層(subendocardial layer)は右方向にねじれ、左心室の基底部は反時計回り、心尖部は時計回りに回転します(図9-3)。この運動により、左心室はしぼるような動きをし、基底部が心尖部に向かって引き下げられます。収縮の終わりには、左心室はバネのように弾性エネルギーを蓄え、弛緩期(diastole)には急速に元の形に戻り、血液がポンプ室に流れ込みやすくなります。

心筋はシンシチウムである
図9-2で示される心筋繊維に交差する暗い部分は、介在板(intercalated discs)と呼ばれるもので、これは心筋細胞同士を隔てる細胞膜です。心筋繊維は、いくつもの個々の細胞が縦横に連結して構成されています。各介在板では、細胞膜が融合し、イオンの急速な拡散を可能にする透過性のある接合部(ギャップ結合、gap junction)を形成しています。機能的には、イオンは心筋繊維の縦軸に沿って容易に移動し、活動電位が隣接する心筋細胞に素早く伝達されます。このため、心筋は多くの心筋細胞からなるシンシチウム(syncytium)であり、一つの細胞が興奮すると、その活動電位はすぐにすべての細胞に伝わります。
心臓は実際には2つのシンシチウムから成り立っており、心房シンシチウム(atrial syncytium)は両心房の壁を構成し、心室シンシチウム(ventricular syncytium)は両心室の壁を構成します。心房と心室は、房室弁(atrioventricular valve)開口部を囲む線維組織(fibrous tissue)によって隔てられています。通常、この線維組織を通じて心房シンシチウムから心室シンシチウムへ直接的に電位が伝導されることはありません。代わりに、房室束(A-V bundle)と呼ばれる特殊な伝導系を通じてのみ伝導されます。
心筋の活動電位
心筋の活動電位は、図9-4に示されるように、平均して約105ミリボルトです。これは、心室筋繊維の細胞内電位が拍動の間に-85ミリボルトという非常に負の値から、拍動中には+20ミリボルトのわずかに正の値にまで上昇することを意味します。初期のスパイクの後、膜は約0.2秒間脱分極(depolarization)を維持し、プラトー(plateau)が現れ、その後急速に再分極(repolarization)します。このプラトーの存在により、心筋の収縮は骨格筋に比べて最大で15倍長く続きます。

心筋の長い活動電位とプラトーの原因
心筋と骨格筋の膜特性の少なくとも2つの主な違いが、心筋での長い活動電位とプラトーを説明します。まず、骨格筋の活動電位は主に、急速にナトリウムイオン(sodium ions)が細胞外液から筋線維内に大量に流入する「速いナトリウムチャネル(fast sodium channels)」の突然の開口によって引き起こされます。これらのチャネルは「速いチャネル」と呼ばれ、その開口はわずか数千分の一秒で終了し、その後急速に閉じます。この閉鎖の直後に再分極が起こり、活動電位は約さらに千分の一秒で終了します。
一方、心筋の活動電位は、2種類のチャネルの開口によって引き起こされます。(1)骨格筋と同じく電圧依存性の速いナトリウムチャネル、そして(2)L型カルシウムチャネル(slow calcium channels、カルシウム・ナトリウムチャネルとも呼ばれる)という別のタイプのチャネルです。この2番目のチャネルは、速いナトリウムチャネルよりも開口が遅く、さらに重要なのは、数十分の1秒間開いたままであることです。この間に、大量のカルシウムイオン(calcium ions)とナトリウムイオンがこれらのチャネルを通じて心筋繊維内に流入し、長時間の脱分極を維持して活動電位のプラトーを引き起こします。さらに、このプラトー相に流入するカルシウムイオンは、心筋の収縮過程を活性化しますが、骨格筋の収縮を引き起こすカルシウムイオンは、主に細胞内の筋小胞体(sarcoplasmic reticulum)から供給されます。
心筋と骨格筋のもう1つの主要な機能的違いは、活動電位の発生直後、心筋の膜のカリウムイオン(potassium ions)に対する透過性が約5倍低下することです。この効果は骨格筋では見られません。このカリウム透過性の低下は、カルシウムチャネルを通じてのカルシウムイオンの過剰流入による可能性があります。いずれにせよ、カリウム透過性の低下は、活動電位のプラトー中に正に帯電したカリウムイオンの流出を大幅に減少させ、活動電位電圧が安静レベルに早く戻るのを防ぎます。0.2~0.3秒後にカルシウム・ナトリウムチャネルが閉じ、カルシウムイオンとナトリウムイオンの流入が停止すると、カリウムイオンの透過性が急速に増加します。この時点でカリウムの流出が急速に増加し、膜電位が安静レベルに戻り、活動電位が終了します。
心筋活動電位の各相
通常、心筋細胞の静止膜電位(Resting Membrane Potential)は約 -80mV から -90mV です。これは、細胞の内側が外側に対して相対的に負の電荷を持っている状態を表します。
テスト出る★
図9-5は、心筋における活動電位の各相とその間に発生するイオンの流れを要約したものです。
- Phase 0(脱分極:Depolarization): 速いナトリウムチャネルが開く
心筋細胞が刺激されて脱分極すると、膜電位は正の方向に変化します。電位依存性ナトリウムチャネルが開き、ナトリウムイオンが急速に細胞内に流入して脱分極を引き起こします。膜電位は約+20ミリボルトに達した後、ナトリウムチャネルは閉じます。 - Phase 1(初期再分極:Initial repolarization): 速いナトリウムチャネルが閉じる
ナトリウムチャネルが閉じ、カリウムイオンが開いたカリウムチャネルを通じて細胞外に流出し、再分極が始まります。 - Phase 2(プラトー:Plateau): カルシウムチャネルが開き、速いカリウムチャネルが閉じる
一時的な再分極が起こった後、活動電位はカルシウムイオンの透過性増加とカリウムイオン透過性の低下によりプラトーに達します。電位依存性カルシウムチャネルはPhase 1および0の間にゆっくりと開き、カルシウムが細胞内に流入します。この結果、カリウムイオンの流出が減少し、カルシウムイオンの流入が増加して活動電位がプラトーに達します。 - Phase 3(急速再分極:Rapid repolarization): カルシウムチャネルが閉じ、遅いカリウムチャネルが開く
カルシウムチャネルの閉鎖とカリウム透過性の増加により、カリウムイオンが急速に細胞外へ流出し、膜電位が安静状態に戻ります。 - Phase 4(安静膜電位:Resting membrane potential): 安静時の膜電位は-80~-90ミリボルトです。
| Phase | Ion Movement | Membrane Potential (mV) | Channel Involved |
|---|---|---|---|
| Phase 0 (Depolarization) | Na+ influx | ~+20 | Fast Na+ channels |
| Phase 1 (Initial repolarization) | K+ efflux | Slight decrease | K+ channels |
| Phase 2 (Plateau) | Ca2+ influx, K+ efflux | Stable plateau | Ca2+ channels, K+ channels |
| Phase 3 (Rapid repolarization) | K+ efflux | Returning to -80 to -90 | K+ channels |
| Phase 4 (Resting membrane potential) | None | -80 to -90 | None |

心筋における信号伝導の速度
心房および心室筋繊維に沿った興奮性活動電位信号の伝導速度は、約0.3~0.5 m/秒です。これは、大型神経繊維に比べて約1/250の速度であり、骨格筋繊維に比べて約1/10の速度です。心臓の特殊な伝導系、特にプルキンエ線維(Purkinje fibers)では、伝導速度はほとんどの部分で約4 m/秒にも達し、心臓の異なる部位に興奮信号を迅速に伝達します(第10章で説明)。
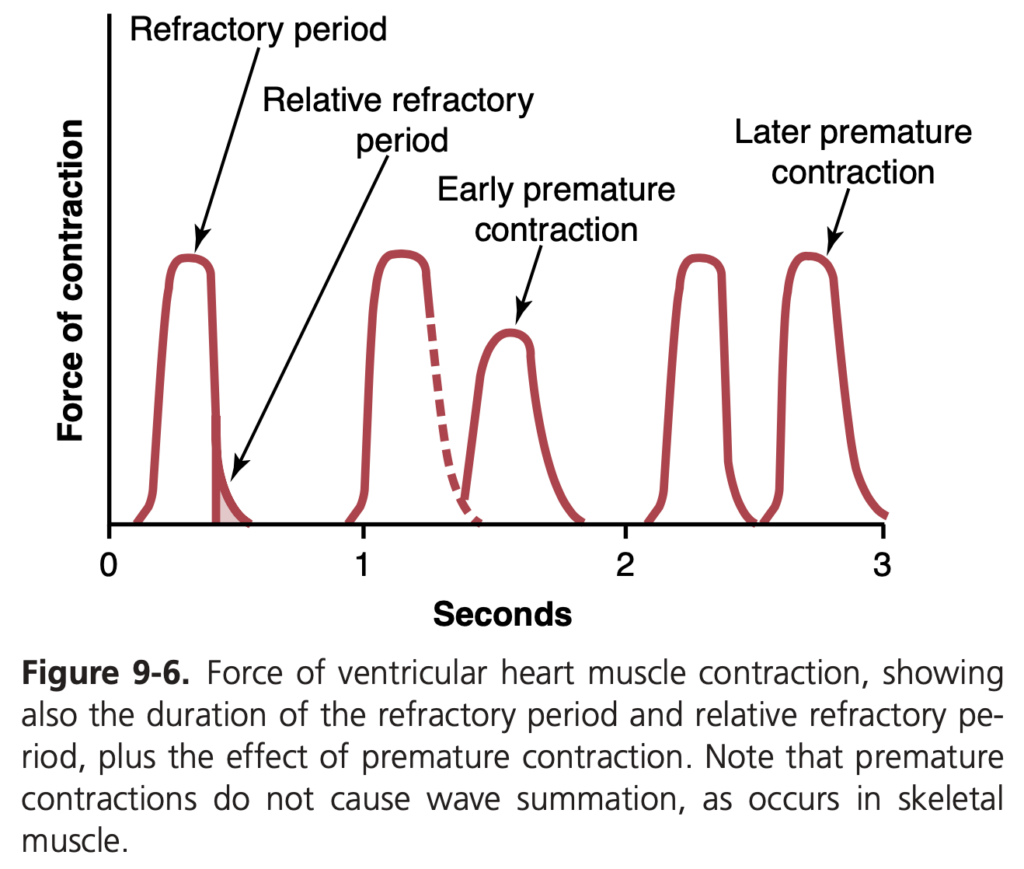
心筋の不応期
心筋はすべての興奮性組織と同様に、活動電位中に再刺激に対して不応性を示します。したがって、心臓の不応期は、既に興奮している心筋部位を再興奮させることができない時間の間隔です。心室の通常の不応期は約0.25~0.30秒で、これはプラトー活動電位の持続時間に相当します。さらに、相対不応期が約0.05秒続き、この期間中は心筋の興奮が通常よりも困難ですが、非常に強い刺激信号によって興奮させることができます。心房筋の不応期は心室筋よりも短く、約0.15秒です。
興奮収縮連関(Excitation-Contraction Coupling)-カルシウムイオンと横細管の役割
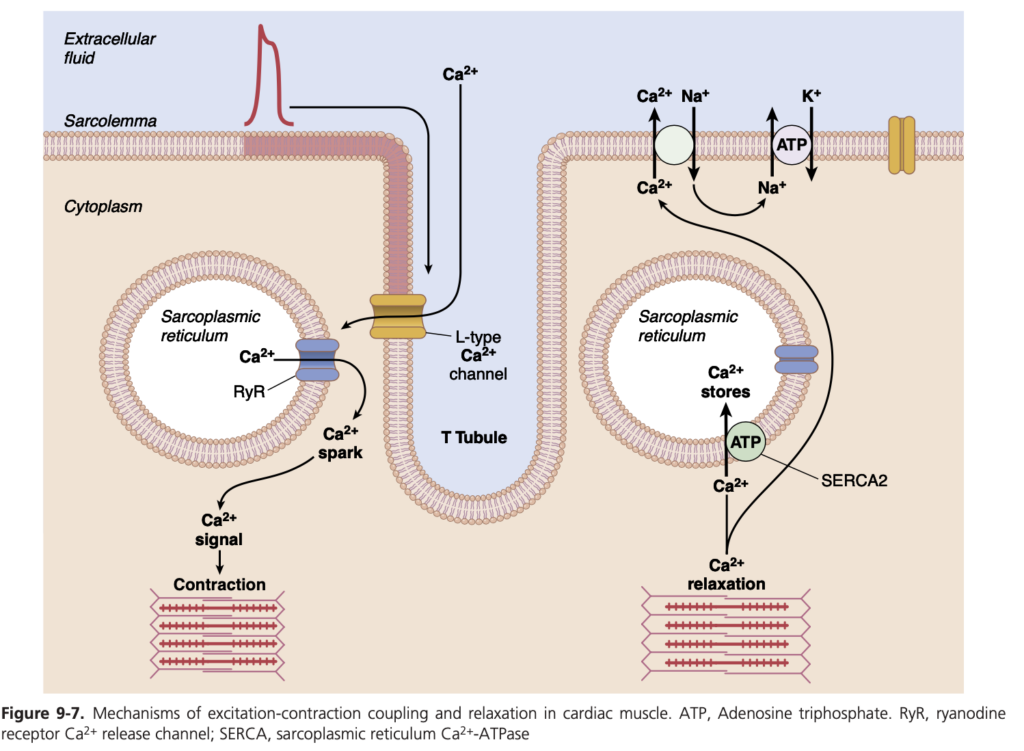
興奮収縮連関とは、活動電位(action potential)が筋線維(myofibrils)の収縮を引き起こすメカニズムを指します。このメカニズムについては、第7章で骨格筋(skeletal muscle)に関して説明しました。心筋におけるこのメカニズムには重要な違いがあり、それが心筋収縮の特性に大きく影響を与えます。
骨格筋の場合と同様に、活動電位が心筋膜を通過すると、活動電位は横細管(T tubules)の膜を介して心筋繊維の内部に広がります。この活動電位は、筋小胞体(sarcoplasmic reticulum)の膜に作用し、カルシウムイオン(calcium ions)が筋細胞質(sarcoplasm)内に放出されます。このカルシウムイオンは数千分の1秒以内に筋原線維(myofibrils)内に拡散し、アクチン(actin)とミオシン(myosin)のフィラメントが互いに滑り合う反応を触媒し、筋肉の収縮を引き起こします。
このメカニズムは骨格筋と同様ですが、心筋にはもう一つの異なる重要な効果があります。小胞体(sarcoplasmic reticulum)のシステルナから放出されるカルシウムイオンに加え、活動電位の際にT管(T tubule)からもカルシウムイオンが細胞質内に拡散します。これにより、T管の膜に存在する電位依存性カルシウムチャネル(voltage-dependent calcium channels)が開き、細胞内にカルシウムが流入します。このカルシウムは、小胞体膜のカルシウム放出チャネル(カルシウム誘発カルシウム放出、ryanodine receptor channels)を活性化し、さらにカルシウムが細胞質内に放出されます。細胞質内のカルシウムイオンはトロポニン(troponin)と相互作用し、アクチン-ミオシン架橋形成を開始します。この過程は、骨格筋で説明された機構と同様です。
もしT管からのカルシウムがなければ、心筋の収縮力は大幅に減少します。これは、心筋の筋小胞体が骨格筋のそれに比べてあまり発達しておらず、完全な収縮を引き起こすのに十分なカルシウムを蓄えていないためです。しかし、心筋のT管は骨格筋のT管よりも直径が5倍大きく、その結果、体積は25倍になります。さらに、T管内にはムコ多糖類(mucopolysaccharides)が豊富に存在し、これらは負に帯電してカルシウムイオンを保持し、T管の活動電位が発生した際にカルシウムが心筋繊維内に拡散できるようにしています。
心筋の収縮力は、細胞外液中のカルシウムイオン濃度に大きく依存します。実際、カルシウムを含まない溶液に心臓を置くと、すぐに拍動を停止します。これは、T管の開口部が心筋細胞膜を直接通り抜け、細胞を取り囲む細胞外液に接続しているためです。したがって、T管系内のカルシウムイオンの量、すなわち心筋収縮を引き起こすカルシウムイオンの供給は、細胞外液中のカルシウムイオン濃度に大きく左右されます。
一方、骨格筋の収縮力は、細胞外液中のカルシウム濃度の変化にほとんど影響を受けません。これは、骨格筋の収縮がほぼ完全に筋線維内の筋小胞体から放出されるカルシウムイオンによって引き起こされるためです。
収縮の終了
心筋活動電位のプラトーが終わると、筋繊維内へのカルシウムイオンの流入は突然停止し、カルシウムイオンは速やかに筋小胞体とT管-細胞外液空間にポンプで送り返されます。このカルシウムの戻りは、カルシウム-アデノシン三リン酸(ATP)ポンプ(サルコプラズミック小胞体カルシウムATPase、SERCA2)の助けを借りて行われます。カルシウムイオンはナトリウム-カルシウム交換体によっても細胞から排出され、交換中に細胞内に入ったナトリウムはナトリウム-カリウムATPaseポンプによって再び細胞外へと排出されます。この結果、活動電位が終わり、新しい活動電位が来るまで収縮は終了します。
収縮の持続時間
心筋は、活動電位が始まった数ミリ秒後に収縮を開始し、活動電位が終了した数ミリ秒後まで収縮を続けます。したがって、心筋の収縮の持続時間は、プラトーを含む活動電位の持続時間に大きく依存します。心房筋(atrial muscle)では約0.2秒、心室筋(ventricular muscle)では約0.3秒です。
心周期(Cardiac Cycle)
心拍が1回始まってから次の心拍が始まるまでの心臓の一連のイベントは、心周期(cardiac cycle)と呼ばれます。各心周期は、洞房結節(sinus node)で自発的に活動電位が発生することから始まります(第10章で説明)。洞房結節は右心房(right atrium)の上側壁に位置し、上大静脈(superior vena cava)の開口部付近にあります。活動電位はここから迅速に両心房を通り、次に房室束(A-V bundle)を経由して心室に伝わります。この特殊な伝導系により、心房から心室への心臓インパルスの伝達には約0.1秒の遅れが生じます。この遅れにより、心房が心室の収縮よりも先に収縮し、心室が強く収縮する前に血液が心室に送られることが可能になります。したがって、心房は心室の予備ポンプとして機能し、心室は血液を体の血管系に送り出す主要な力を提供します。
心臓周期 (cardiac cycle) は、心拍ごとに繰り返される一連のイベントを指します。これには、主に**収縮期 (systole)と拡張期 (diastole)**という2つの大きな段階があり、それぞれがさらにいくつかの小さな段階に分けられます。ここで収縮期と拡張期は、特に指定がない限り、**心室 (ventricles)**の収縮と弛緩を指します。
重要なポイント:
- 血液は**高圧 (high pressure)から低圧 (low pressure)**へ流れます。
- **収縮 (contraction)**は心室内の圧力を上げ、**弛緩 (relaxation)**は圧力を下げます。
- **房室弁 (AV valves)**は、**心房 (atria)**の圧力が心室の圧力よりも高いときに開き、逆の場合には閉じます。同様に、**半月弁 (semilunar valves)は、心室の圧力が大動脈 (aorta)や肺動脈 (pulmonary artery)**の圧力よりも高いときに開き、逆の場合には閉じます。
心臓周期のステップ:
- **洞房結節 (SA node)が興奮することで心臓のサイクルが始まり、心房が脱分極 (depolarize)します。これがP波 (P-wave)**としてECGに表示されます。心房の収縮はP波が始まってすぐに始まり、心房内の圧力が上がり、血液が心室へ押し出されます。しかし、心房の収縮は心室への充満の一部に過ぎません。この時点では、**AV弁 (atrioventricular valves)**が開いており、心室には既に受動的に血液が流れ込んでいます。
- 心房の収縮が終わると、心房内の圧力が下がり、AV弁を逆方向に閉じます。このAV弁の閉鎖が**第1心音 (S1)を引き起こし、収縮期の始まりを示します。この時点で、心室の脱分極はECGのQRS複合波 (QRS complex)**に半分ほど示され、心室は収縮を開始し、急速に圧力を高めます。
- しばらくの間、**半月弁 (semilunar valves)は閉じたままです。このフェーズは等容性収縮 (isovolumetric contraction)**と呼ばれ、血液は排出されず、心室の体積は変わりません。心室の圧力が大動脈や肺動脈の圧力を超えると、**大動脈弁 (aortic valve)と肺動脈弁 (pulmonic valve)**が開き、血液が心室から排出されます。
- これが**急速排出期 (rapid ejection phase)です。心室の再分極がT波 (T-wave)**として始まると、心室の圧力が低下し、排出力が減少します。心室の圧力が大動脈や肺動脈の圧力を下回ると、半月弁が閉じ、収縮期が終わり、拡張期が始まります。
- 半月弁の閉鎖は**第2心音 (S2)**を引き起こします。拡張期の最初の部分は再び等容性であり、心室はすべての弁が閉じたままリラックスし、圧力が急速に低下しますが、体積は変わりません。その間、心房には血液が充満し、心房の圧力が徐々に上昇します。
- 心室の圧力が心房の圧力を下回ると、AV弁が開き、血液が受動的に心室へ流れ込みます。最終的に、心房が収縮し、充満フェーズが完了し、サイクルが繰り返されます。
拡張期(Diastole)と収縮期(Systole)
心周期全体の持続時間(拡張期と収縮期を含む)は、心拍数(heart rate)の逆数です。例えば、心拍数が72拍/分の場合、心周期の持続時間は1/72分/拍、すなわち約0.833秒/拍です。
図9-8は、心臓の左側における心周期の様々なイベントを示しています。上から3つの曲線は、それぞれ大動脈(aorta)、左心室(left ventricle)、および左心房(left atrium)の圧力変化を表しています。4つ目の曲線は左心室の容積変化、5つ目は心電図(electrocardiogram)、6つ目は心音図(phonocardiogram)を示しています。心音図は、主に心臓弁(heart valves)によって生成される音を記録したものです。この図を詳しく学び、すべてのイベントの原因を理解することが重要です。
心拍数の増加による心周期の短縮
心拍数が増加すると、心周期の持続時間が短縮されますが、収縮期と弛緩期の両方が短くなります。活動電位と収縮期の持続時間も短縮されますが、拡張期の減少割合ほどではありません。通常の心拍数72拍/分では、収縮期は心周期全体の約0.4を占めます。しかし、心拍数が3倍になると、収縮期は心周期の約0.65を占めるようになります。これにより、心拍が非常に速い場合、次の収縮前に心腔が完全に充填される時間が短くなります。
心電図(Electrocardiogram)と心周期の関係
図9-8の心電図には、P波、Q波、R波、S波、およびT波が示されています(第11章および第12章で詳述)。これらは心臓によって生成される電気的な電圧であり、体表面から記録されます。
- P波: 心房全体への脱分極(depolarization)の伝播によって引き起こされ、心房の収縮がこれに続きます。これにより、P波直後に心房圧曲線がわずかに上昇します。
- QRS波: 心室の電気的脱分極の結果として現れ、心室の収縮を開始します。この時点で心室圧が上昇し始め、QRS複合波は心室収縮の開始直前に現れます。
- T波: 心室の再分極(repolarization)を表し、心室筋繊維が弛緩を開始する段階です。T波は心室収縮の終わり直前に現れます。

心周期のフェーズ(Phases of the cardiac cycle):
- 等容性収縮期(Isovolumic contraction):
- 左心室が収縮を開始し、圧力が急上昇しますが、まだ大動脈弁(aortic valve)は閉じたままです。このため心室容積(ventricular volume)は変わりません。左心室圧が大動脈圧を超えると、大動脈弁が開き、次の「駆出期(ejection)」に移行します。
- 駆出期(Ejection):
- 左心室から血液が大動脈に押し出されるフェーズで、心室容積が急激に減少します。大動脈圧(aortic pressure)は左心室圧とともに上昇し、ピークに達します。
- 等容性弛緩期(Isovolumic relaxation):
- 左心室が弛緩し、圧力が急激に低下します。この段階では、全ての弁が閉じており、心室容積は変化しません。
- 急速充満期(Rapid inflow)と拡張期(Diastasis):
- 左心房から左心室へ血液が急速に流れ込み、心室容積が増加します。A-V弁(房室弁:atrioventricular valve)は開いており、心房圧(atrial pressure)は緩やかに低下します。
- 心房収縮期(Atrial systole):
- P波の後、心房が収縮し、さらに血液が左心室に送られます。この段階で、左心室容積は最大となります。
圧力変化(Pressure changes):
- 左心室圧(Ventricular pressure)(青線):
- 左心室圧は等容性収縮期とともに急激に上昇し、駆出期でピークに達します。弛緩期には急激に低下し、拡張期には最低点になります。
- 大動脈圧(Aortic pressure)(赤線):
- 左心室から血液が大動脈に送り出されることで大動脈圧が上昇し、駆出期の終わりにピークに達します。その後、弛緩期には血液が末梢に流れることで圧力が徐々に低下します。
- 左心房圧(Atrial pressure)(点線):
- 心房収縮期に上昇し、左心房から血液が心室に流れ込むと緩やかに低下します。
心室容積(Ventricular volume):
- **最大容積(End-diastolic volume, EDV)と最小容積(End-systolic volume, ESV)**が図示されています。EDVは拡張末期に達し、心室が収縮して血液を送り出すとESVに達します。
心音図(Phonocardiogram):
- **第1音(1st heart sound)**は房室弁が閉じる際に発生し、**第2音(2nd heart sound)**は大動脈弁が閉じる際に発生します。
心電図(Electrocardiogram, ECG):
- P波は心房の脱分極を示し、QRS波群は心室の脱分極を示しています。T波は心室の再分極に対応します。
心房の役割と圧力変化
心房は心室の予備ポンプとして機能し、大静脈から心房に血液が流れ込みます。通常、心房収縮前に血液の約80%が心室に流入し、心房収縮によってさらに20%が心室に充填されます。したがって、心房は心室のポンプ効率を約20%向上させますが、心房が機能しなくても、心臓は安静時の身体に必要な血液量の300~400%を供給できるため、ほとんどの場合は問題ありません。しかし、運動中に心房が機能しない場合、心不全の症状が現れることがあります(特に息切れ)。
心房圧の変化 ― a波、c波、v波
図9-8の心房圧曲線には、a波、c波、v波という3つの小さな圧力上昇が示されています。
- a波: 心房収縮によって引き起こされます。右心房圧は通常4~6 mmHg上昇し、左心房圧は7~8 mmHg上昇します。
- c波: 心室の収縮が始まるときに発生し、心室収縮の開始時に血液がわずかに心房に逆流すること、および房室弁(A-V valves)が心房に向かって膨らむことによって引き起こされます。
- v波: 心室収縮の終わりに発生し、房室弁が閉じている間に静脈から心房にゆっくりと血液が流入することによって引き起こされます。
心室のポンプ機能
拡張期における心室への血液充填
心室の収縮期(systole)中には、房室弁(A-V valves)が閉じているため、右心房と左心房に大量の血液が溜まります。そのため、収縮期が終わり心室内圧が低下して拡張期(diastole)の低い圧力値に戻ると、心房内で増加した圧力が房室弁を押し開き、血液が急速に心室に流れ込みます(図9-8の左心室容量曲線を参照)。この期間は**急速充填期(period of rapid filling)**と呼ばれます。
健康な心臓では、この急速充填期は拡張期の最初の3分の1にあたります。拡張期の中間の3分の1では、通常、静脈から心房に流れ込む血液が直接心房を通じて少量心室に流れ込みます。拡張期の最後の3分の1では、心房が収縮し、心室への血液の流入に追加の力を与えます。この仕組みは、心周期中の心室充填量の約20%を担っています。
加齢や心臓線維症を引き起こす高血圧や糖尿病などの疾患により、心室が硬化すると、拡張期の初期に心室に充填される血液が減少し、後期の心房収縮による血液充填が重要となります。
収縮期における心室からの血液排出
等容性収縮期(Isovolumic Contraction Period): 心室収縮が始まるとすぐに、心室圧が急速に上昇し、房室弁が閉じます。その後、心室内圧が十分に上昇して大動脈弁と肺動脈弁(半月弁)を開くまで、さらに0.02~0.03秒かかります。この間、心室収縮は続きますが、血液の排出は起こりません。この期間は等容性収縮期と呼ばれ、筋繊維の長さがほとんど変化しないまま筋張力が増加します。
駆出期(Ejection Period): 左心室圧が80 mmHg(右心室圧は8 mmHg)をわずかに超えると、半月弁が開き、血液が大動脈と肺動脈に駆出されます。拡張期末の心室血液量の約60%が収縮期中に排出され、そのうち70%は駆出期の最初の3分の1で排出され、残りの30%が次の3分の2で排出されます。したがって、最初の3分の1は急速駆出期(rapid ejection period)、残りは**緩徐駆出期(slow ejection period)**と呼ばれます。
等容性弛緩期(Isovolumic Relaxation Period): 収縮期の終わりには、心室の弛緩が突然始まり、心室内圧が急速に低下します。拡張した大動脈と肺動脈内の血液が心室に戻ろうとし、半月弁が閉じます。その後0.03~0.06秒の間、心室の容積が変わらないまま心筋が弛緩し、心室内圧は急速に低下します。この期間を等容性弛緩期と呼びます。心室内圧が低い拡張期のレベルに戻ると、房室弁が開き、新しい心周期が始まります。
拡張末期容積、収縮末期容積、及び1回拍出量★
拡張期中に心室に通常充填される血液量は約110~120 mlで、これを**拡張末期容積(end-diastolic volume)と呼びます。収縮期中に心室が空になると、この容積は約70 ml減少し、これを1回拍出量(stroke volume output)と呼びます。残りの40~50 mlは収縮末期容積(end-systolic volume)です。拡張末期容積に対する駆出量の割合を駆出率(ejection fraction)**と呼び、通常約60%です。この値は、心臓の収縮力を評価するために臨床的に使用されます。CO(cardiac volume)。
心臓弁の機能
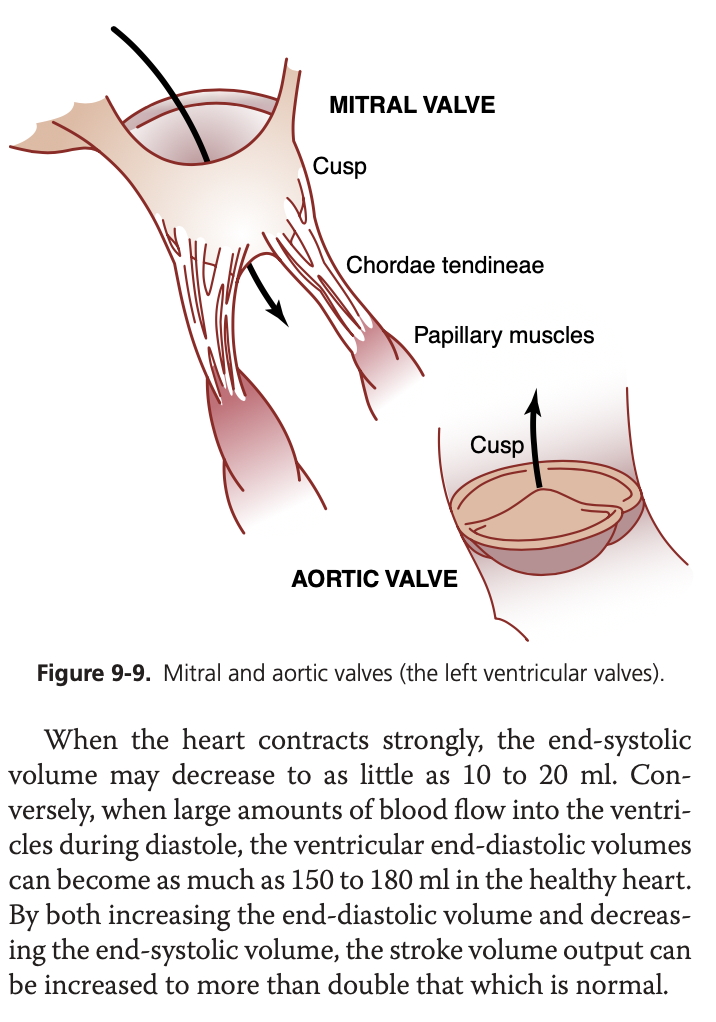
房室弁(A-V valves): 三尖弁(tricuspid valve)と僧帽弁(mitral valve)は、収縮期に心房への逆流を防ぎ、半月弁(大動脈弁と肺動脈弁)は拡張期に大動脈や肺動脈から心室への逆流を防ぎます。これらの弁は、後方圧力勾配が血液を逆流させると閉じ、前方圧力勾配が血液を前方に押し出すと開きます。
乳頭筋の役割: 房室弁には、腱索(chordae tendineae)を介して乳頭筋(papillary muscles)が付着しており、乳頭筋は心室が収縮する際に弁が過度に心房方向に膨らむのを防ぎます。
大動脈弁と肺動脈弁: これらの半月弁は、房室弁とは異なり、動脈内の高圧により素早く閉じ、血液の流速が速く、より強力な構造を持っています。
大動脈圧曲線
収縮期に左心室が収縮すると、大動脈内圧が急速に上昇し、血液が大動脈に流れ込むと圧力は120 mmHgに達します。収縮期終了後、大動脈弁が閉じると、大動脈壁の弾性により圧力は依然として高い状態が維持されます。
心音と心臓のポンプ機能の関係
聴診器で心音を聞くとき、弁の開閉音を聞くことができますが、弁が開く音は比較的ゆっくりしたプロセスで通常音を出さないため、聞こえません。しかし、弁が閉じるときには、弁の翼と周囲の液体が突然の圧力変化の影響を受けて振動し、その振動が胸部全体に音として伝わります。
心室が収縮すると、最初に房室弁(A-V valves)が閉じる音が聞こえます。この音の振動の音程は低く、比較的長く続きます。この音は**第一心音(S1)**として知られています。次に、大動脈弁と肺動脈弁が収縮期の終わりに急速に閉じると、鋭い音がします。この音は弁が素早く閉じ、周囲が短時間振動するためであり、**第二心音(S2)**と呼ばれます。
心臓の仕事出力(Work Output of the Heart)
心臓の1回拍出仕事量(stroke work output)は、心臓が血液を動脈に送り出す際に、1回の心拍でエネルギーを仕事に変換する量です。心臓の仕事出力は2つの形で行われます。1つ目は、低圧の静脈から高圧の動脈へ血液を移動させるためのエネルギーで、これは**容積圧力仕事(volume-pressure work)**または外部仕事(external work)と呼ばれます。2つ目は、血液が大動脈弁や肺動脈弁を通過して射出される際に必要な血液の加速度、つまり血流の運動エネルギーを生成するためのエネルギーです。
右心室の外部仕事出力は、左心室の仕事出力の約6分の1です。これは、両心室が送る収縮期の圧力に6倍の差があるためです。心室が生成する運動エネルギーは、排出される血液の質量と射出速度の二乗に比例します。
通常、左心室が血流の運動エネルギーを生成するために必要な仕事出力は、全体の仕事出力の約1%に過ぎないため、通常の計算では無視されます。しかし、大動脈弁狭窄(aortic stenosis)などの異常な状態では、血流が非常に速くなるため、全体の仕事出力の50%以上が運動エネルギーの生成に必要となる場合があります。
心室ポンプのグラフィカル解析
図9-10は、左心室のポンプメカニズムを説明するのに特に役立つ図です。最も重要な要素は、「拡張期圧力曲線(diastolic pressure curve)」と「収縮期圧力曲線(systolic pressure curve)」と呼ばれる2つの曲線です。これらは**容積圧曲線(volume-pressure curves)**です。
- 拡張期圧力曲線: 心臓が徐々に多くの血液で満たされる際に、心室収縮が始まる直前に測定された拡張期圧力を示します。
- 収縮期圧力曲線: 各充填量において、心室収縮時に達成された収縮期圧力を示します。
非収縮期の心室容積が約150 mlを超えるまでは、拡張期圧力はあまり上昇しません。そのため、この容積までは、血液が心房から心室に容易に流れ込みますが、150 mlを超えると急激に圧力が上昇します。これは、心臓の線維組織がこれ以上伸びず、心膜(pericardium)がほぼ限界まで拡張するためです。
心室収縮中、収縮期圧力は心室容積が少ない場合でも上昇し、150~170 mlの心室容積で最大に達します。その後、心室容積がさらに増加すると、収縮期圧力は減少します。これは、心筋のアクチン(actin)とミオシン(myosin)フィラメントが引き離され、各心筋繊維の収縮力が最適な状態を下回るためです。
図では、正常な左心室の最大収縮期圧力が250~300 mmHgであることが示されていますが、これは個々の心臓の強さや神経刺激の度合いによって大きく異なります。正常な右心室の最大収縮期圧力は60~80 mmHgです。

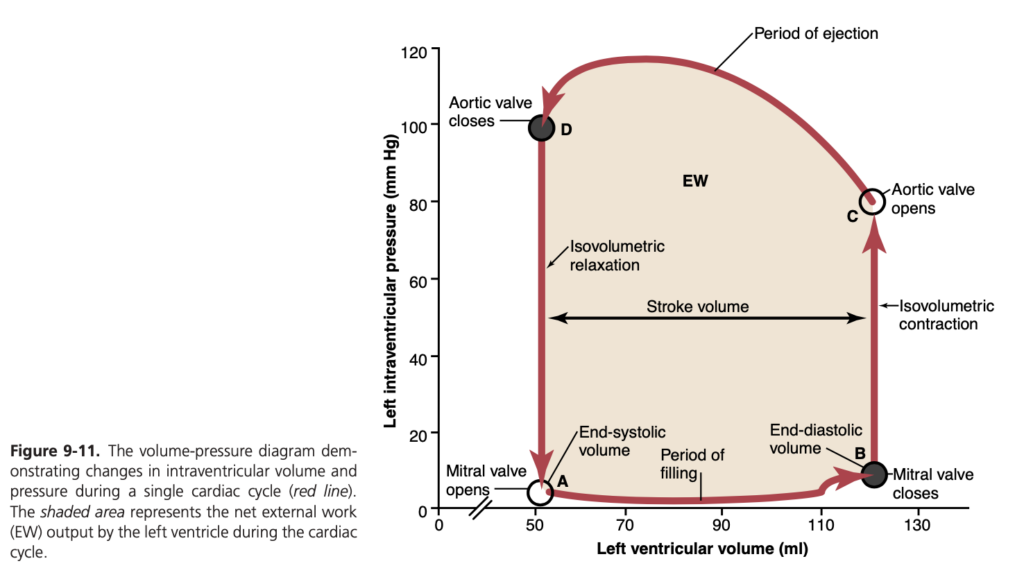
容積圧力図と心臓の仕事出力
図9-10の赤線で描かれたループは、左心室の正常な機能を示す**容積圧力図(volume-pressure diagram)**です。このループは4つのフェーズに分けられます。
- フェーズI: 充填期(Period of Filling): 心室容積が約50 mlから始まり、拡張期圧が2~3 mmHgの状態です。この段階では、静脈血が心室に流入し、心室容積は約120 ml(拡張末期容積)に増加します。
- フェーズII: 等容性収縮期(Period of Isovolumic Contraction): すべての弁が閉じているため、心室容積は変化しませんが、心室内圧は急上昇し、大動脈圧と等しくなります(約80 mmHg)。
- フェーズIII: 駆出期(Period of Ejection): 収縮期圧はさらに上昇し、大動脈弁が開くと血液が心室から排出されます。
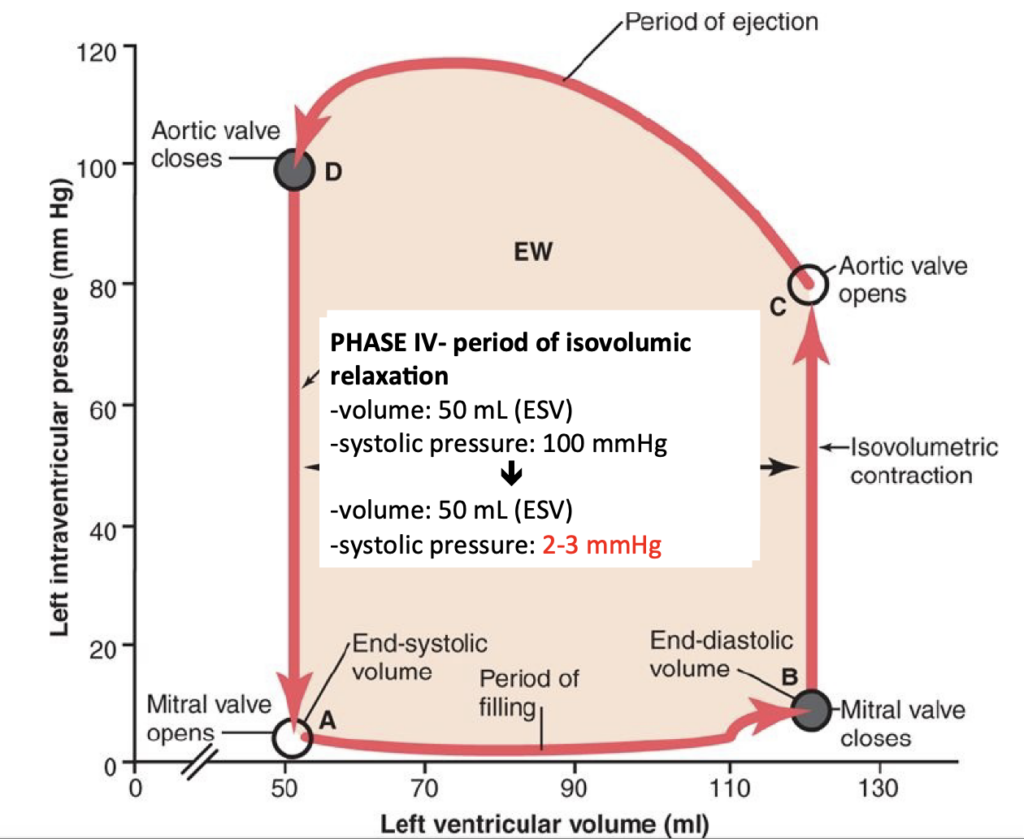
- フェーズIV: 等容性弛緩期(Period of Isovolumic Relaxation): 駆出期の終わりに大動脈弁が閉じ、心室内圧が低下して拡張期の圧力レベルに戻ります。
容積圧力図の囲まれた領域は、収縮サイクル中の心室の**外部仕事出力(external work output)**を表しています。
前負荷(Preload)と後負荷(Afterload)の概念
筋肉の収縮特性を評価する際には、筋肉が収縮を開始する際の張力を**前負荷(preload)と呼び、筋肉が収縮力を発揮する際の負荷を後負荷(afterload)**と呼びます。
心臓の収縮において、前負荷は通常、心室が充填されたときの**拡張末期圧(end-diastolic pressure)**と考えられます。一方、後負荷は心室から大動脈に向かう際の圧力、つまり大動脈圧です。
心筋収縮に必要な化学エネルギー: 心臓の酸素消費量
心筋は、骨格筋と同様に、収縮のために化学エネルギーを利用します。心臓のエネルギー源の約70~90%は脂肪酸の酸化的代謝によって供給され、残りの10~30%は主にグルコースや乳酸などの他の栄養素から得られます。したがって、心臓の酸素消費量は、心臓がその仕事を行う際に放出する化学エネルギーの良い指標となります。このエネルギーを放出する化学反応については、第68章および第69章で説明されています。
実験研究によると、心臓の酸素消費量と収縮時に消費される化学エネルギーは、図9-10の陰影部分に直接関連しています。この陰影部分は、前述した**外部仕事(External Work, EW)**に加え、**潜在的エネルギー(Potential Energy, PE)**と呼ばれる部分を含んでいます。潜在的エネルギーは、心室が完全に血液を排出できた場合に達成可能な追加の仕事を示します。
また、酸素消費量は、収縮中に発生する心筋の張力と収縮が持続する時間にほぼ比例することが示されています。これを**張力-時間指数(tension-time index)**と呼びます。ラプラスの法則に従い、心室壁の張力(T)は左心室圧(P)と半径(r)に関係し、次の式で表されます。
T = P × r
収縮期圧(すなわち左心室圧)が高い場合、張力が高くなり、それに応じて酸素消費量が増加します。収縮期圧が慢性的に高い場合、壁のストレスと心臓の仕事量が増加し、左心室の壁が肥厚(同心性肥大, concentric hypertrophy)して心室腔の半径が縮小し、壁の張力を部分的に解消することがあります。逆に、心室が異常に拡張している場合(偏心性肥大, eccentric hypertrophy)、通常の収縮期圧でも化学エネルギーの消費量が増加します。これは特に心不全の際に重要で、心室が拡張しているため、仕事出力量に対して必要な化学エネルギーが増加し、心臓がすでに機能不全を起こしているにもかかわらず、さらに多くのエネルギーを必要とする状態です。
心臓の効率
心筋の収縮中に消費される化学エネルギーの大部分は熱に変換され、残りの一部が仕事出力に変換されます。**心臓の効率(cardiac efficiency)**は、仕事出力と、仕事を行うために使用された化学エネルギーの総量との比率を表します。正常な心臓の最大効率は20~25%ですが、心不全の患者では5%にまで低下することがあります。
心臓のポンプ機能の調節
安静時には、心臓は毎分4~6リットルの血液をポンプしますが、激しい運動中にはこの量が4~7倍に増加することがあります。心臓のポンプ機能を調節する基本的なメカニズムは次の2つです。
- 心臓に流れ込む血液量の変化に応じた内因性調節(intrinsic regulation)。
- 自律神経系による心拍数と心筋収縮力の調節。
心臓ポンプの内因性調節 – フランク-スターリング機構
ほとんどの状況下で、心臓が毎分ポンプする血液量は、静脈から心臓に流れ込む血液の量(静脈還流, venous return)によって決まります。すなわち、各末梢組織が自分自身の局所血流を制御し、これらの局所血流が静脈を通って右心房に戻ります。心臓はこの血液を動脈に送り出し、再び全身に循環させます。
このように、心臓が増加する血液量に適応する内因性の能力を**フランク-スターリング機構(Frank-Starling mechanism)**と呼びます。この機構は、心臓が充填される際に筋肉が伸びるほど、収縮力が増加し、より多くの血液が大動脈に送り出されることを意味します。言い換えれば、生理学的範囲内では、心臓は静脈から戻ってくるすべての血液をポンプします。
フランク-スターリング機構の説明
心室に追加の血液が流入すると、心筋がより伸展されます。この伸展により、アクチンとミオシンフィラメントがより最適な位置に配置され、収縮力が増加します。したがって、心室は増加した血液を自動的に動脈に送り出します。このように、筋肉が最適な長さまで伸展されると、収縮力が増加し、より多くの仕事出力が得られるのは、すべての横紋筋(striated muscle)に共通する特性です。
さらに、心臓の体積が増加した際に心臓のポンプ力を増加させるもう一つの要因があります。それは、右心房壁の伸展が心拍数を10~20%増加させることです。これにより、毎分ポンプされる血液量が増加しますが、この効果はフランク-スターリング機構に比べると少ないです。また、右心房の伸展は**ベインブリッジ反射(Bainbridge reflex)**を引き起こし、迷走神経を介して心拍数をさらに40~60%増加させることがあります。
心室機能曲線
心室のポンプ機能を表現する最良の方法の一つは、**心室機能曲線(ventricular function curves)**です。図9-12は、**1回拍出仕事量曲線(stroke work output curve)**と呼ばれる心室機能曲線の一例です。心房圧が増加すると、それに伴い、心室の1回拍出仕事量も増加し、心室のポンプ能力の限界に達するまで続きます。

図9-13は、**心室容積出力曲線(ventricular volume output curve)**を示しています。この図は、動物実験のデータに基づいて人間の心臓の両心室の機能を示しています。右心房および左心房圧が増加するにつれて、それぞれの心室の1分間あたりの容積出力も増加します。
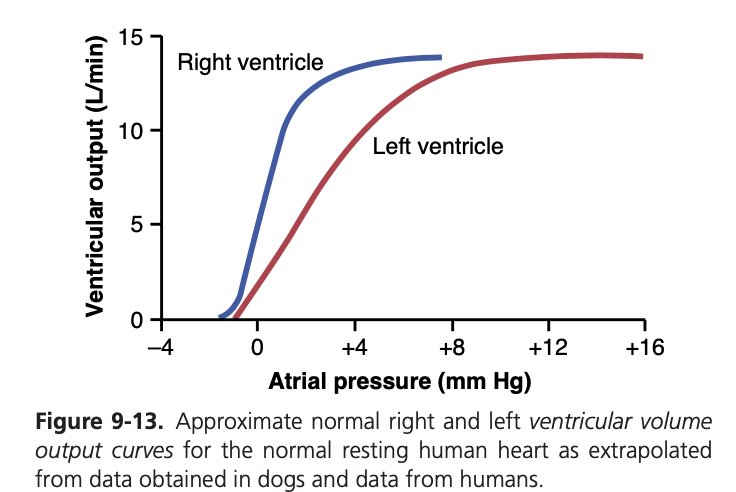
このように、心室機能曲線は心臓のフランク-スターリング機構を表現するもう一つの方法です。心房圧が上昇し、それに応じて心室が充填されると、心筋の収縮力が増加し、動脈に送り出される血液量が増加します。
交感神経と副交感神経による心臓の制御
心臓のポンプ能力は、交感神経と副交感神経(迷走神経)によっても制御されています。交感神経刺激により、心臓の1分間あたりのポンプ量(心拍出量)は100%以上増加することがあります。これに対し、迷走神経刺激により心拍出量はほぼゼロにまで減少します。
1. Chronotropic effects(クロノトロピック効果)
クロノトロピック効果は、心拍数 (heart rate) に影響を与える効果を指します。これには正のクロノトロピック効果(心拍数が増加)と負のクロノトロピック効果(心拍数が減少)の2つの種類があります。
- 正のクロノトロピック効果: 交感神経が刺激されると、心拍数が増加します。例えば、運動やストレス時に心拍数が上がるのはこの効果です。
- 負のクロノトロピック効果: 副交感神経(迷走神経)の刺激により、心拍数が減少します。リラックスした状態や睡眠中に見られます。
2. Dromotropic effects(ドロモトロピック効果)
ドロモトロピック効果は、主に房室結節(AV node)における伝導速度 (conduction velocity) に影響を与える効果を指します。
- 正のドロモトロピック効果: 伝導速度が増加し、心房から心室への信号伝達が速くなります。交感神経の刺激によって引き起こされ、心臓全体の収縮が早くなります。
- 負のドロモトロピック効果: 伝導速度が減少し、心臓の電気信号が心室に到達するまでに時間がかかります。副交感神経が刺激されると、この効果が生じます。
3. Inotropic effects(イノトロピック効果)
イノトロピック効果は、心臓の収縮力 (contractility) に影響を与える効果を指します。心筋の収縮力を増減させ、心臓がポンプとして血液を送り出す能力に影響を与えます。
- 正のイノトロピック効果: 心筋の収縮力が増加し、1回拍出量 (stroke volume) が増加します。交感神経の刺激やカテコラミン(例:アドレナリン)の放出によって引き起こされます。
- 負のイノトロピック効果: 心筋の収縮力が低下し、血液を送り出す能力が弱くなります。副交感神経や特定の薬物によって引き起こされることがあります。
| Effect Type | Influence | Positive Effect | Negative Effect |
|---|---|---|---|
| Chronotropic Effects (クロノトロピック効果) | Changes in heart rate (心拍数の変化) | Increases heart rate (心拍数増加) | Decreases heart rate (心拍数減少) |
| Dromotropic Effects (ドロモトロピック効果) | Changes in conduction velocity (伝導速度の変化) | Increases conduction velocity (伝導速度増加) | Decreases conduction velocity (伝導速度減少) |
| Inotropic Effects (イノトロピック効果) | Changes in cardiac contractility (心筋収縮力の変化) | Increases contractility (収縮力増加) | Decreases contractility (収縮力減少) |
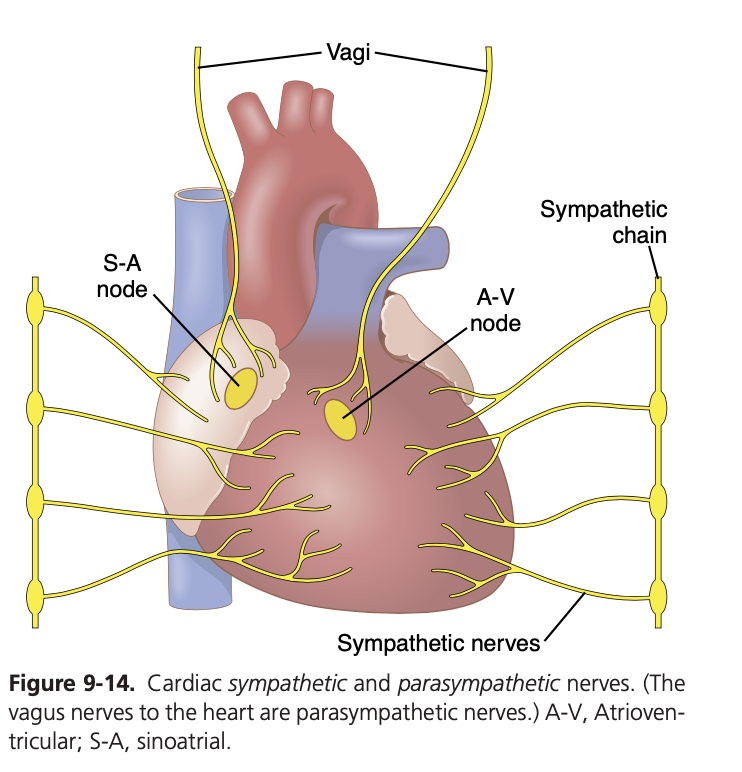
交感神経による心臓刺激のメカニズム
強い交感神経刺激は、若年成人の心拍数を通常の70拍/分から180~200拍/分に増加させ、まれに250拍/分に達することもあります。さらに、交感神経刺激により心筋の収縮

カリウムイオンとカルシウムイオンが心臓機能に与える影響
カリウムイオンの影響
細胞膜電位については第5章で説明しましたが、カリウムイオンが膜電位に顕著な影響を与えることを指摘しました。また、第6章では、カルシウムイオンが筋収縮プロセスを活性化する上で重要な役割を果たすことを述べました。したがって、これら2つのイオンの濃度が細胞外液において心臓のポンプ機能に重要な影響を与えるのは当然のことです。
過剰なカリウムイオンの影響: 細胞外液中のカリウムが過剰になると、心臓は拡張し、弛緩状態となり、心拍数も遅くなります。大量のカリウムは、心房から心室へのインパルス伝導を房室束(A-V bundle)でブロックすることもあります。カリウム濃度が8〜12 mEq/L(正常値の2〜3倍)に上昇すると、心臓の極端な弱さ、異常なリズム、さらには死を引き起こすことがあります。
これらの影響は、部分的には細胞外液中のカリウム濃度が高いと心筋繊維の静止膜電位が低下するためです。高濃度のカリウムは細胞膜の脱分極を引き起こし、膜電位がより負に戻りにくくなります。膜電位が低下すると、活動電位の強度も低下し、心臓の収縮力が徐々に弱まります。
カルシウムイオンの影響
カルシウムイオンの過剰は、カリウムイオンの影響とはほぼ正反対で、心臓が痙攣性収縮(spastic contraction)に向かう傾向があります。これは、カルシウムイオンが心臓の収縮プロセスを直接的に開始するためです。
逆に、カルシウムイオンが不足すると、心臓の弱さが生じ、これは高カリウムの場合と似た影響を及ぼします。幸いにも、血中のカルシウムイオン濃度は非常に狭い範囲で調整されており、カルシウム濃度の異常による心臓への影響が臨床的に問題となることはあまりありません。
温度が心臓機能に与える影響
体温が上昇すると(例えば発熱時)、心拍数は大幅に増加し、通常の倍になることもあります。一方、体温が低下すると心拍数は大幅に減少し、低体温症(hypothermia)の際には1分間に数回の拍動しか見られないことがあります。これは、温度が心筋膜の透過性を増加させ、心拍数を制御するイオンの透過を促進し、自動興奮過程が加速されるためと考えられています。
運動時など、体温が適度に上昇した場合、心筋の収縮力が一時的に強化されることがありますが、体温が長時間上昇したままだと代謝系が疲弊し、最終的には心臓が弱くなります。したがって、心臓の最適な機能は、体温の適切な制御に大きく依存しています。
動脈圧の増加が心拍出量に与える影響
図9-16に示されているように、動脈圧が上昇しても、平均動脈圧が約160 mmHgを超えるまでは心拍出量が減少することはありません。言い換えれば、通常の心機能では、心拍出量は主に組織を通る血液の流れやすさ、すなわち静脈還流量にほぼ完全に依存しています。このメカニズムについては、第20章で詳しく説明されています。



コメント