Contents
- 1 第10章 心臓のリズミカルな興奮
- 2 心臓の特殊な興奮性および伝導系
- 3 洞房結節(Sinoatrial Node)
- 4 洞房結節繊維の自動的電気的リズミカル性
- 5 洞房結節繊維のナトリウムおよびカルシウムイオンの透過性による自己興奮
- 6 結節間路と心房間路による心臓インパルスの伝導
- 7 房室結節による心房から心室へのインパルス伝導の遅延
- 8 心室のプルキンエ系における心臓インパルスの急速伝達
- 9 房室束(A-V bundle)の伝導は通常一方向
- 10 左右の束枝におけるプルキンエ線維の分布
- 11 心室筋における心臓インパルスの伝達
- 12 心臓インパルスの伝導の要約
- 13 心臓の興奮および伝導の制御
- 14 交感神経と副交感神経による心臓リズムとインパルス伝導の制御
第10章 心臓のリズミカルな興奮
人間の心臓は、リズミカルな自己興奮と反復的な収縮を行う特別なシステムを持っており、1日に約10万回、平均寿命では約30億回も動き続けます。この驚異的な働きを可能にするシステムは、以下の役割を果たしています。
- 心筋のリズミカルな収縮を開始するための電気的インパルスを生成する。
- これらのインパルスを心臓全体に迅速に伝導する。
このシステムが正常に機能すると、心房は心室の収縮よりも約6分の1秒早く収縮し、心室が肺や全身へ血液を送り出す前に十分に充填されるようになります。また、このシステムは心室全体がほぼ同時に収縮(almost simultaneously)することを可能にし、心室内で最大の圧力が生成されるため、非常に効率的なポンピングを行うことができます。
しかし、心臓病、特に冠血流の不足による虚血(ischemia)によってこのシステムが損傷を受けることがあります。これにより、心拍リズムが異常になったり、心室の収縮が不適切な順序で行われたりし、心臓のポンピング機能が大幅に低下し、最悪の場合には死に至ることもあります。
心臓の特殊な興奮性および伝導系
図10-1に、心臓の収縮を制御する特殊な興奮性および伝導系が示されています。この図には、通常のリズミカルなインパルスが生成される洞房結節(S-A node)、洞房結節から房室結節(A-V node)にインパルスを伝導する結節間路(internodal pathways)、心房から心室にインパルスが伝わる前に遅延が生じる房室結節(A-V node)、そして心房から心室にインパルスを伝える**房室束(A-V bundle)および心室全体にインパルスを伝導するプルキンエ線維(Purkinje fibers)**が含まれています。
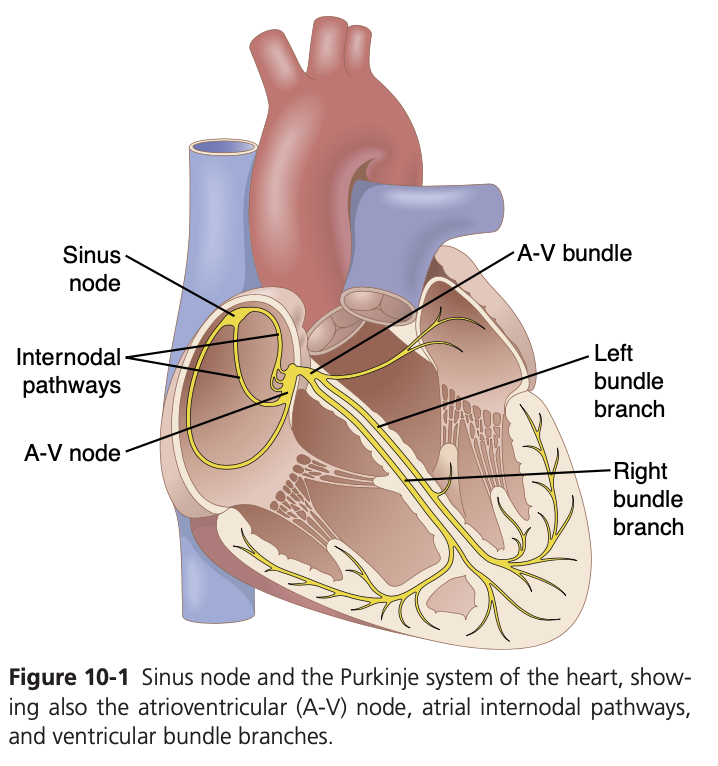
洞房結節(Sinoatrial Node)
洞房結節は、特別な心筋で構成された小さく平らな楕円形の部分で、幅約3 mm、長さ約15 mm、厚さ約1 mmです。右心房の後上壁、上大静脈の開口部のすぐ下、やや外側に位置しています。この結節の繊維は収縮性の筋フィラメントをほとんど持っておらず、直径はわずか3~5 μmで、周囲の心房筋繊維(10~15 μm)よりもかなり細いです。しかし、洞房結節の繊維は心房筋繊維と直接接続しており、洞房結節で始まる活動電位はすぐに心房壁に広がります。
洞房結節繊維の自動的電気的リズミカル性
心臓の一部の繊維には**自己興奮(self-excitation)**の能力があり、自動的にリズミカルな放電と収縮を引き起こします。この能力は、特に洞房結節のような心臓の特殊な伝導系に顕著です。このため、洞房結節は通常、心臓全体の拍動速度を制御します。ここでは、この自動リズム性のメカニズムを説明します。
洞房結節のリズム性のメカニズム
図10-2は、洞房結節繊維から記録された3回の心拍分の活動電位と、比較として単一の心室筋繊維の活動電位を示しています。洞房結節繊維の静止膜電位は、放電間において約-55~-60 mVであり、心室筋繊維の-85~-90 mVと比較すると、かなり低いです。この低い電位は、洞房結節の細胞膜がナトリウム(Na⁺)やカルシウム(Ca²⁺)イオンに対して自然に透過性があるためです。ナトリウムとカルシウムの正電荷が細胞内の負電荷を中和し、膜電位が低く保たれています。

心筋の活動電位には3つの主要なイオンチャネルが関与しており、それぞれが活動電位の電圧変化を引き起こします。
- 速いナトリウムチャネル(Fast sodium channels)
- カルシウムチャネル(Calcium channels)(特にL型カルシウムチャネル、”slow” calcium channelsとも呼ばれます)
- カリウムチャネル(Potassium channels)
心室筋において、速いナトリウムチャネルの開口は急速な活動電位の上昇を引き起こし、続いて遅いナトリウム・カルシウムチャネルの開口により活動電位のプラトーが形成されます。そして最後に、カリウムチャネルが開き、カリウムイオンが細胞外に拡散し、膜電位が静止レベルに戻ります。
一方、洞房結節繊維では、静止電位が約-55 mVと低いため、速いナトリウムチャネルはすでに不活化されており、活動電位の生成には主に遅いナトリウム・カルシウムチャネルが関与します。このため、洞房結節の活動電位は心室筋に比べて発生が遅く、膜電位の回復もゆっくりと進行します。
洞房結節繊維のナトリウムおよびカルシウムイオンの透過性による自己興奮
洞房結節繊維の膜はナトリウム(Na⁺)やカルシウム(Ca²⁺)に対して透過性が高く、これが自己興奮を引き起こします。特に、細胞外液中のナトリウムイオン濃度が高く、一部のナトリウムチャネルが既に開いているため、ナトリウムイオンが「ファニー電流(funny current)」を通して繊維内部に流入します。このナトリウムの流入により、心拍の間に静止膜電位が徐々に上昇し、次第にポジティブな方向へ移行します。図10-2に示されるように、静止膜電位は心拍ごとに徐々に上昇し、約-40 mVに達すると、L型カルシウムチャネルが活性化し、活動電位が発生します。このように、洞房結節繊維のナトリウムおよびカルシウムに対する透過性の高さが自己興奮を引き起こしています。
では、なぜこの透過性の高さが洞房結節繊維を常に脱分極させないのでしょうか。活動電位中に2つの出来事がこの問題を防いでいます。まず、L型カルシウムチャネルは開いてから約100~150ミリ秒後に不活性化(閉じる)されます。次に、同時期に多くのカリウムチャネルが開きます。このため、L型カルシウムチャネルを通じたナトリウムとカルシウムの流入は停止し、一方で大量のカリウムイオンが繊維外に拡散します。この2つの作用により、細胞内電位が再び負の静止レベルに戻り、活動電位が終了します。さらに、カリウムチャネルは数分の1秒間開いたままになり、正の電荷が細胞外へと移動し続け、その結果、繊維内部に過剰な負電荷が残ります。この過程を**過分極(hyperpolarization)**と呼びます。この過分極状態では、膜電位は活動電位終了後に約-55~-60 mVに達します。
では、なぜこの新しい過分極状態が維持され続けないのでしょうか。それは、活動電位が終了した後、徐々にカリウムチャネルが閉じるからです。そして、再びナトリウム(「ファニー電流」)およびカルシウムイオンの流入がカリウムイオンの流出を上回り、静止電位が再び上昇し、最終的に約-40 mVの閾値に達します。これにより再び活動電位が発生し、自己興奮のサイクルが繰り返されます。このプロセスは生涯にわたり続きます。
結節間路と心房間路による心臓インパルスの伝導
洞房結節繊維の末端は周囲の心房筋繊維と直接接続しているため、洞房結節で発生した活動電位は心房筋繊維に広がります。このようにして、活動電位は心房全体に伝わり、最終的には房室結節(A-V node)に到達します。ほとんどの心房筋での伝導速度は約0.3 m/secですが、いくつかの細い線維帯では伝導がより速く、約1 m/secです。そのうちの1つである**前心房間帯(Bachman’s bundle)**は、心房の前壁を通って左心房に達します。さらに、他の3本の小さな帯が心房の前方、側方、後方の壁を通り、房室結節に終わります。これらはそれぞれ、前結節間路(anterior internodal pathway)、中結節間路(middle internodal pathway)、後結節間路(posterior internodal pathway)と呼ばれます。これらの帯での伝導速度が速い理由は、特殊な伝導繊維が含まれているためです。これらの繊維は、後述する心室のプルキンエ繊維(Purkinje fibers)と類似しています。
房室結節による心房から心室へのインパルス伝導の遅延
心房の伝導系は、心房から心室へインパルスが急速に伝わらないように組織されており、この遅延により、心房が収縮して心室に血液を送り込む時間が確保されます。この伝導の遅延は主に房室結節(A-V node)およびその周辺の伝導繊維によって引き起こされます。
房室結節は右心房の後壁、三尖弁(tricuspid valve)の直後に位置しています。図10-3には、房室結節の異なる部分と、心房の結節間路繊維との接続、および房室束(A-V bundle)への接続が示されています。インパルスが洞房結節で発生し、房室結節に到達するまでの時間は約0.03秒です。さらに、房室結節内で約0.09秒の遅延が生じ、次に房室束の貫通部分に入ります。ここでは、心房と心室を隔てる線維組織を通過する小さな繊維束によって、さらに0.04秒の遅延が発生します。
このように、房室結節および房室束での合計遅延時間は約0.13秒です。洞房結節から房室結節までの最初の0.03秒の遅延を加えると、興奮信号が心室の収縮筋に到達するまでに合計で0.16秒の遅延が生じます。
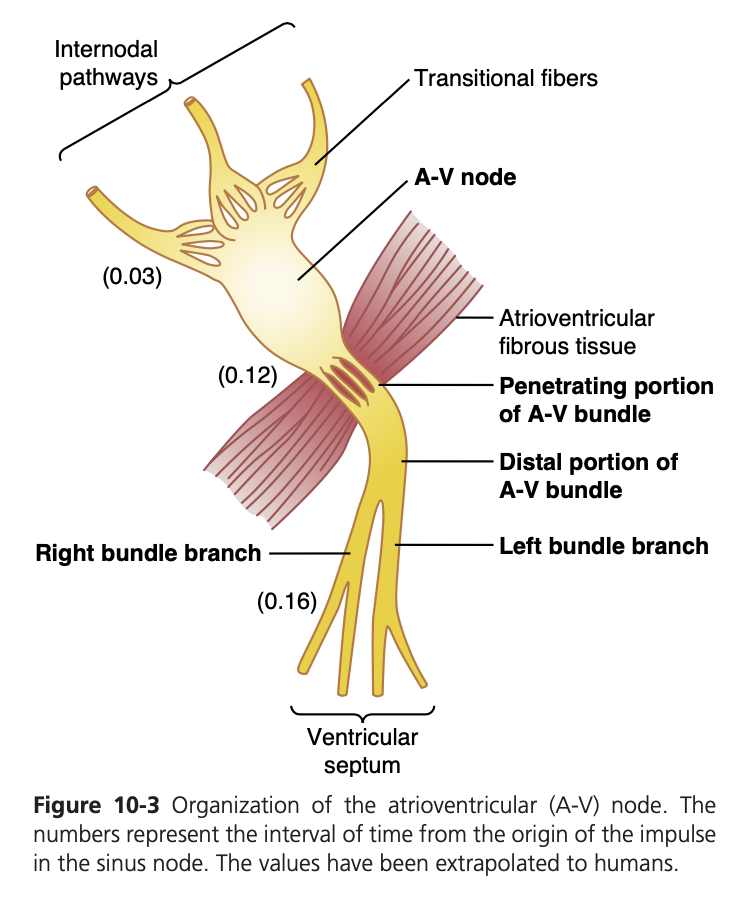
伝導の遅さの原因
房室結節や房室束の遷移部、結節部、貫通部の繊維における伝導の遅さは、主に隣接する細胞間でのギャップ結合の数が少ないためです。これにより、興奮性イオンが次の伝導繊維に伝わる際の抵抗が大きくなり、各細胞の興奮が遅れることになります。
心室のプルキンエ系における心臓インパルスの急速伝達
プルキンエ線維は、房室結節(A-V node)から房室束(A-V bundle)を経由して心室へ伝導されます。これらの線維は非常に大きく、通常の心室筋繊維よりも大きいため、伝導速度が1.5〜4.0 m/secにも達し、通常の心室筋の6倍、房室結節の一部の繊維の150倍の速度で活動電位を伝達します。この高速伝導により、心室筋全体にほぼ瞬時に心臓インパルスが伝わります。
プルキンエ線維による活動電位の急速伝達は、これらの繊維を構成する細胞間の介在板(intercalated discs)にあるギャップ結合(gap junctions)の透過性が非常に高いためだと考えられています。これにより、イオンが細胞間を容易に移動し、伝導速度が向上します。また、プルキンエ線維には筋原線維がほとんどなく、インパルスの伝達中に収縮はほとんど行われません。
房室束(A-V bundle)の伝導は通常一方向
房室束には、通常、活動電位が心室から心房へ逆行できないという特別な特徴があります。これにより、心房から心室への一方向の伝導が確保され、心室から心房へのインパルスの再入力を防ぎます。
また、房室束を除く心房筋と心室筋の間には、連続する線維性のバリアが存在し、これがインパルスの伝導を他の経路から防ぐ絶縁体として機能します。ただし、まれに異常な筋肉の橋や副経路がこの線維性バリアを貫通し、心室から心房へインパルスが再入力され、深刻な不整脈を引き起こすことがあります。
左右の束枝におけるプルキンエ線維の分布
房室束が心房筋と心室筋の間の線維性組織を貫通した後、房室束の遠位部分は心室中隔内を5~15 mm下方に走り、心尖部に向かいます。その後、左脚と右脚に分岐し、それぞれ心室中隔の左側と右側に沿って進みます。これらの枝はさらに細かく分岐し、心室の各部屋を側面に回り込んで心基部に戻ります。プルキンエ線維の終端は心筋の約3分の1まで浸透し、最終的に心筋繊維と連続します。
心臓インパルスが房室束に入ってからプルキンエ線維の終端に到達するまでの時間は、平均してわずか0.03秒です。したがって、心室プルキンエ伝導系にインパルスが入ると、心室全体にほぼ瞬時に広がります。
心室筋における心臓インパルスの伝達
プルキンエ線維の終端にインパルスが到達すると、その後は心室筋繊維自体によって心室筋全体に伝達されます。この伝導速度は0.3〜0.5 m/secで、プルキンエ線維の約6分の1です。
心筋は心臓の周りを2重螺旋に巻きついており、螺旋層の間には線維性中隔があります。そのため、心臓インパルスは必ずしも心臓表面に直接向かうわけではなく、螺旋に沿って斜めに進むことがあります。内膜から心外膜表面までの伝導には約0.03秒かかり、これはプルキンエ系全体での伝導時間とほぼ同じです。したがって、インパルスが最初に束枝に到達してから、心室筋繊維の最後に到達するまでの総伝導時間は約0.06秒です。
心臓インパルスの伝導の要約
図10-4は、心臓インパルスが心臓全体を伝導する過程をまとめたものです。図中の数字は、洞房結節でインパルスが発生してから、心臓の各部位でインパルスが現れるまでの時間を秒単位で示しています。インパルスは心房内を中程度の速度で広がり、房室結節で0.1秒以上の遅延が発生しますが、房室束に入るとプルキンエ線維を介して非常に速く心室全体に伝わります。その後、インパルスは心室筋を通じてやや遅い速度で心外膜表面に広がります。
この心臓インパルスの伝導経路と各部位での伝導時間について、詳細に理解することが心電図(第11〜13章で詳述)を理解する上で非常に重要です。
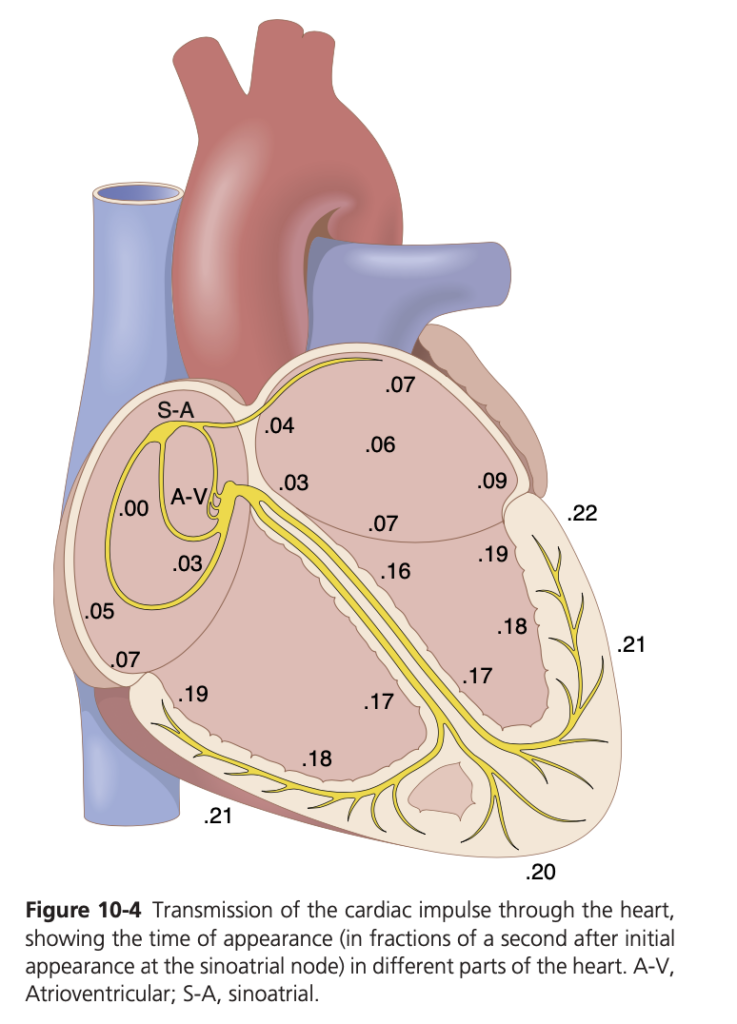
この図は、心臓の伝導系におけるインパルスの伝達の時間を示しています。特に、心臓のさまざまな部分における伝導の経路と、各部位での活動電位の到達時間が秒単位で示されています(S-Aノードからの時間を基準にしています)。
図には、以下のポイントが含まれています:
- S-Aノード(洞房結節)
洞房結節(Sinoatrial node、SA node)は、心臓のペースメーカーとして機能し、最初に活動電位を発生させます。インパルスはここで開始され、心房に伝わります。 - A-Vノード(房室結節)
洞房結節からのインパルスは房室結節(Atrioventricular node、AV node)に伝わります。ここで伝導はわずかに遅れます(約0.03秒の遅れ)。この遅延は、心房が完全に収縮して血液を心室に送り込む時間を確保するために重要です。 - ヒス束(His bundle)と右脚・左脚
インパルスは房室結節を通過した後、ヒス束を通って心室に伝わります。ヒス束は心室の右脚と左脚に分かれており、各脚を通じて心室全体にインパルスを伝えます。図中の数字は、インパルスが心臓の各部位に到達するまでの時間(秒)を示しています。たとえば、左脚の伝導は約0.16秒後に発生します。 - プルキンエ線維(Purkinje fibers)
インパルスは最終的にプルキンエ線維に到達し、心室の筋肉全体に迅速に伝わり、心室全体が同期して収縮します。プルキンエ線維は、心筋にインパルスを非常に速く伝えるため、心室の収縮が効率的に行われます。 - 伝導の時間
各数字は、S-Aノードからインパルスが心臓の他の部分に伝わるまでの時間を示しています。たとえば、心房にインパルスが到達するのは0.03秒後、心室に伝わるのは0.16秒から0.20秒後ということになります。
心臓の興奮および伝導の制御
洞房結節は心臓の通常のペースメーカー
心臓インパルスの発生と伝導について述べましたが、通常、インパルスは**洞房結節(sinus node)で始まります。しかし、異常な状態では、他の部分でも洞房結節繊維と同様に内因的なリズミカルな興奮が起こることがあります。特に房室結節(A-V node)やプルキンエ線維(Purkinje fibers)**がその例です。
- 房室結節繊維は、外部からの刺激がない場合、毎分40~60回の内因的なリズムで放電します。
- プルキンエ線維は毎分15~40回で放電します。
- 一方、洞房結節の通常の放電速度は毎分70~80回です。
なぜ、洞房結節が他の部位よりも心臓のリズムを制御するのでしょうか?その理由は、洞房結節の放電速度が他の部位よりもかなり速いためです。洞房結節が放電するたびに、そのインパルスは房室結節やプルキンエ線維にも伝導され、これらの部位の膜が興奮します。洞房結節が再び放電する前に、房室結節やプルキンエ線維は自発的な興奮の閾値に達することができません。そのため、洞房結節が心臓全体のリズムを制御し、洞房結節が通常の心臓のペースメーカーとなるのです。
異所性ペースメーカー(Ectopic Pacemaker)
時折、洞房結節以外の部分が洞房結節よりも速いリズミカルな放電を示すことがあります。例えば、房室結節やプルキンエ線維が異常になった場合、心臓のペースメーカーは洞房結節からこれらの部位に移ります。また、心房や心室の筋肉の一部が過度に興奮し、ペースメーカーになることもあります。
洞房結節以外にあるペースメーカーは**異所性ペースメーカー(ectopic pacemaker)**と呼ばれ、心臓の各部分が異常な順序で収縮するため、心臓のポンピング力が大幅に弱まることがあります。
もう一つのペースメーカーの変位の原因は、洞房結節から他の部分へのインパルスの伝導がブロックされることです。この場合、新しいペースメーカーは通常、房室結節や房室束の貫通部分で発生します。
房室ブロック(A-V block)が発生すると、心臓のインパルスは心房から心室に伝わらなくなりますが、心房は洞房結節のリズムで通常通り拍動し続けます。一方、心室のペースメーカーはプルキンエ系で新たに形成され、心室筋は毎分15~40回で拍動するようになります。このようなStokes-Adams症候群では、房室束のブロックが起きた直後、プルキンエ系が自発的なリズムを発生させるまでに5~20秒かかるため、その間心室は血液をポンプできなくなります。脳への血流が途絶えた後、最初の4~5秒で意識を失うことがあり、遅延が長引くと死に至る可能性もあります。
プルキンエ系の役割と心室筋の同期収縮
プルキンエ系の高速伝導により、心臓インパルスは心室全体に短時間で伝わります。最初に興奮した心室筋繊維と最後に興奮した心室筋繊維の間には0.03~0.06秒の差しかありません。このタイミングにより、両心室の心筋全体がほぼ同時に収縮し始め、その後約0.3秒間収縮し続けます。
この同期的な収縮は、両心室が効果的に血液を送り出すために必要です。もし心室内でインパルスの伝導が遅くなった場合、心室の一部が他の部分よりも先に収縮し、全体的なポンピング効果が大幅に低下します。実際、いくつかの心機能障害では、伝導の遅れが発生し、心室のポンピング効率が20~30%低下します。心臓再同期療法デバイス(CRT)は、心房と心室の適切なタイミングを回復させ、拡張した弱い心臓のポンピング効果を改善するために使用されるペースメーカーです。
交感神経と副交感神経による心臓リズムとインパルス伝導の制御
心臓は、交感神経と副交感神経の両方に支配されています。図9-14に示されるように、**副交感神経(vagus nerve)は主に洞房結節(S-A node)および房室結節(A-V node)**に分布し、心房筋にも一部が分布していますが、心室筋にはほとんど直接的な支配はありません。一方、交感神経は心臓のすべての部分に分布しており、特に心室筋に強く影響を及ぼします。
副交感神経(迷走神経)刺激による心臓リズムと伝導の遅延
副交感神経が刺激されると、**アセチルコリン(acetylcholine)**が迷走神経の末端で放出されます。これには次の2つの主要な効果があります。
- 洞房結節のリズムの減少: 洞房結節の自動興奮頻度が減少します。
- 房室結節の興奮性の減少: 心房筋と房室結節の間の繊維の興奮性が低下し、心臓インパルスの伝導が遅くなります。
弱から中程度の迷走神経刺激では、心拍数が通常の半分程度まで減少することがあります。強い迷走神経刺激では、洞房結節のリズム的興奮が完全に停止するか、房室結節を通じて心房から心室へのインパルス伝導が完全にブロックされることがあります。この場合、心室はリズム的な興奮信号を受け取らなくなり、一時的に心拍が停止することがありますが、通常は5~20秒後にプルキンエ繊維の一部が独自のリズムを形成し、心室が15~40回/分のペースで拍動します。この現象を**心室脱出(ventricular escape)**と呼びます。
迷走神経効果のメカニズム
迷走神経の末端から放出されたアセチルコリンは、繊維膜のカリウムイオンに対する透過性を大幅に増加させ、カリウムイオンが急速に漏れ出します。この過程は繊維内の負電荷を増加させ、**過分極(hyperpolarization)**を引き起こします。これにより、興奮性組織の興奮が非常に困難になります。
- 洞房結節: 過分極により、洞房結節の静止膜電位が通常よりもかなり負の値(-65~-75 mV)になります。このため、ナトリウムおよびカルシウムの流入による膜電位の上昇が遅れ、閾値に達するまでの時間が長くなります。結果として、洞房結節のリズムが大幅に遅くなります。
- 房室結節: 迷走神経刺激による過分極は、心房から房室結節に入る小さな繊維が十分な電気を生成できなくなり、心臓インパルスの伝導が難しくなります。これにより、心臓インパルスの伝導の安全性が低下し、伝導が遅れるか、完全にブロックされる可能性があります。
交感神経刺激による心臓リズムと伝導の増加
交感神経刺激は、副交感神経刺激とは逆の効果をもたらします。
- 洞房結節の放電率が増加します。
- 心臓のすべての部分で伝導速度および興奮性が増加します。
- 心房および心室の両方で収縮力が大幅に増加します。
つまり、交感神経刺激は心臓全体の活動を増加させます。最大の交感神経刺激では、心拍数がほぼ3倍に増加し、心筋の収縮力も最大で2倍に増加します。
交感神経効果のメカニズム
交感神経が刺激されると、**ノルエピネフリン(norepinephrine)が神経末端から放出されます。ノルエピネフリンはβ1アドレナリン受容体(beta-1 adrenergic receptors)**を刺激し、心拍数に影響を与えます。この受容体刺激により、心筋繊維膜のナトリウムおよびカルシウムイオンに対する透過性が増加すると考えられています。
- 洞房結節: ナトリウムおよびカルシウムの透過性が増加すると、静止膜電位がより正の方向に移動し、膜電位が閾値に達する速度が加速されます。これにより、自己興奮が加速し、心拍数が増加します。
- 房室結節および房室束: ナトリウムおよびカルシウムの透過性が増加すると、次の繊維が活動電位によって興奮するのが容易になり、心房から心室への伝導時間が短縮されます。
- 収縮力の増加: カルシウムイオンの透過性の増加は、心筋の収縮力を増加させます。カルシウムは筋原線維の収縮プロセスを促進するため、収縮力の強化に重要な役割を果たします。


コメント