Contents
- 1 今日の学習目標
- 2 タンパク質 (Proteins)
- 3 プロテオームとプロテオミクスとは?
- 4 アミノ酸 (Amino Acids)
- 5 分子生物学のセントラルドグマ (Central Dogma of Molecular Biology)
- 6 遺伝暗号 (Genetic Code)
- 7 アミノ酸 (Amino Acids)
- 8 アミノ酸の種類
- 9 非極性側鎖アミノ酸の特徴
- 10 電荷を持たない極性側鎖アミノ酸
- 11 酸性側鎖アミノ酸
- 12 塩基性側鎖アミノ酸
- 13 セレノシステイン、21番目のアミノ酸
- 14 アミノ酸の光学的特性
- 15 アミノ酸の電荷
- 16 必須アミノ酸
- 17 条件付き必須アミノ酸
- 18 タンパク質の構造
- 19 二次構造 (Secondary Structure)
- 20 二次構造の他の形式
- 21 三次構造 (Tertiary Structure)
- 22 ドメイン (Domains)
- 23 四次構造 (Quaternary Structure)
- 24 変性 (Denaturation)
- 25 臨床的関連
今日の学習目標
- 20種類のアミノ酸の構造図を描き、3文字および1文字の表記を記載する
- アミノ酸の基本構造には、アミノ基(NH2)、カルボキシル基(COOH)、水素原子(H)、および側鎖(Rグループ)があり、これらがα炭素に結合しています。20種類のアミノ酸は、それぞれ異なるRグループを持ち、その性質や機能が異なります。学習では、各アミノ酸の分子構造を理解し、それに対応する3文字および1文字の表記(例:グリシンはGly, G)を覚えることが重要です。
- Rグループの重要性と寄与について説明する
- Rグループ(側鎖)はアミノ酸の性質を決定する重要な要素です。Rグループの性質(例えば、極性、疎水性、電荷の有無)は、アミノ酸がどのようにしてタンパク質の三次元構造を形成し、機能を果たすかに大きく影響します。異なるRグループの特徴がタンパク質の機能や安定性にどのように寄与するかを理解することが求められます。
- 等電点(pI)を定義し、多官能電解質の正味の電荷との関係を説明する
- 等電点(pI)は、アミノ酸やペプチドが電荷を帯びていない(正味の電荷が0)状態になるpH値です。多官能電解質(例えば、アミノ酸やペプチド)は、pHの変化によってプロトンが解離または結合し、正味の電荷が変化します。等電点における電荷の分布と、その結果として生じるタンパク質の溶解性や電気泳動での挙動について理解します。
- ペプチドの方向性、命名法、一次構造について説明する
- ペプチドは、アミノ酸がペプチド結合で連結したポリマーです。ペプチドにはN末端(アミノ基側)からC末端(カルボキシル基側)への方向性があり、この方向性に従って命名されます。一次構造とは、ペプチドやタンパク質におけるアミノ酸の配列を指し、この配列が最終的なタンパク質の機能にどのように影響するかについて学びます。
- ペプチド結合の部分的な二重結合性が構造に与える影響を説明し、回転が自由なペプチドバックボーン内の結合を特定する
- ペプチド結合は部分的に二重結合の性質を持つため、平面構造を形成し、この部分の自由回転が制限されます。この結合の性質がペプチドの構造に与える影響を理解し、ペプチドバックボーンにおいて自由に回転できる結合(α炭素とアミノ基、α炭素とカルボキシル基の間の結合)を特定します。これにより、タンパク質の立体構造の形成と安定性について学びます。
タンパク質 (Proteins)
- 最も豊富で機能的に多様な分子
タンパク質は生体内で最も豊富に存在し、非常に多様な機能を持つ分子です。 - アミノ酸の線状ポリマー
タンパク質はアミノ酸が直線的に結合したポリマーで構成されています。 - タンパク質が重要である理由
タンパク質は以下のような重要な役割を担っています:- 酵素: 酵素として代謝を調節します。
- 神経伝達物質: 神経伝達に関与します。
- 筋肉の収縮タンパク質: 筋肉の収縮に関与します。
- 結合組織: 結合組織のフレームワークを提供します。
- 血中の分子輸送: 血液中で分子を輸送します。
- 免疫系の構成要素: 免疫系の重要な構成要素です。
プロテオームとプロテオミクスとは?
- プロテオーム (Proteome)
プロテオームとは、特定の時点である細胞によって発現される全てのタンパク質のセットを指します。 - プロテオミクス (Proteomics)
プロテオミクスは、様々な条件下で細胞が生成する全てのタンパク質を特定することを目的とした研究分野です。
アミノ酸 (Amino Acids)
- 300種類以上のアミノ酸
300種類以上のアミノ酸が知られていますが、哺乳類のタンパク質に一般的に見られるのは20種類のみです。 - DNAによってコードされる唯一のアミノ酸
これらの20種類のアミノ酸だけがDNAによってコードされています。
分子生物学のセントラルドグマ (Central Dogma of Molecular Biology)
- セントラルドグマは、遺伝情報の流れを説明する基本的な概念です。遺伝情報はDNAからRNAへ、そしてRNAからタンパク質へと伝達されます。これは生物学における遺伝情報の伝達の中心的な原理です。
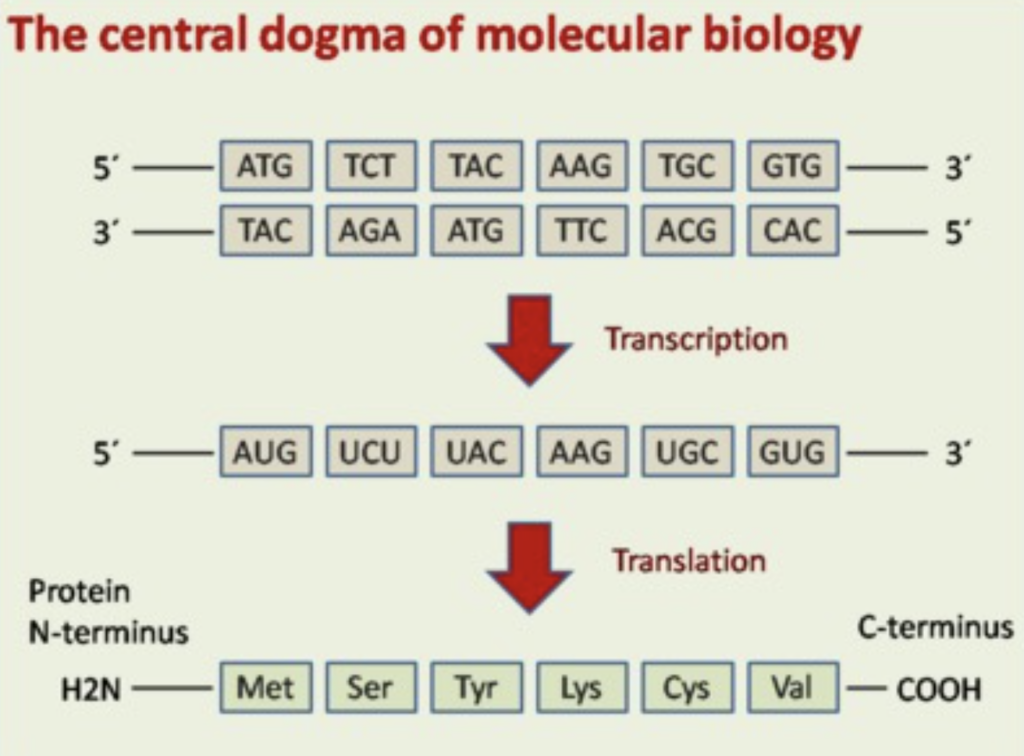
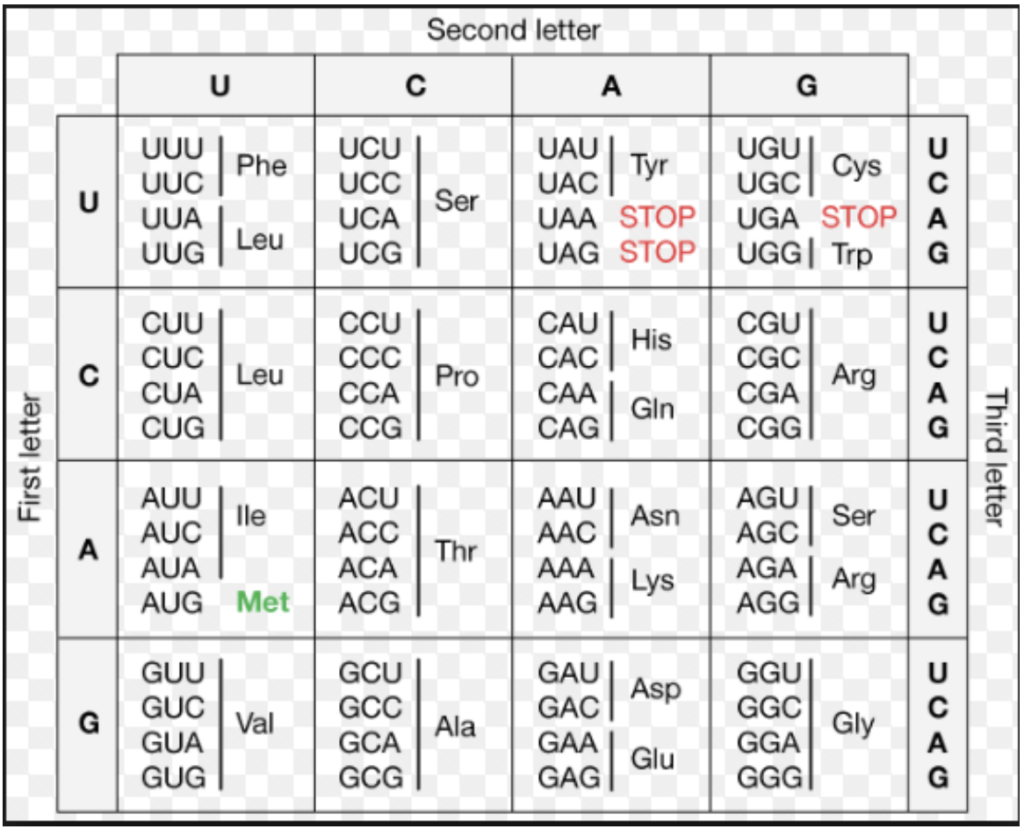
遺伝暗号 (Genetic Code)
- 遺伝暗号は、DNAやRNAの中でアミノ酸を指定するための3つのヌクレオチドの組み合わせ(コドン)を指します。これらのコドンがどのアミノ酸を指定するかは、タンパク質の合成において決定的な役割を果たします。
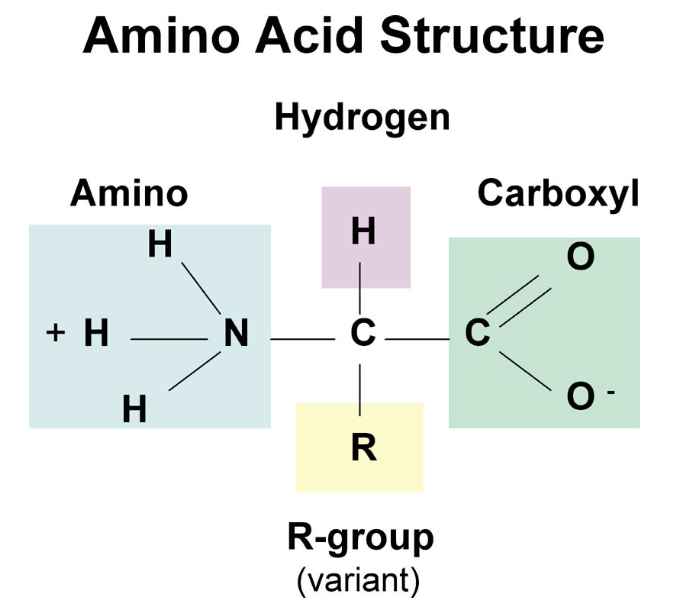
アミノ酸 (Amino Acids)
- 基本構造: 各アミノ酸は、以下の構成要素を持つ基本的な構造をしています:
- 中心炭素原子 (α炭素): 全てのアミノ酸に共通の中心炭素。
- アミノ基 (NH2): α炭素に結合したアミノ基。
- カルボキシル基 (COOH): α炭素に結合したカルボキシル基。
- 水素原子 (H): α炭素に結合した水素原子。
- イオン化: 水溶液中では、アミノ基とカルボキシル基はそれぞれイオン化します(アミノ基はNH3+、カルボキシル基はCOO-)。
- Rグループ (側鎖):
各アミノ酸には、α炭素に結合する別の原子または原子群(Rグループ)が存在します。このRグループは、アミノ酸に特定の特徴(サイズ、極性、pHなど)を与えます。Rグループの違いが、アミノ酸の物理的および化学的性質を決定し、それによりタンパク質の構造と機能に影響を与えます。
アミノ酸の種類
- 脂肪族側鎖を持つアミノ酸
- ヒドロキシル基(OH基)を持つアミノ酸
- チオール基(SH基)を持つアミノ酸
- 塩基性側鎖を持つアミノ酸
- 酸性側鎖を持つアミノ酸
- 芳香族側鎖を持つアミノ酸
| アミノ酸分類 | アミノ酸 | 極性/略号 | 側鎖構造(R) | 簡単な説明 |
|---|---|---|---|---|
| 脂肪族側鎖 (GAVIL) | グリシン (Glycine) | 非 Gly (G) | 1H | 最もシンプルな構造のアミノ酸。 |
| アラニン (Alanine) | 非 Ala (A) | 1C | メチル基を持つ、非極性アミノ酸。 | |
| バリン (Valine) | 非 Val (V) | 3C | 分岐した側鎖を持つ、非極性アミノ酸。 | |
| イソロイシン (Isoleucine) | 非 Ile (I) | 4C | 分岐鎖アミノ酸で、筋肉に多く存在。 | |
| ロイシン (Leucine) | 非 Leu (L) | 4C | 筋肉タンパク質に豊富な分岐鎖アミノ酸。 | |
| OH基 (STT) | セリン (Serine) | 極 Ser (S) | 1C, 1OH | 極性アミノ酸で、酵素の活性部位に多い。 |
| スレオニン (Threonine) | 極 Thr (T) | 1C, 1OH, 1C | OH基を持つため極性がある。 | |
| チロシン (Tyrosine) | 極 Tyr (Y) | 1C, hexose, 1OH | 芳香族であり、ホルモンの前駆体。 | |
| SH基 (CM) | システイン (Cysteine) | 極 Cys (C) | 1C, 1SH | ジスルフィド結合を形成し、タンパク質の安定性を保つ。 |
| メチオニン (Methionine) | 非 Met (M) | 2C, 1SH, 1C | タンパク質合成の開始に関与する。 | |
| 塩基性側鎖 (HAL) | ヒスチジン (Histidine) | His (H) | 1C, 1 pentose | 酵素の活性部位に多く、pHに応じて荷電が変わる。 |
| アルギニン (Arginine) | 極 Arg (R) | 3C, NCN c double bond | 強塩基性で、タンパク質内でプラスの電荷を持つ。 | |
| リシン (Lysine) | Lys (K) | 4C, 1NH3+ | 塩基性アミノ酸で、タンパク質の安定性に寄与。 | |
| 酸性側鎖 (AGAG) | アスパラギン酸 (Aspartic Acid) | Asp (D) | 1C, 1COO– | 酸性アミノ酸で、負の電荷を持つ。 |
| グルタミン酸 (Glutamic Acid) | Glu (E) | 2C, 1COO– | 神経伝達物質としても機能する。 | |
| アスパラギン (Asparagine) | 極 Asn (N) | 2C, 1O, 1NH2+ | 非荷電極性で、糖鎖の結合に関与。 | |
| グルタミン (Glutamine) | 極 Gln (Q) | 3C, 1O, 1NH2 | アミノ基を持ち、窒素の運搬に重要。 | |
| 芳香族側鎖 (HPTT) | ヒスチジン (Histidine) | His (H) | 1C, 1 pentose | 繰り返し出現するため、2つのカテゴリーに含まれる。 |
| フェニルアラニン (Phenylalanine) | 非 Phe (F) | 1C, 1 hexose | 芳香族側鎖で、疎水性が強い。 | |
| チロシン (Tyrosine) | 極 Tyr (Y) | 1C, hexose, 1OH | 芳香族であり、酵素反応に関与。 | |
| トリプトファン (Tryptophan) | 非 Trp (W) | 1C, 1 hexose, 1 pentose | 芳香族で、セロトニンの前駆体。 | |
| イミノ基 (P) | プロリン (Proline) | Pro (P) | 1 pentose, 1NH2, 1COO | 独自の環状構造により、タンパク質の構造を安定化。 |
非極性側鎖アミノ酸の特徴
- 生理的pHでは正味電荷はゼロ
- 酸や塩基としての性質を持たない
- プロトンの放出や結合をしない
- 疎水性(親水性を避ける)相互作用を促進
- タンパク質の内部に集まる傾向がある
- 例:アラニン、バリン、イソロイシン、ロイシン、フェニルアラニン、プロリン、トリプトファン、メチオニン
非極性側鎖アミノ酸
| アミノ酸名 | 略号 | 側鎖構造(Rグループ) | 簡単な説明 |
|---|---|---|---|
| グリシン (Glycine) | Gly (G) | H | 最もシンプルな構造を持つアミノ酸。非極性だが疎水性は低い。 |
| アラニン (Alanine) | Ala (A) | CH₃ | メチル基を持つ非極性アミノ酸。タンパク質の内部によく見られる。 |
| バリン (Valine) | Val (V) | CH(CH₃)₂ | 分岐鎖を持つ非極性アミノ酸で、強い疎水性を持つ。 |
| イソロイシン (Isoleucine) | Ile (I) | CH(CH₃)CH₂CH₃ | 分岐鎖アミノ酸で、筋肉に多く存在し、疎水性が高い。 |
| ロイシン (Leucine) | Leu (L) | CH₂CH(CH₃)₂ | 分岐鎖アミノ酸で、タンパク質の内部に多く、構造安定化に寄与する。 |
| メチオニン (Methionine) | Met (M) | CH₂CH₂SCH₃ | 硫黄を含む非極性アミノ酸。タンパク質合成の開始に関与。 |
| フェニルアラニン (Phenylalanine) | Phe (F) | CH₂C₆H₅ | 芳香族側鎖を持つ非極性アミノ酸で、強い疎水性を持つ。 |
| トリプトファン (Tryptophan) | Trp (W) | CH₂C₈H₆N | 芳香族側鎖を持つが、他の非極性アミノ酸よりもやや極性がある。 |
注記: 重要な単語には英語での表記を括弧内に示しています。また、側鎖構造(Rグループ)は簡略化した化学式で表記しています。
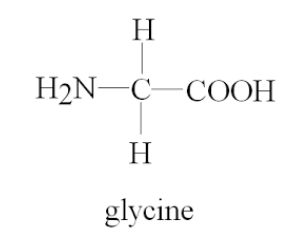
グリシン (Glycine, Gly, G)
- 唯一、アキラルな炭素(側鎖が水素)を持つアミノ酸
※アキラルな炭素とは、立体的に鏡像対称であり、左右の区別がない炭素原子です。 - ヘム合成の第一段階に関与:グリシン + サクシニルCoA → D-アミノレブリン酸(D-ALA)
- プリン合成に利用される
- 脊髄における主要な抑制性神経伝達物質
アラニン (Alanine, Ala, A)
- 周辺組織から肝臓への窒素輸送を担う
バリン、イソロイシン、ロイシン (Valine, Isoleucine, Leucine, VIL)
- 分岐鎖アミノ酸であり、メープルシロップ尿症(MSUD)ではこれらの代謝物が蓄積
- 分岐鎖α-ケト酸脱水素酵素の欠乏が原因
フェニルアラニン (Phenylalanine, Phe, F)
- フェニルケトン尿症(フェニルアラニンヒドロキシラーゼの欠乏)で蓄積
この解説は、非極性側鎖アミノ酸がどのようにタンパク質の内部に配置され、その疎水性によって安定性をもたらすかを示しています。また、各アミノ酸の特定の生化学的役割や関連する疾患についても説明しています。
トリプトファン (Tryptophan, Trp, W)
- 最も大きな芳香族側鎖を持つアミノ酸
- ニコチン酸(ナイアシン)、セロトニン、メラトニンの前駆体として機能
メチオニン (Methionine, Met, M)
- SAM(S-アデノシルメチオニン)としてメチル基を転移する役割を持つ
- ホモシステインの前駆体
プロリン (Proline, Pro, P)
- アミノ酸ではなく、イミノ酸として分類される
- コラーゲンの繊維構造に寄与し、球状タンパク質のα-ヘリックスを中断させる役割を果たす
これらのアミノ酸は、それぞれ特有の構造と機能を持っており、生体内で重要な役割を果たしています。トリプトファンは神経伝達物質やホルモンの前駆体であり、メチオニンはメチル基の供与体として重要です。プロリンは、タンパク質の立体構造や安定性に関与しています。
電荷を持たない極性側鎖アミノ酸
これらのアミノ酸は、生理的pHで電荷を持たず、極性を持つため、水素結合を形成できます。これにより、タンパク質内での結合や相互作用が可能です。
Uncharged(帯電していない)
- 定義: 帯電していないとは、分子全体として電荷がゼロであることを意味します。つまり、分子に正の電荷や負の電荷がない状態です。
- 生理的pH: 生理的pH(約7.4)で、分子が正または負の電荷を帯びていない状態。
- 例: アミノ酸の中で、側鎖が中性である(酸性や塩基性でない)ものがこれに該当します。例えば、グリシンやアラニンは生理的pHで帯電していません。
Polar(極性)
- 定義: 極性とは、分子内の電荷分布が不均等であることを指します。分子内に部分的な正電荷と負電荷が存在し、これにより水分子などの他の極性分子と相互作用(例: 水素結合)が可能です。
- 特徴: 極性分子は水に溶けやすい傾向があり、分子間で水素結合を形成することができます。
- 例: セリンやスレオニンは側鎖にOH基を持っており、これが水と相互作用できるため、極性を示します。
違いのまとめ
- 帯電していない(uncharged)は、分子全体の電荷の有無に関する特性です。電荷がない状態を意味します。
- 極性(polar)は、分子の内部の電荷分布が不均等であることを意味し、これにより水素結合などの相互作用が可能です。
極性の分子が常に帯電していないわけではなく、例えば水は極性で帯電もしていますが、帯電していない極性アミノ酸(セリンやスレオニン)は、分子全体として電荷がゼロでありながら、極性の特性を持ちます。
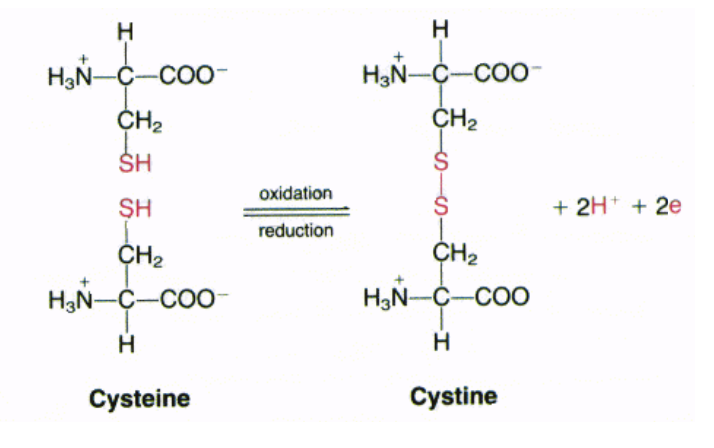
システイン (Cysteine, Cys, C)
- 特徴: 硫化水素基(-SH)を含み、多くの酵素の活性部位に関与します。
- 機能: 二つのシステインが共有結合で結びつき、シスチンを形成します。これがタンパク質の構造を安定させるのに役立ちます。例えば、ケラチン(髪や爪の構成成分)には多くのシスチンが含まれており、これが髪の曲がりやストレートさに影響を与えます。
チロシン (Tyrosine, Tyr, Y)
- 特徴: チロシンはホルモンや色素の前駆体です。
- 機能: チロキシン(甲状腺ホルモン)やメラニン(皮膚や髪の色素)の合成に必要です。
セリン (Serine, Ser, S)
- 特徴: 酵素の修飾のためのリン酸化の部位です。
- 機能: 糖タンパク質において糖鎖と結びつくことが多いです。ゴルジ体でのO-結合型糖鎖化の部位としても機能します。
スレオニン (Threonine, Thr, T)
- 特徴: セリンと似た機能を持ちます。
- 機能: ゴルジ体でのO-結合型糖鎖化の部位です。
アスパラギン (Asparagine, Asn, N)
- 特徴: N-結合型糖鎖化の部位です。
- 機能: 内因性に糖鎖と結びつき、糖タンパク質の構造や機能に関与します。
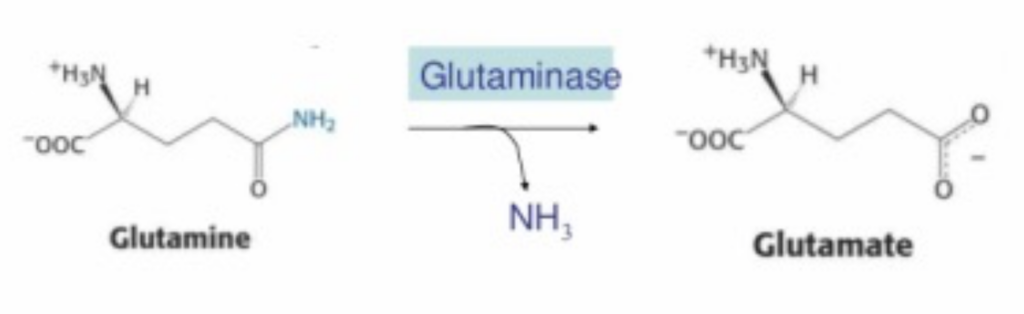
グルタミン (Glutamine, Gln, Q)
- 特徴: グルタミン酸から脱アミノ化(グルタミナーゼによって)され、アンモニアを生成します。
- 機能: アンモニアの供給源として重要で、細胞の窒素代謝に関与します。
これらのアミノ酸は、酵素の活性部位、タンパク質の構造、ホルモンや色素の合成など、様々な生理的プロセスに重要な役割を果たしています。
極性側鎖アミノ酸
| アミノ酸名 | 略号 | 側鎖構造(Rグループ) | 簡単な説明 |
|---|---|---|---|
| セリン (Serine) | Ser (S) | CH₂OH | ヒドロキシル基 (OH) を持ち、酵素の活性部位で重要な役割を果たす。 |
| スレオニン (Threonine) | Thr (T) | CHOHCH₃ | ヒドロキシル基 (OH) を持ち、極性があり、タンパク質の修飾に関与する。 |
| チロシン (Tyrosine) | Tyr (Y) | CH₂C₆H₄OH | 芳香族側鎖にヒドロキシル基 (OH) を持ち、ホルモンや神経伝達物質の前駆体。 |
| アスパラギン (Asparagine) | Asn (N) | CH₂CONH₂ | アミド基 (CONH₂) を持ち、糖鎖の結合やタンパク質の安定性に寄与する。 |
| グルタミン (Glutamine) | Gln (Q) | CH₂CH₂CONH₂ | アミド基 (CONH₂) を持ち、窒素の運搬やアンモニアの無毒化に関与する。 |
| システイン (Cysteine) | Cys (C) | CH₂SH | チオール基 (SH) を持ち、ジスルフィド結合を形成し、タンパク質の安定性を保つ。 |
注記: 重要な単語には英語での表記を括弧内に示しています。また、側鎖構造(Rグループ)は簡略化した化学式で表記しています。
酸性側鎖アミノ酸
- 特徴: 生理的pHで負の電荷を持つ。カルボキシレート基(-COO⁻)による。
- 機能: 酸性のためプロトン供与体(プロトンを放出する)。イオン反応に関与する。
グルタミン酸 (Glutamate, Glu, E)
- 特徴: GABA(γ-アミノ酪酸)やグルタチオンの前駆体。
- 機能: 神経伝達物質GABAの合成に関与し、抗酸化作用を持つグルタチオンの合成にも関与。
塩基性側鎖アミノ酸
- 特徴: 生理的pHで正の電荷を持つ。アミノ基(-NH₂)が影響。
- 機能: 塩基性のためプロトン受容体(プロトンを受け取る)。中性pHでは以下のように振る舞う:
- アルギニン (Arginine, Arg, R): 正の電荷を持つ。尿素、クレアチニン、一酸化窒素の前駆体。
- リシン (Lysine, Lys, K): 正の電荷を持つ。タンパク質の安定性に寄与。
- ヒスチジン (Histidine, His, H): 弱塩基性で、中性pHでは電荷を持たない。ヒスタミンの前駆体で、葉酸欠乏症の診断にも使用される。特に大容量のヒスチジン摂取後に尿中のN-formiminoglutamate(FIGlu)が増加することが示されています。
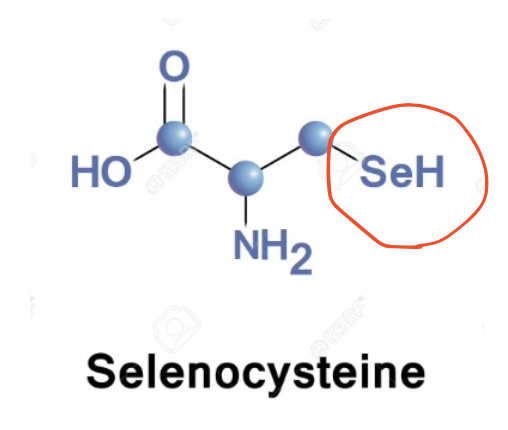
セレノシステイン、21番目のアミノ酸
- 特徴: L-αアミノ酸で、特定のタンパク質に含まれる。
- 機能: 過酸化物還元酵素、セレノプロテインP、ヨウ素甲状腺ホルモン脱ヨウ素酵素などに含まれ、抗酸化作用やホルモンの代謝に関与します。
これらのアミノ酸は、タンパク質の機能や構造において重要な役割を果たし、生理的プロセスに欠かせない成分です。
アミノ酸の光学的特性
- キラリティ: グリシンを除く全てのアミノ酸はキラル(光学異性体)です。これは、分子が鏡像異性体(エナンチオマー)を持ち、鏡に映したように完全に一致しないことを意味します。
- L-構造: タンパク質に含まれるアミノ酸は通常L-構造です。
- D-構造: 一部の細菌の細胞壁や抗生物質などではD-構造が見られます。
アミノ酸の電荷
- 電荷の変化: アミノ酸はpKa値や環境のpHに応じて、正の電荷、負の電荷、または電荷なし(ゼロ)になることがあります。
- ジワッターイオン(Zwitterion): アミノ酸は、pHが等電点(アイソエレクトリックポイント)に達すると、正負の電荷が相殺し合い、全体として電荷がゼロの分子になります。
- 等電点(Isoelectric Point): アミノ酸がジワッターイオンとして存在するpH値であり、このpHではアミノ酸の全体的な電荷がゼロです。
必須アミノ酸
- PVT TIM HALL:
- Phenylalanine(フェニルアラニン)
- Valine(バリン)
- Tryptophan(トリプトファン)
Threonine(スレオニン)- Isoleucine(イソロイシン)
- Methionine(メチオニン)
- Histidine(ヒスチジン)
Arginine(アルギニン)- Leucine(ロイシン)
- Lysine(リシン)
- 覚え方: 「Always ARGues, never TYRes」(アルギニンとスレオニンを除いたアミノ酸は必須です)
条件付き必須アミノ酸
- アルギニン (Arginine): 通常体内で合成可能ですが、必要量を満たすためには食事から摂取する必要があります。
- ヒスチジン (Histidine): 体内でリサイクルされることはありますが、完全に合成することはできず、最終的には食事から摂取する必要があります。
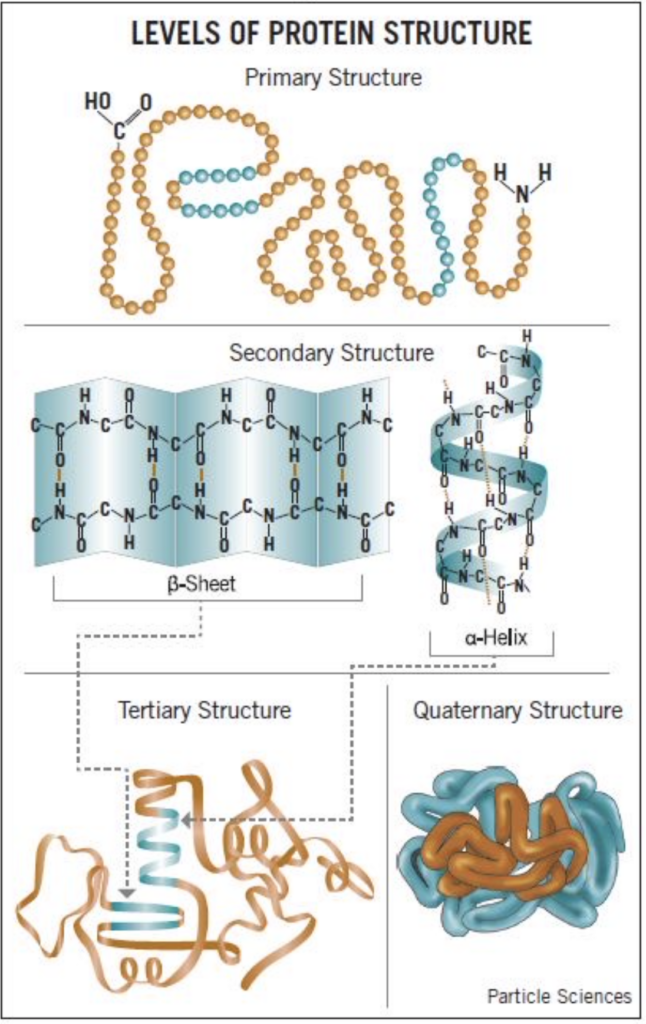
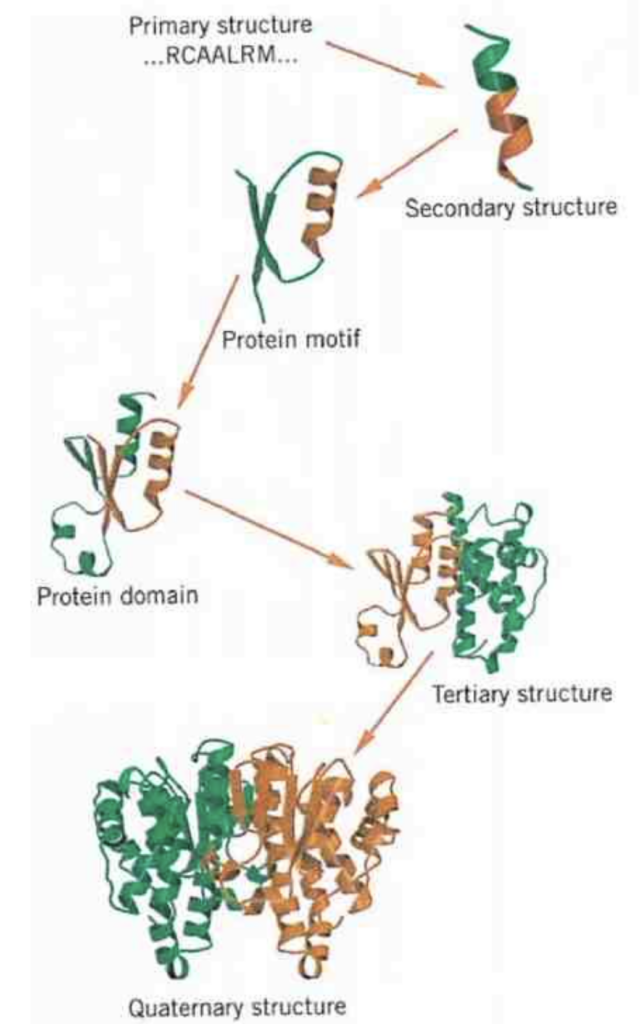
タンパク質の構造
タンパク質の構造は、以下の4つの階層に分けられます:
- 一次構造 (Primary Structure)
- 二次構造 (Secondary Structure)
- 三次構造 (Tertiary Structure)
- 四次構造 (Quaternary Structure)
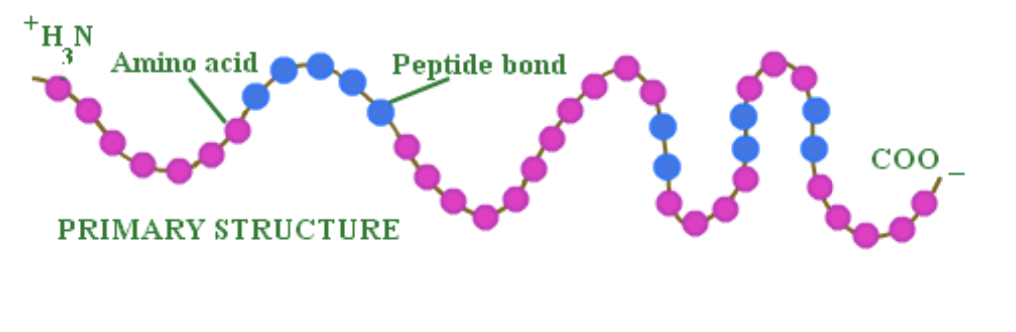
一次構造 (Primary Structure)
- 定義: 一次構造は、タンパク質のアミノ酸の直線的な配列を指します。この配列がタンパク質の基本的な構造を決定します。
- ペプチド結合 (Peptide Bonds):
- 役割: アミノ酸のα-アミノ基と別のアミノ酸のα-カルボニル基との間に形成される結合です。これにより、アミノ酸が連結されてポリペプチド鎖が形成されます。
- 特徴: ペプチド結合は非常に安定しており、加水分解や高温で強酸または強塩基に長時間さらされることでのみ切断されます。
ペプチド結合の特性
- 部分的な二重結合特性: ペプチド結合は部分的に二重結合の性質を持っており、このため結合は硬直し平面状になります。これにより、ペプチド鎖の柔軟性が制限され、特定の構造が安定します。
- トランス配置: ペプチド結合は通常トランス配置(アミノ酸の側鎖が反対側に配置される状態)で存在します。これにより、立体障害が最小限に抑えられ、構造が安定します。
二次構造 (Secondary Structure)
二次構造は、短いアミノ酸残基(3~30個)が幾何学的に整った単位に折りたたまれることで形成されます。一次構造のアミノ酸配列が近くに位置することによって生じる規則的な配列で、主に水素結合によって安定化します。
主な二次構造の2つの種類
- アルファヘリックス (Alpha-Helix)
- ベータシート (Beta-Sheet)
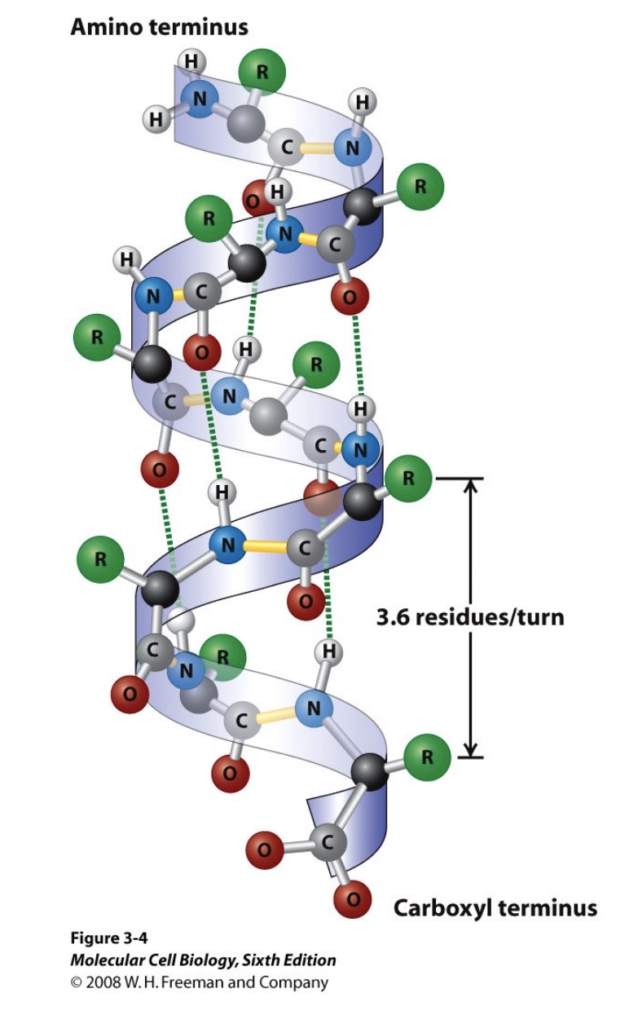
アルファヘリックス (Alpha-Helix)
- 特徴:
- 最も一般的な二次構造です。
- 右巻きの螺旋状にポリペプチド骨格が折りたたまれ、側鎖は外向きに伸びています。
- 一回の螺旋で3.6個のアミノ酸残基が含まれます。
- 安定化因子:
- 水素結合が螺旋の内側で形成され、アミノ酸の側鎖は螺旋の外側に位置します。
- 破壊因子:
- プロリン: 螺旋の柔軟性を損なうため、通常、アルファヘリックスには含まれません。
- 大きな側鎖 (例: トリプトファン): 側鎖が大きく、螺旋の安定性を損なうため。
- 荷電側鎖 (酸性/塩基性アミノ酸): 相互作用によって螺旋が不安定になります。
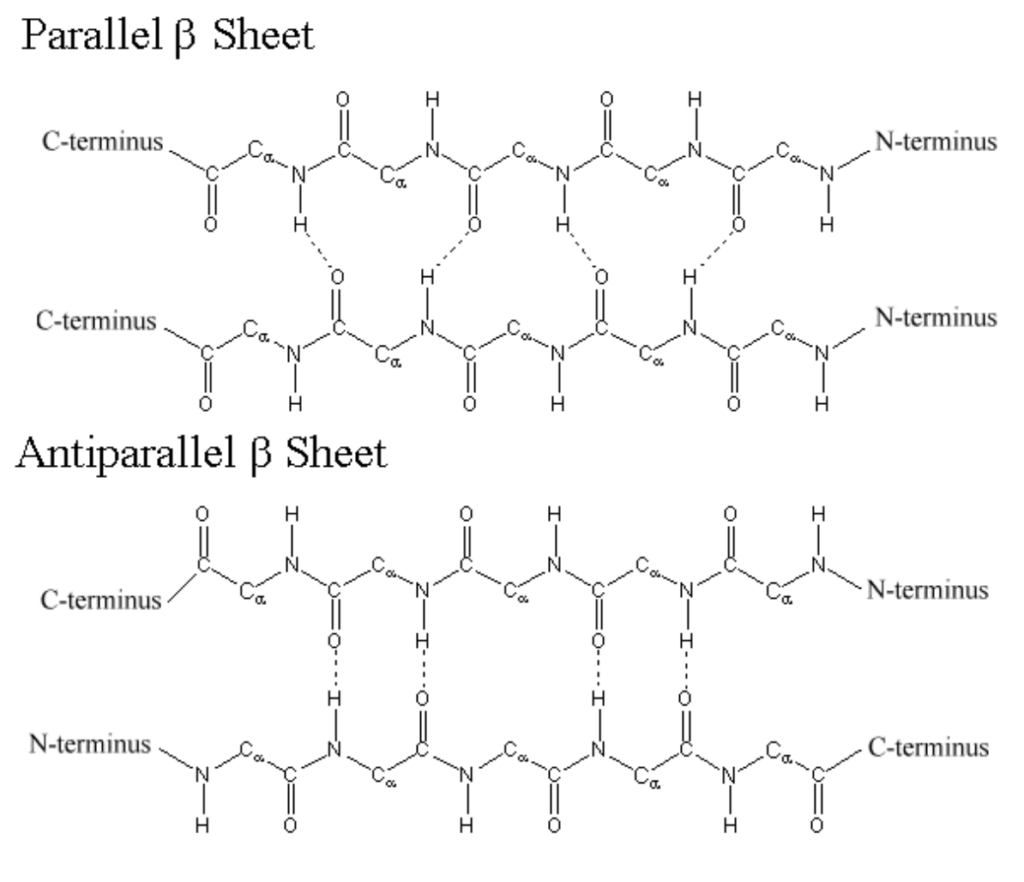
ベータシート (Beta-Sheet)
- 特徴:
- 表面が平坦でひだ状に見えます。
- 2つ以上のペプチド鎖が平行または反平行に配置されます。
- 安定化因子:
- 鎖間および鎖内の水素結合によって安定します。
- ベータシートは、アミノ酸残基が互いに向かい合うように配置されることで、構造的な安定性を確保します。
二次構造の他の形式
β-ベンド (Beta-bends)
- 特徴: ループやコイルのような非反復的な構造
- 説明: β-ベンドはポリペプチド鎖が急激に方向を変える部分で、しばしば機能的な役割を果たします。これにより、ポリペプチド鎖は他の二次構造と接触することができます。
モチーフやスーパーセカンダリ構造 (Motifs or Supersecondary Structures)
- 特徴: 隣接する二次構造の組み合わせ
- 説明: モチーフはアルファヘリックスやベータシートなどの基本的な二次構造が特定のパターンで組み合わさったものです。例えば、βαβユニット(アルファヘリックスとベータシートが交互に並んでいる構造)やβ-バレル(ベータシートが円筒形に折りたたまれた構造)があります。
| 特徴 | アルファヘリックス (Alpha Helix) | ベータシート (Beta Sheet) |
|---|---|---|
| 一般的な形 | 右巻きの螺旋 | 平らなシート |
| 水素結合の方向 | 螺旋に対して平行 | シートに対して垂直 |
| 一般的な例 | ケラチン (100% αヘリックス)、ヘモグロビン (80% αヘリックス) | アミロイド(アルツハイマー病)、免疫グロブリン |
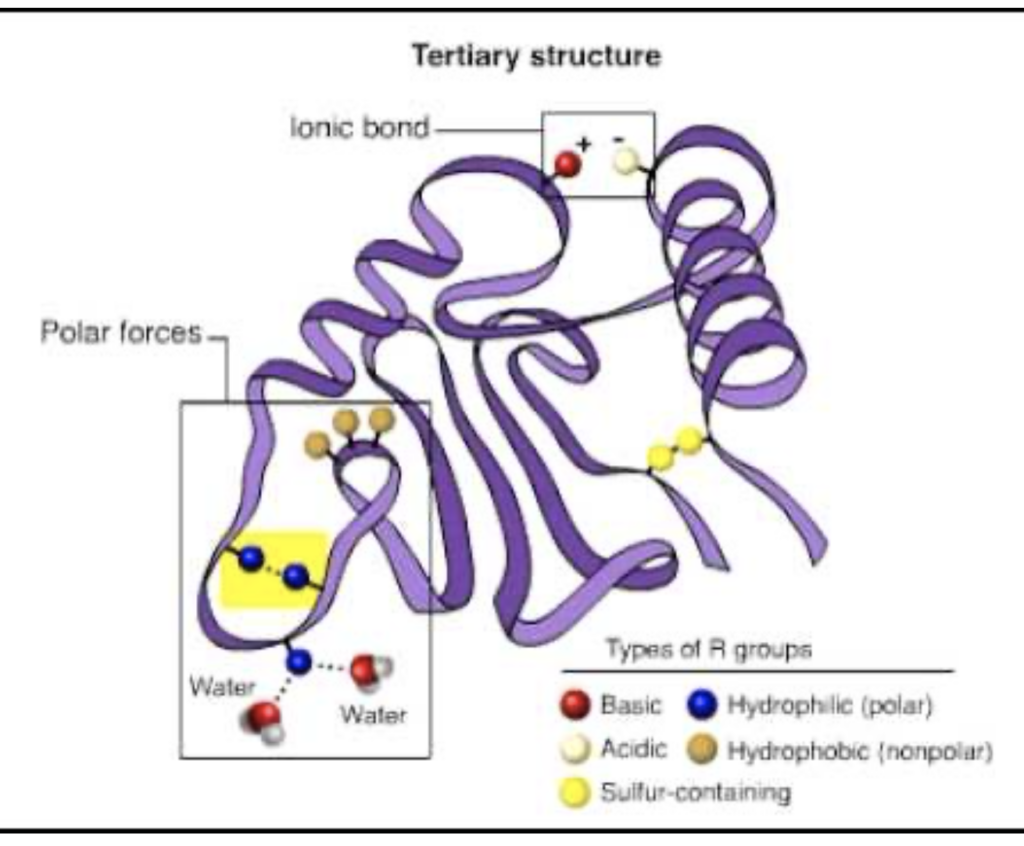
三次構造 (Tertiary Structure)
- 特徴: タンパク質の全体的な三次元的形状
- 例: グロブラータンパク質、線維性タンパク質
- 説明: 三次構造はポリペプチド鎖のドメインが折りたたまれた最終的な配置を指します。三次構造は以下の相互作用によって安定化されます:
- ジスルフィド結合 (Disulfide Bonds): システイン残基間で形成される共有結合
- 疎水性相互作用 (Hydrophobic Interactions): 疎水性アミノ酸側鎖が内側に集まることで安定化
- 水素結合 (Hydrogen Bonds): アミノ酸間の水素原子と酸素原子の相互作用
- イオン結合 (Ionic Bonds): 正負の電荷を持つアミノ酸残基間の相互作用
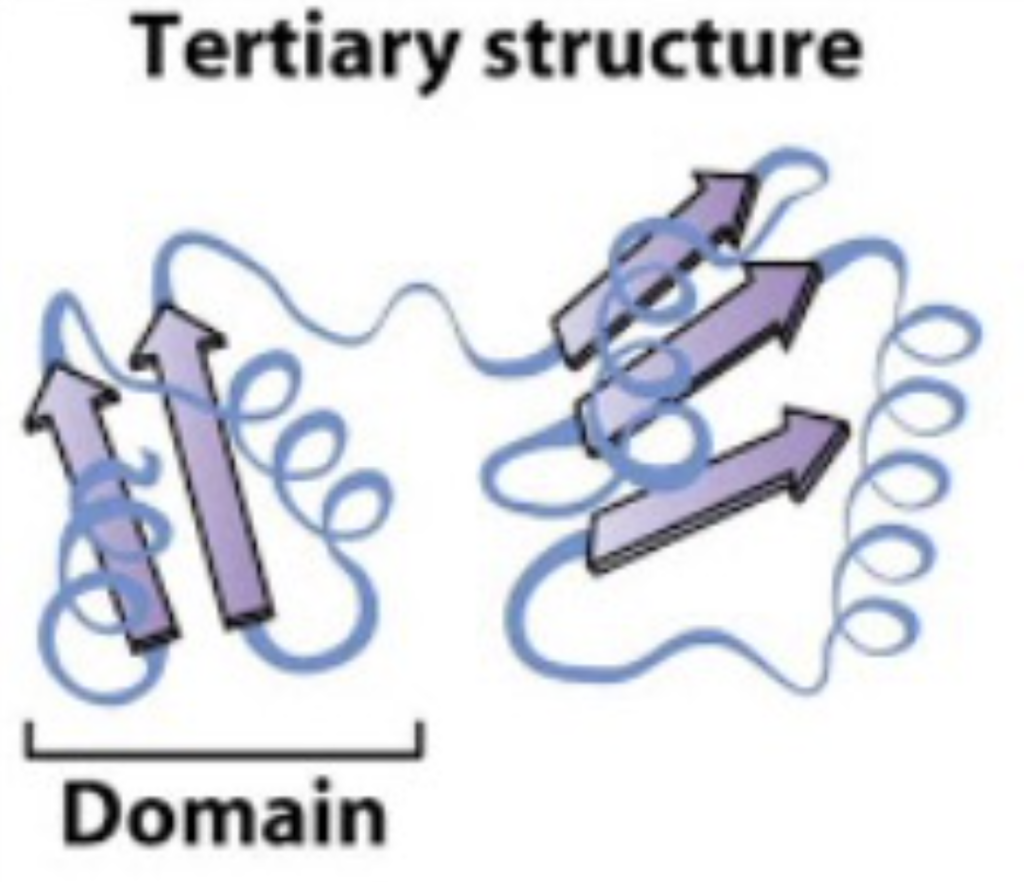
ドメイン (Domains)
- 特徴: ポリペプチドの基本的な機能的および三次元的構造単位
- 説明: ドメインは、モチーフ(二次構造の特定のパターン)の組み合わせによって形成される構造単位です。各ドメインは特定の機能を持ち、ポリペプチド鎖全体の構造と機能に寄与します。例えば、酵素の活性部位や結合部位などがドメインに含まれることがあります。
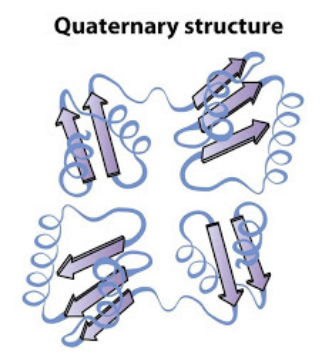
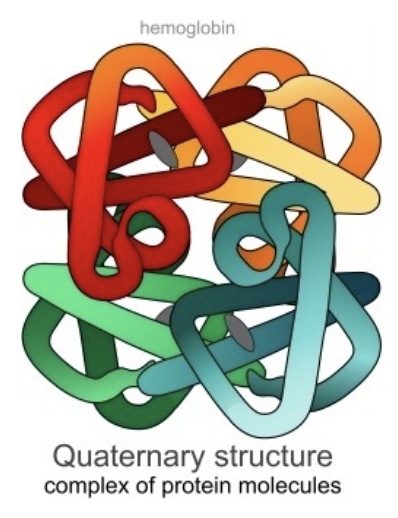
四次構造 (Quaternary Structure)
- 特徴: 複数のポリペプチド鎖からなるタンパク質の構造
- 説明: 四次構造は、複数のポリペプチド鎖(サブユニット)が相互に結合して形成される構造です。これらの鎖は、主に非共有結合(例: 水素結合、疎水性相互作用、イオン結合)によって結びついています。例えば、ヘモグロビンは4つのサブユニットから成る四次構造を持っています。
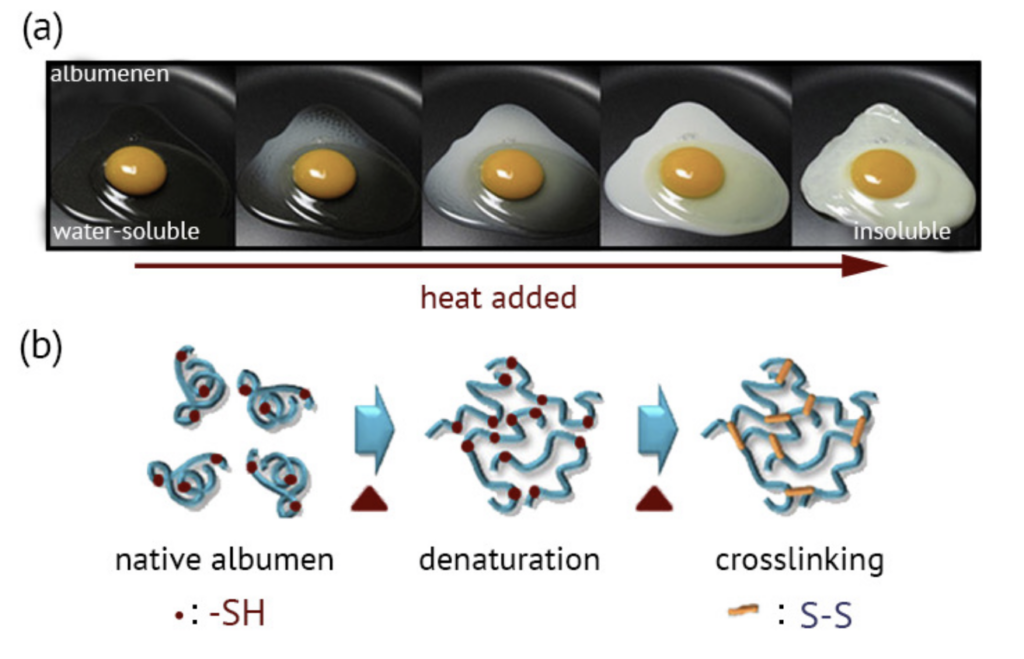
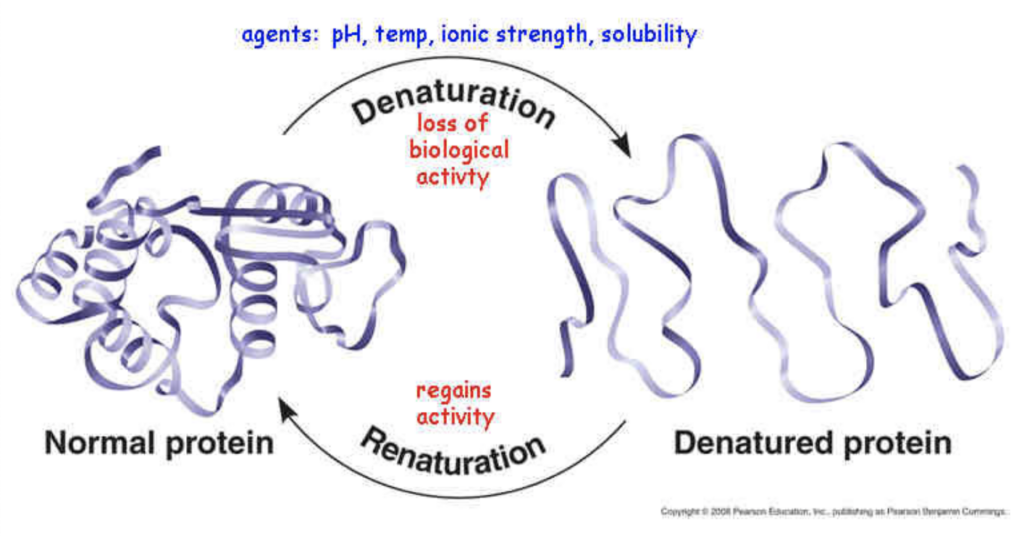
変性 (Denaturation)
- 特徴: タンパク質の構造が破壊される現象
- 説明: 変性は、タンパク質の立体構造が崩れて機能を失うことです。変性によってタンパク質が unfolded し、非機能的になります。変性は時に可逆的で、条件を戻すと元の構造に戻ることもありますが、完全に不可逆的な場合もあります。
- 変性の原因:
- 熱: 高温によりタンパク質の構造が破壊される。
- 有機溶媒: アルコールやアセトンなどの溶媒によってタンパク質が変性する。
- 機械的混合: 激しく攪拌すると構造が変化する。
- 強酸および強塩基: 極端なpHの変化がタンパク質の構造を破壊する。
- 洗剤: 界面活性剤が疎水性相互作用を破壊する。
- 重金属イオン: 鉛や水銀などのイオンがタンパク質に結合し、構造を変化させる。
臨床的関連
- プリオン病 (Prion Diseases)
- 説明: プリオンは異常な立体構造を持つタンパク質で、正常なタンパク質の構造を変性させることがあります。これにより神経変性が引き起こされ、例としてはクロイツフェルト・ヤコブ病や狂牛病があります。
- 伝播:
変換メカニズム: 異常なプリオンタンパク質(PrP^Sc)は、正常なプリオンタンパク質(PrP^C)の構造を変化させる「テンプレート」として作用します。このプロセスは「テンプレート誘導変換(template-induced conversion)」と呼ばれます。 - 蓄積:
異常なプリオンタンパク質は、神経細胞内に蓄積し、細胞の機能を障害します。蓄積した異常プリオンは、細胞膜に付着し、細胞間の信号伝達を妨げ、最終的には細胞死を引き起こします。
- アルツハイマー病 (Alzheimer’s Disease)
- 説明: アルツハイマー病は異常なタンパク質(アミロイドβやタウタンパク質)の蓄積が脳内で起こる神経変性疾患です。これにより脳の機能が低下し、記憶や認知機能が障害されます。


コメント